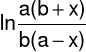Ćwiczenie 26
KINETYKA JODOWANIA ACETONU.
Cel ćwiczenia: Wyznaczenie stałej szybkości procesu jodowania acetonu katalizowanego jonami H+.
I. Wstęp teoretyczny:
Sumaryczne równanie reakcji jodowania acetonu można przedstawić następująco:
CH3-CO-CH3 + I2 → CH3-CO-CH2I + H+ + I- (1)
Stwierdzono, że reakcje między ketonami i chlorowcami (Cl2, Br2, I2) w środowisku wodnym są pierwszego rzędu względem ketonu i rzędu zerowego względem chlorowca. Zaobserwowano również, że szybkości procesu jodowania, chlorowania
i bromowania są identyczne. Wyniki te wskazują, że proces chlorowcowania ketonu jest dwuetapowy, a pierwszym stadium, które decyduje o szybkości reakcji jest enolizacja ketonu
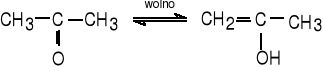
Aceton występuje zawsze w dwóch postaciach: ketonowej i enolowej.
W temperaturze pokojowej postać enolowa stanowi zaledwie 2,5 x 10-3 %.
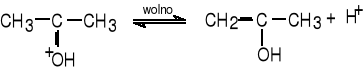
Proces enolizacji acetonu jest katalizowany przez kwasy i zasady. Schemat reakcji enolizacji w obecności jonów H+ przedstawiają reakcje:
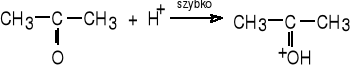
Utworzony enol reaguje z jodem I3- zgodnie z reakcją:
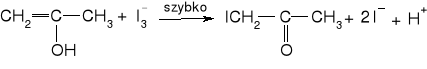
Rozpuszczalność I2 w czystej wodzie jest niewielka (ok. 1,2 x 10-3 mol dm-3 w temp. 200C), natomiast rozpuszcza się on dobrze w roztworze KI z utworzeniem I3-. Stała równowagi reakcji I2 + I- = I3- w temp. 250C wynosi K ≈ 800, dlatego w roztworze dominującym reagentem jest I3-.
Szybkość reakcji jodowania acetonu determinuje stężenie formy enolowej, natomiast szybkość procesu przegrupowania formy ketonowej w enolową nie zależy od stężenia I2, dlatego szybkość reakcji jodowania acetonu również nie zależy od stężenia jodu. Proces przegrupowania formy ketonowej w enolową jest katalizowany przez jony wodorowe, których stężenie zmienia się w tej reakcji, gdyż produktami reakcji, zgodnie ze schematem (1) są jony H+ oraz I-
W rezultacie szybkość całej reakcji zależy od stężenia acetonu i zmieniającego się
w reakcji stężenia jonów H+. Zgodnie ze schematem (1) zmniejszeniu stężenia acetonu o x moli odpowiada identyczne zwiększenie stężenia jonów H+, dlatego szybkość reakcji jodowania acetonu można wyrazić zależnością:
![]()
(2)
Po rozdzieleniu zmiennych i scałkowaniu otrzymujemy zależność:
![]()
(3)
w której a i b oznaczają początkowe stężenia acetonu i jonów wodorowych, natomiast x jest stężeniem produktu.
Postęp reakcji można śledzić poprzez odmiareczkowanie jodu roztworem tiosiarczanu sodu zgodnie z reakcją:
I2 + 2 Na2S2O3 → Na2S4O6 + 2 NaI (4)
Miareczkowanie prowadzi się wobec skrobi, która z wolnym jodem tworzy niebiesko zabarwiony kompleks.
II. Wykonanie ćwiczenia.
Pobrać zestaw w skład którego wchodzą: dwie kolby miarowe o poj.250 ml
i dwie erlenmayerki o poj.100 ml.Ustalić z asystentem temperaturę, w której należy wykonać ćwiczenie oraz ilość acetonu i mianowanego kwasu solnego. Należy przestrzegać proporcji 12,5 ml mieszaniny jodującej na 1 ml acetonu.
Do kolby miarowej o pojemności 250 cm3 odmierzyć dokładnie podane przez asystenta ilości roztworów kwasu i jodu. Mieszaninę rozcieńczyć wodą destylowaną tak aby do objętości 0,25 dm3 (do kreski) brakowało kilka cm3. Kolbę z roztworem wstawić do termostatu o temp. 250C na około 20 minut..
W kolbce Erlenmayera przygotować 25 ml 0,15 M roztworu NaHCO3.
Po ustaleniu się temperatury (ok. 20 minut) odmierzyć dokładnie pipetą podaną ilość acetonu i wlać ją do kolby znajdującej się w termostacie. Dopełnić jej zawartość wodą destylowaną do kreski, szybko lecz starannie wymieszać i umieścić ją z powrotem w termostacie.
Możliwie szybko pobrać próbkę mieszaniny reagującej pipetą o pojemności
25 ml i wlać do kolbki napełnionej uprzednio 25 cm3 0,15 M roztworu NaHCO3. (W tym roztworze jon H+ ulega zobojętnieniu i reakcja jodowania zostaje zahamowana). Zanotować czas pobrania tej próbki, przyjmując go za czas rozpoczęcia reakcji.Oznaczyć stężenie jodu w pobranej próbce roztworu za pomocą miareczkowania 0,02 M Na2S2O3. Gdy zabarwienie miareczkowanego roztworu staje się lekko żółte należy dodać skrobię -roztwór staje się granatowy. Koniec miareczkowania, gdy roztwór staje się bezbarwny.
Następne próbki pobierać w odstępach 15 minutowych, notując czas jaki upłynął od chwili rozpoczęcia reakcji do momentu jej zahamowania w badanej próbce.
Wyniki pomiarów notować w tabelce:
t [min.] |
Vt[ml] |
x |
a - x |
b + x |
|
|
|
|
|
|
|
|
|
|
|
|
|
III. Opracowanie wyników
Obliczyć stężenie początkowe acetonu a i kwasu b znając objętość acetonu Vacetonu i gęstość acetonu dacetonu oraz stężenie kwasu HCl cHCl.
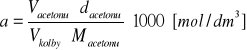
Macetonu= 58 g / mol
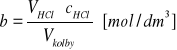
Wszystkie objętości V wyrażone są w cm3 .
Obliczyć ubytek stężenia acetonu x (= przyrostowi stężenia kwasu = ubytkowi stężenia jodu) po upływie czasu t w oparciu o wyniki miareczkowania. Ze stechiometrii reakcji redukcji jodu tiosiarczanem (równanie (4)) wynika, że ubytek stężenia I2 jest dwukrotnie mniejszy od ubytku tiosiarczanu, a więc od różnicy ilości moli Na2S2O3 zużytych na początku (V0) i po upływie czasu t (Vt) na zmiareczkowanie nadmiaru jodu:
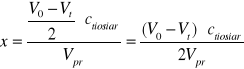
gdzie:
V0 i Vt - ilości Na2S2O3 zużyte na zmiareczkowanie 25 cm3 (Vpr) mieszaniny reagującej na początku reakcji (t=0) i po czasie t,
ctiosiar - stężenie Na2S2O3 w mol/dm3.
W celu wyznaczenia stałej szybkości należy dla każdego czasu t (moment pobierania kolejnych próbek) obliczyć wartość x, a-x, b+x oraz ![]()
Wykonać wykres
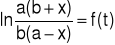
.Z wykresu wyznaczyć nachylenie prostej
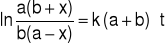
.
Współczynniki kierunkowy prostej obliczyć metodą najmniejszych kwadratów lub za pomocą arkusza kalkulacyjnego i wyznaczyć wartość stałej szybkości k.
1
Wyszukiwarka