Określenie rzędu reakcji i stałej szybkości reakcji
Doświadczalnie bada się przebieg reakcji mierząc przede wszystkim szybkość, z jaką reakcja zachodzi, oraz zależność tej szybkości od stężenia reagentów i od temperatury. Wszystkie te czynniki składają się na kinetykę reakcji. Nasze ćwiczenie polega na badaniu kinetyki reakcji chemicznej zmydlania octanu etylu na podstawie pomiarów zmiany stężenia substratu w funkcji czasu.
Równanie kinetyczne dowolnej reakcji chemicznej ma postać:
![]()
, T = const
gdzie: n może być zerem, liczbą całkowitą lub ułamkową dodatnią i oznacza rząd reakcji,
k - jest stałą reakcji,
t - czasem,
c - reprezentuje stężenie substratu c.
Reakcje chemiczne przebiegające często zgodnie z równaniem kinetycznym są rzędu zerowego (parametr n = 0). Szybkość reakcji nie zależy wówczas od stężenia substratu i dana jest wzorem:
![]()
, ![]()
, zatem ![]()
Wynika z tego, że stężenie substratu maleje liniowo z czasem.
Reakcja pierwszego rzędu to taka, której szybkość w danej temperaturze zależy jedynie od pierwszej potęgi stężenia pojedynczego reagenta. Oznaczając stężenie tego reagenta przez c i zakładając, że objętość układu pozostaje podczas reakcji stała, powstaje równanie kinetyczne pierwszego rzędu:
![]()
, ![]()
, zatem ![]()
Dane doświadczalne otrzymywane podczas badania szybkości reakcji stanowią zwykle wartości c lub jakiejś wielkości związanej z c w różnych chwilach. Najdogodniej jest porównywać te dane ze scałkowaną postacią równania kinetycznego pierwszego rzędu. Jeżeli stężenie początkowe wynosi c0,
a po pewnym czasie w chwili t stężenie to maleje do c, całkowanie daje wynik
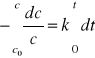
![]()
![]()
(2)
Można, więc stwierdzić, że dana reakcja jest reakcją pierwszego rzędu, jeżeli wykresem zależności ln(c/c0) w funkcji t jest linia prosta. Na podstawie nachylenia tej linii można wyznaczyć wartość stałej szybkości k. Reakcję uważa się za reakcje pierwszego rzędu, gdy ze wszystkich danych wynika jednakowa wartość k , tj., gdy k w równ.(2) jest wielkością stałą.
Reakcja zalicza się do reakcji drugiego rzędu, jeżeli jej szybkość jest proporcjonalna do kwadratu stężenia jednego z reagentów lub do iloczynu stężeń dwóch reagentów. Oba te przypadki opisuje to samo równanie, jeżeli obydwa substraty zużywają się z jednakową szybkością i jeżeli ich stężenia początkowe są równe, równanie to ma postać:
![]()
gdzie: c - oznacza stężenie pojedynczego reagenta lub jednego dwóch reagentów
W tym przypadku dane kinetyczne porównuje się ze scałkowaną postacią równania:
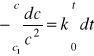
![]()
Reakcja rozważanego typu jest, więc reakcją drugiego rzędu, jeżeli zależność 1/c od t jest prostoliniowa. Nachylenie prostej równe jest stałej szybkości.
Reakcje trzeciego rzędu są reakcjami bardzo rzadkimi, znamy bardzo niewiele przykładów takich reakcji. Reakcje tlenku azotu w fazie gazowej stanowią jedyne dokładnie zbadane reakcje trzeciego rzędu, zachodzące z udziałem trzech cząsteczek.
np. reakcja gazowa 2NO + Cl2 = 2NOCl przebiega według równania kinetycznego:
![]()
Metody wyznaczania stałej rzędów reakcji:
Przypadek gdy początkowe stężenia substratów są jednakowe. Metoda prób i błędów. Rząd reakcji n można albo odgadnąć, albo w pewien sposób wyznaczyć. W metodzie tej zakładamy pewną wartość n i następnie z równania obliczamy k dla poszczególnych punktów pomiarowych. Jeśli wartości k są stałe to wybór był prawidłowy . Sprawdzenie poprawności doboru n można wykonać metodą graficzną. Metoda prób i błędów prowadzi szybko do sukcesu zazwyczaj wtedy, gdy rząd reakcji jest liczbą całkowitą.
Przypadek gdy początkowe stężenia substratów nie są jednakowe. Jeśli początkowe stężenia substratów nie są jednakowe, znajomość całkowitego rzędu reakcji nie wystarcza do opisu kinetyki reakcji chemicznej i trzeba kolejno wyznaczać rzędy względem poszczególnych reagentów. Ogólny sposób postępowania jest znany jako metoda izolacyjna Ostwalda.
W naszym ćwiczeniu będziemy korzystały z metody całkowej. Wyznaczamy stężenie substratu w funkcji czasu c = f (t) - wstawiamy do równania wartości zmieniającego się z biegiem czasu stężenia (zmienną niezależną jest tu więc czas), otrzymane punkty nanosimy na wykresie i sprawdzamy czy eksperymentalna krzywa kinetyczna ma kształt liniowy. Znając jej nachylenie obliczamy rząd reakcji. Tak wyznaczony rząd nazywamy rzędem względem czasu.
Opracowanie wyników
obliczenie stężenia c po czasie t
Reakcja przebiega zgodnie z równaniem:
CH3COOC2H5 + OH -![]()
CH3COO - + C2H5OH
Wartości zostały wyliczone ze wzorów i zależności:
![]()
n = Cm∙V = 0,0044 dm3 ∙ 0,1 mol/dm3 =4,4∙10-4 moli NaOH (ze miareczkowania)
Liczba moli NaOH ze zmiareczkowania odpowiada ilości moli HCl, który nie przereagował w czasie zatrzymania reakcji
nHCl = 0,01 dm3 ∙ 0,1 mol/dm3 = 1∙10-3 mol
nHCl przereagowane = 0,001 mol - 4,4∙10-4 mol= 5,6∙10-4 mol
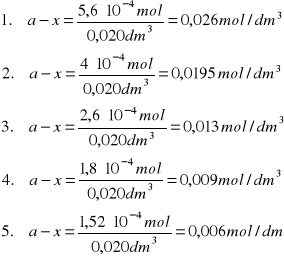
Czas t [min] |
Objętość 0.1M NaOH użytego do miareczkowania [cm3] |
x [mol/dm3] |
a - x [mol/dm3] |
b - x [mol/dm3] |
3 |
4,4 |
0,0220 |
0,0280 |
0,0280 |
6 |
6,0 |
0,0300 |
0,0200 |
0,0200 |
12 |
7,4 |
0,0370 |
0,0130 |
0,0130 |
24 |
8,2 |
0,0410 |
0,0090 |
0,0090 |
48 |
8,48 |
0,0424 |
0,0076 |
0,0076 |
96 |
8,48 |
0,0424 |
0,0076 |
0,0076 |
177 |
8,48 |
0,0424 |
0,0076 |
0,0076 |
1440 |
8,48 |
0,0424 |
0,0076 |
0,0076 |
a - początkowe stężenie NaOH [mol/dm3]
b - początkowe stężenie estru [mol/dm3]
x - ubytek NaOH lub estru po czasie t, x jest więc równe stężeniu produktu po czasie t
a - x - stężenie estru po czasie t
b - x - stężenie NaOH po czasie t
wyznaczenie rzędu reakcji
Reakcja zgodnie z obliczeniami przeprowadzonymi przez program komputerowy jest reakcją odwracalną rzędu drugiego (n=2.00). Wykres stężenia w funkcji czasu ma następującą postać:
wykres I:
wykres II:
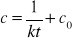
obliczenia stałej szybkości
Stała szybkości reakcji obliczana jest na podstawie wzoru dla reakcji drugorzędowej odwracalnej i jest przeprowadzana przez program obliczeniowy UNIRATE.
stężenie c [mol/dm3] |
czas t [min] |
stała k [dm3/mol∙min] |
0,028 |
3 |
5,272056 |
0,020 |
6 |
5,121952 |
0,013 |
12 |
5,216425 |
0,009 |
24 |
5,239786 |
0,0076 |
48 |
5,729934 |
II. Wnioski i dyskusja błędów
O nieprawidłowych wynikach ćwiczenia świadczy postać zależności c-1= f(t) otrzymanych na wykresie I (zależność liniowa występuje tylko w wybranych przedziałach czasu zamiast podczas całego pomiaru). Otrzymane błędy mogą być spowodowane jakością i czystością roztworów, błędem miareczkowania (w danym czasie pobiera się tylko jedną próbkę bez możliwości powtórzenia, ponieważ próbka pobrana trochę później już ma prawo dać inną ilość zużytego titranta).
Wartości stałej szybkości reakcji k najbardziej zbliżone są do siebie dla pierwszych czterech pomiarów, co widać na podstawie powyższych obliczeń i można to zaobserwować na wykresie I.
Wykres II przedstawia zmiany stężeń substratów i produktów w miarę upływu czasu reakcji, która dąży do stanu równowagi. Czas równowagi badanej reakcji ustala się po upływie około 40 minut - co na wykresie przedstawia się linią prostą.
Zarówno metoda graficzna (liniowy przebieg prostej) jak i całkowa potwierdzają drugorzędowy charakter reakcji.
- 2 -
Wyszukiwarka