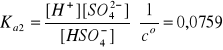
PROBLEMY OBLICZENIOWE i ZADANIA
Obliczyć stężenie jonów wodorowych i pcH w 0,25 M roztworze H2SO4. pKa2 = 1,12
Kwas siarkowy(VI) - H2SO4, mocny kwas dwuzasadowy
H2SO4 → H+ + HSO4-, pierwszy etap
HSO4- ↔ H+ + SO42-, drugi etap, Ka2 = 10-1,12 = 0,0759
Anion HSO4- jest kwasem średniej mocy, dlatego w drugim etapie dysocjacji H2SO4 ustala się stan równowagi ze stałą dysocjacji Ka2:
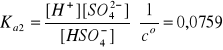
Bilans stężeń w stanie równowagi:
ck - analityczne stężenie kwasu siarkowego(VI)
[H+]1 = ck
[H+]2 = [SO42-]
[H+] = [H+]1 + [H+]2 = ck + [H+]2
[HSO4-] = ck - [H+]2
Aby obliczyć całkowite stężenie jonów wodorowych należy najpierw obliczyć z wyrażenia na Ka2 stężenie jonów wodorowych [H+]2 z drugiego etapu dysocjacji:
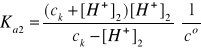
![]()
![]()
Δ = 0,106211+4∙0,018975 = 0,182111
Δ1/2 = 0,426745
![]()
[H+] = [H+]1 + [H+]2 = ck + [H+]2 = 0,250 + 0,0504 = 0,255 mol/dm3
pcH = - log 0,255 = 0,59
Dobrać współczynniki stechiometryczne w reakcji utleniania i redukcji:
Fe2+ + ClO- + H+ → Fe3+ + Cl- + H2O
Fe2+ →Fe3+ + 1e- /x2
Cl+ +2e-→Cl- /x1
2 Fe2+ + ClO- + 2H+ = 2 Fe3+ + Cl- + H2O
b) HCl + KMnO4 → Cl2 + MnCl2 + KCl + H2O
Cl- → ½ Cl2 + 1e- / x10
Mn7+ +5e- → Mn2+ /x2
16 HCl + 2 KMnO4 = 5 Cl2 + 2 MnCl2 + 2KCl + H2O
c) Cu2O + HNO3 → Cu(NO3)2 + NO + H2O
2 Cu+ →2 Cu2+ + 2e- /x3
N5+ + 3e- → N2+ /x2
3 Cu2O + 14 HNO3 → 6 Cu(NO3)2 + 2 NO + 7 H2O
d) Hg + NO3- + Cl- + H+ → HgCl42- + NO + H2O
(reakcja roztwarzania Hg w wodzie królewskiej)
Hg0 + 4 Cl- → HgCl42- + 2e- /x3
NO3- + 4 H+ + 3e- → NO + 2 H2O /x2
3Hg + 2NO3- + 12Cl- + 8H+ = 3HgCl42- + 2NO + 4H2O
e) NO2 + H2O → HNO3 + HNO2
N4+ → N5+ + 1e- /1x (utlenianie)
N4+ + 1e- → N3+ /1x (redukcja)
2 NO2 + H2O = HNO3 + HNO2
Obliczyć masę wodorotlenku sodu potrzebną do zobojętnienia 100 cm3 20,0% roztworu H2SO4
o gęstości d = 1,143 g/cm3.
V = 100 cm3 20,0% H2SO4, d = 1,143 g/cm3
MH2SO4 = 98,08 g/mol, MNaOH = 39,997 g/mol
mNaOH = ?
H2SO4 + 2 NaOH = Na2SO4 + 2H2O
nNaOH : nH2SO4 = 2 : 1 → nNaOH = 2∙nH2SO4
mH2SO4 = mroztworu∙p[%]/100 = V∙d∙ p[%]/100 = 100∙1,143∙20,0/100 = 22,86 g
nH2SO4 = mH2SO4/ MH2SO4 = 22,86/98,08 = 0,2331 mol
nNaOH = 2∙0,2331 = 0,4662 mol
mNaOH = nNaOH∙MNaOH = 0,4662∙39,997 = 18,6 g NaOH
Jaka objętość 0,50 M HCl jest potrzebna do całkowitego roztworzenia 2,45g cynku?
MZn = 65,39g/mol
cHCl = 0,50 mol/dm3, VHCl = ?
Zn + 2HCl = ZnCl2 + H2↑
nHCl : nZn = 2 : 1 → nHCl = 2nZn
nZn = mZn/MZn = 2,45/65,39 = 0,0375 mol
nHCl = 2∙0,0375 =0,0750 mol
nHCl = VHCl∙cHCl
VHCl = nHCl/cHCl = 0,0750/0,50 = 0,150 dm3 = 150 cm3
Jaka masa srebra wydzieli się na katodzie podczas elektrolizy roztworu AgNO3 w czasie 3 minut przy natężeniu prądu 1,5 A?
MAg =107,9 g/mol, F = 96485 C
Na katodzie zachodzi reakcja redukcji jonów Ag+:
Ag+ + e- = Ag0 (n = 1)
mAg = kAg·I·t
kAg = MAg/nF = 107,9/1·96485 = 0,0011183 g/C
mAg = 0,0011183·1,5·180 = 0,302g Ag
Jaka masa niklu wydzieli się na katodzie po upływie
5 minut w trakcie elektrolizy roztworu NiSO4 prądem
o natężeniu 1,2 A?
MNi = 58,69 g/mol, F = 96485 C
Na katodzie zachodzi reakcja redukcji jonów Ni2+:
Ni2+ + 2e- = Ni0 (n = 2)
mNi = kNi·I·t
kNi = MNi/nF = 58,69/2·96485 = 3,0414·10-4 g/C
mNi = 3,0414·10-4·1,2·300 = 0,109g Ni