Łoś Monika Poniedziałek, 12.15-16.00
Kowalczyk Katarzyna
Ryder Marta
Ćwiczenie 10
Degradacja polisacharydów
1. Wstęp teoretyczny
Skrobia jest polisacharydem roślinnym, składa się cząsteczek glukozy. Może tworzyć dwie struktury: amylozy i amylopektyny. Pierwsza podjednostka ma charakter liniowy i występują w niej wiązania glikozydowe typu α-1,4 , natomiast w drugiej podjednostce występują rozgałęzienia a występują w niej wiązania α-1,4 oraz α-1,6.
Degradacja skrobii zachodzi w środowisku kwaśnym, alkalicznym lub pod wpływem działania odpowiednich enzymów. Podstawową reakcją degradacji skrobii jest hydroliza kwasowa, jednakże efekt działania tego procesu jest znacznie mniej wydajny niż metoda enzymatyczna.
W trakcie hydrolizy kwasowej skrobia rozpada się na coraz krótsze łańcucht tworząc kolejno:
amylodekstryny (barwiące się z I2 na fioletowo),
erytrodekstryny (barwiące się z I2 na czerwono-brązowe),
achrodekstryny (niebarwiące się z I2) i
maltozę i glukozę.
Podczas hydrolizy kwasowej może zachodzić wiele reakcji ubocznych, co znacznie obniża wartość glukozy. Rozkład enzymatyczny jest bardziej specyficzny i przebiega w łagodnych warunkach pH i temperatury.
Enzymy degradujące skrobię można podzielić na trzy zasadnicze grupy:
upłynniające
np. α-amylaza - enzym, który działa na wiązania α-1,4 w sposób przypadkowy (aby działał na fragment dekstryny musi zawierać przynajmniej 6 merów), enzym ten obniża lepkość i zwiększa reduktywnośćzcukrzające
np. glukoamylaza - enzym, który działa od nieredukującego końca, działa przede wszystkim na wiązania α-1,4 oraz nieco wolniej działa także na wiązania α-1,6
np. β-amylaza - enzym działający na wiązania α-1,6 odrywa od łańcucha skrobiowego cząsteczki maltozy i przekształca je w β-maltozę.znoszące rozgałęzienia
np. pululanaza -enzym hydrolizujący wiązanie α-1,6 znosząc rozgałęzienia łańcucha polisacharydowego
2. Cel ćwiczenia
Celem ćwiczenia było zbadanie dynamiki reakcji degradacji skrobii, wyznaczenie współczynnika DE dla różnych preparatów enzymatycznych oraz różnych stężeń początkowych skrobii.
3. Wykonanie ćwiczenia
Preparaty enzymatyczne stosowane przez poszczególne grupy:
stół I - enzym: H-zyme
stół II - enzym: Amylogal CS
stół III - enzym: Termamyl
stół IV - enzym: glukoamylaza
Poszczególne zespoły badały różne preparaty enzymów dla roztworów skrobi o stężeniach: 10% i 15%.
Do zlewki odważono odpowiednio 5g(10%) lub 7.5g(15%) skrobi. Kolejno dodano do niej odpowiednio - 45 lub 42,5 ml buforu fosforanowego o pH 6. Zawiesinę wymieszano i skleikowano w łaźni wodnej. Uzyskany roztwór chłodzono i umieszczano w łaźni wodnej o temperaturze 40oC.
Jednocześnie do kolby o pojemności 250cm3 dodano 5ml roztworu CuSO4 , 5ml roztworu winianu sodowo-potasowego, 10ml wody destylowanej oraz kamyczek grzejny. Przygotowano także cylinder z 24 ml wody destylowanej.
Następnie rozpoczęto pomiary próby zero (t=0). W tym celu do zlewki, w której znajdował się roztwór skrobi o temperaturze 40ºC dodano 1ml badanego enzymu. Wymieszano i możliwie najszybciej pobrano 1ml roztworu, który dodano do cylindra z wodą. Mieszaninę energicznie wymieszano.
Z cylindra pobrano 5 ml roztworu, które dodano do wcześniej przygotowanej mieszaniny reakcyjnej w kolbie. Roztwór doprowadzono do wrzenia i utrzymywano go tak przez po 2 minuty. Po tym czasie chłodzono go i dodano 5ml roztworu KJ oraz 5ml 5% H2SO4. Próbę miareczkowano Na2S203 do uzyskania barwy mlecznej, wobec barwnika, którym była skrobia.
Kolejne próby, z którymi postępowano analogicznie, pobierano po upływie 20, 40 oraz 60 minut.
Nasza grupa przeprowadzała doświadczenie z zastosowaniem enzymu
H-zyme przy stężeniu skrobi 15%.
4. Wyniki
Do obliczeń posłużyła różnica objętości tiosiarczanu sodu zużyta do zmiareczkowania próby zero oraz objętości titrantu zużytego do zmiareczkowania próby. Odczytywano dla niej z tabeli zawartej w normie
PN-70/A-74701 ilość cukrów redukujących wyrażonych jako glukoza.
4.1 Tabela 1
Próba |
Objętość zużytego titranta |
Różnica objętości Na2S203 |
Ilość cukrów redukujących (a) |
0 |
12,7 |
---- |
---- |
1 |
10,2 |
2,5 |
7,58 |
2 |
9,6 |
3,1 |
9,72 |
3 |
9,4 |
3,3 |
10,36 |
Ilość cukrów redukujących obliczano ze wzoru:
![]()
,
gdzie
a - ilość mg glukozy, odczytana z tabeli,
b - objętość kolby miarowej z rozpuszczoną mieszaniną reakcyjną (25cm3),
c - objętość badanego roztworu zużytego do analizy (5cm3).
![]()
Wartość DE, określającego procentową zawartość cukrów redukujących w suchej substancji mleczka skrobiowego, w przeliczeniu na glukozę, obliczano ze wzoru:
![]()
,
gdzie
s - sucha substancja mleczka skrobiowego:
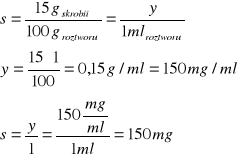
Analogiczne obliczenia przeprowadzono dla stężenia początkowego10%.
x - jak ustalono wyżej.
Więc:
![]()
Przykład obliczenia dla próby 1:
![]()
Zestawienie obliczeń współczynnika DE ze wszystkich grup:
4.2 Tabela 2
ENZYM |
SKROBIA [%] |
20' |
40' |
60' |
H-zyme |
10 |
42,3 |
53,4 |
76,2 |
|
15 |
25,3 |
32,4 |
34,5 |
Amylogal CS |
10 |
20,7 |
29,95 |
43,9 |
|
7,5 |
4,2 |
13,8 |
14,9 |
Termamyl |
10 |
16,8 |
28,0 |
35,4 |
|
15 |
3,13 |
6,4 |
15,8 |
glukoamylaza |
10 |
7,95 |
28,4 |
34,6 |
|
15 |
5,3 |
12,7 |
16,9 |
4.3 Wykres
Wykres sporządzony został dla enzymów: H-zyme i glukoamylazy, działających przy stężeniu skrobi równym 10%.
5. Wnioski
Enzymatyczna metoda degradacji skrobi jest skuteczniejsza przy niższym stężeniu skrobi, to jest równym 10%, aniżeli przy stężeniu 15%. DE dla mniejszego stężenia jest przy zastosowaniu każdego enzymu większe. Spowodowane to jest faktem, że w roztworach o mniejszym stężeniu więcej cząsteczek enzymu przypada na cząsteczkę skrobi.
W czasie wartości DE rosną. Wzrost ten początkowo jest wyraźniejszy dla glukoamylazy, niż dla pozostałych enzymów. Najbardziej wydajnym enzymem jest H-zyme. Jest on najlepiej oczyszczonym preparatem. Enzymy: H-zyme, Amylogal CS i Termamyl są to preparaty z przewagą α-amylazy. Enzymy Amylogal CS i Termamyl mają porównywalną aktywność, a różnice w wynikach spowodowane są tym, że optymalna temperatura działania Termamylu wynosi 60oC, a nasze doświadczenie przeprowadzane było w temperaturze 40oC. Najmniejszą aktywność wykazuje glukoamylaza.
Wyszukiwarka