Ćwiczenie nr 28
WYZNACZANIE PUNKTU
IZOELEKTRYCZNEGO AMFOLITU
Celem ćwiczenia jest wyznaczenie punktu izoelektrycznego amfolitu, czyli wartości pH, przy której stężenie postaci RH2+ i R- amfolitu są równe.
Aparatura i szkło: Odczynniki:
PH-metr z elektrodą kombinowaną 0.05 M NaOH
Mieszadło magnetyczne 0,05 M HCl
Biureta 0,005 M NH2CH2COOH
Zlewki o poj. 150 cm3
WYKONANIE ĆWICZENIA:
Zmontować układ do miareczkowania pH-metrycznego.
2. Do zlewki o poj. 150 cm3 wlać 100 cm3 kwasu aminooctowego. Zlewkę z roztworem umieścić na podstawie mieszadła magnetycznego, zanurzyć elektrodę kombinowaną i mieszalnik i rozpocząć miareczkowanie roztworu, spuszczając z biurety po 1 cm3 0,05 M HCl (łącznie 10 cm3). Po dodaniu kolejnej objętości titranta odczytać wartość pH.
3. Roztwór amfolitu (przygotowany analogicznie jak w pkt. 2) miareczkować 0,05 M NaOH, dodając po 1 cm3 z biurety (łącznie 10 cm3). Po dodaniu kolejnej objętości titranta odczytać wartość pH.
Wyniki pomiarów i obliczeń zestawić w tabelach:
VNaOH lub VHCl [cm3] |
pH |
[H+] 103 lub [OH¯] |
cA 103 [mol dm-3] |
cZ 103 lub cK 103 [mol dm-3] |
pK |
|
|
|
|
|
|
OPRACOWANIE WYNIKÓW:
Na podstawie pomiarów pH kwasu aminooctowego, miareczkowanego roztworami HCl i NaOH, obliczyć wartości pK1 i pK2 ze wzorów:
pK1 = pH + log 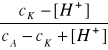
,
pK2 = pH + log 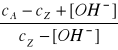
,
gdzie: cA - całkowite stężenie amfolitu,
cK - stężenie kwasu (HCl),
[H+] - stężenie jonów wodorowych,
cZ - stężenie zasady (NaOH),
[OH¯] - stężenie jonów hydroksylowych.
Wyniki obliczeń zestawić w tabelach (jak wyżej).
Obliczyć pH punktu izoelektrycznego amfolitu według wzoru, podstawiając średnie wartości pK1 i pK2 :
pHizoel. = ![]()
(pK1 + pK2)
Przeprowadzić dyskusję otrzymanych wyników.
Wyszukiwarka