![]()
Dominika Polka
Wydział Biotechnologii i Nauk o Żywności
Biotechnologia
Grupa 4, semestr III
Czwartek 8.00-12.00
20
Laboratorium Chemii Fizycznej
Ćwiczenie nr 59
Temat: Wyznaczanie standardowej siły elektromotorycznej ogniwa
Część teoretyczna.
ogniwo elektrochemiczne - układ w którym wymiana elektronów pomiędzy reagentami zachodzi poprzez przewodnik zamykający obwód między elektrodami.
SEM ogniwa (siła elektromotoryczna) - jest to potencjał elektrostatyczny drutu przyłączonego do elektrody znajdującej się na schemacie ogniwa po stronie prawej, mierzony w stanie równowagi względem potencjału drutu z tego samego metalu, przyłączonego do elektrody lewej.
potencjał standardowy elektrody - jest to siła elektromotoryczna ogniwa zbudowanego w taki sposób, że lewym półogniwem jest standardowa elektroda wodorowa, a prawym badana elektroda. W związku z tym, że wartość potencjału standardowej elektrody wodorowej została przyjęta jako wzorcowa, równa zero, to mierzona siła elektromotoryczna jest równa potencjałowi standardowemu elektrody badanej
ogniwo to zbudowane jest z elektrod: chlorosrebrowej i chinchydronowej:
Ag, AgCls, HCl(m), C6H4O2, C6H6(OH)2, Pt
Zachodzą w nim następujące reakcje:
na elektrodzie chlorosrebrowej
2 Ag(s) + 2Cl-(aq) => 2 AgCl + 2e
na elektrodzie chinchydronowej (chinhydron jest równomolową mieszaniną chinonu C6H4O2 i hydrohinonu C6H6(OH)2:
C6H4O2 + 2H+ + 2e => C6H6(OH)2
sumaryczna reakcja w ogniwie:
2 Ag(s) + 2Cl-(aq) + C6H4O2(aq) + 2H+(aq) = 2 AgCl(s) + C6H6(OH)2(aq)
równanie Nernsta zgodnie z którym wyznacza sie siłę elektromotoryczną tego ogniwa:
![]()
gdzie:
γ±- średni jonowy współczynnik aktywoności ![]()
dla HCl
m±- średnia jonowa molarność HCl ![]()
F - stała Faradaya, ![]()
R- stała gazowa, R=8,314 J/K*mol
T - temperatura wyrażona w kelwinach
E0- standardowa siła elektromotoryczna
dla małych mocy jonowych, średni jonowy współczynnik γ± można obliczyć z granicznego prawa Debaye'a-Huckel'a. Dla ekektrolitu (1:1), gdy spełniona jest równość l=m, graniczne prawo Debaye'a-Huckel'a przyjmuje postać:
![]()
siłę elektromotoryczną ogniwa E0 można wyznaczyć z zależności prostoliniowej:
![]()
2. Cześć eksperymentalna.
Lp. |
Stężenie HCl [mol/dm3] |
SEM [V] |
|||
|
|
E1 |
E2 |
E3 |
Eśr |
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
4 |
|
|
|
|
|
5 |
|
|
|
|
|
6 |
|
|
|
|
|
7 |
|
|
|
|
|
3. Opracowanie wyników.
c |
√c |
Eśr |
y= Eśr-0,118 log c |
[mol/dm3] |
- |
[v] |
[v] |
0,00625 |
0,07906 |
0,179 |
0,4391 |
0,0125 |
0,1118 |
0,193 |
0,4176 |
0,025 |
0,1581 |
0,2015 |
0,3905 |
0,05 |
0,2236 |
0,2213 |
0,3748 |
0,1 |
0,3162 |
0,2443 |
0,3623 |
Wykres zależności:
![]()
Ekstrapolacja prostej:
![]()
Ekstrapolowana wartość y, kiedy ![]()
:
Eo=y=![]()
[V]
Obliczenie teoretycznej wartości Eo:
ΠoAgCl=0,222 V
ΠoCh= 0,699 V
Zgodnie ze schematem ogniwa:
Ag| AgCl| HCl(m)|Q, QH2| Pt
Eo= ΠoCh- ΠoAgCl=0,699-0,222=0,477 V
4. Rachunek błędu.
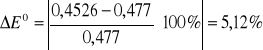
5. Uwagi i wnioski.
Zmierzona wartość obarczona jest niewielkim błędem. Moim zdaniem wynika on zarówno z metody pomiaru i obliczeń, jak również z błędu wykonania pomiaru. Z metody dlatego, że ekstrapolacja stanowi przybliżenie i powoduje błąd sama z siebie. Błąd wykonania pomiaru może wynikać z zbyt krótkiego czasu od wstawienia elektrody do próbki do pomiaru, w wyniku czego wskazanie woltomierza mogło nie uzyskać dostatecznego stanu równowagi, gwarantującego poprawny odczyt. Również stężenia przygotowywanych roztworów mogły charakteryzować się lekkim błędem w stosunku do zadanej wartości, aczkolwiek błąd ten, spowodowany niedokładnością stężenia uważam za bardzo mały.
![]()
![]()