PK WIiTCh Grupa 34 Zespół nr1 |
Ćwiczenie 6 |
Data: 27.11.2003 |
|
Równowagi pH w roztworach buforowych |
Ocena: |
1. Część teoretyczna
Stała dysocjacji słabego jednozasadowego kwasu RH jest równa:
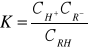
Dysocjację tego kwasu można cofnąć wprowadzając do roztworu sól powstałą z tego kwasu i mocnej zasady. Stężenie anionów soli w roztworze jest tak duże w porównaniu ze stężeniem tych anionów pochodzących z kwasu, że to ostatnie możemy pominąć i napisać:
![]()
Stężenie niezdysocjowanego kwasu natomiast tak mało różni się od stężenia całkowitego, że nie popełniając poważniejszego błędu możemy napisać:
![]()
Podstawiając wyżej wymienione zależności do wzoru na stałą dysocjacji otrzymujemy:
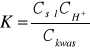
Gdy zmierzone wartości pH wykreśli się w zależności od ![]()
otrzymuje się, zgodnie z równaniem, prostą, której wartość odciętej dla ![]()
daje szukaną wartość stałej dysocjacji K.
Gdy do roztworu buforowego dodamy mocnego kwasu o stężeniu CHCl, to pH tego roztworu wyniesie:
![]()
a jony wodorowe pochodzące z jego dysocjacji zostaną usunięte w reakcji:
R- + H+ = RH + H2O
Zatem ΔpH po dodaniu HCl będzie równa:
![]()
,
natomiast w roztworze niezbuforowanym:
![]()
gdzie J - iloczyn jonowy wody
Roztwór, dla którego Csól=Ckwas ma najlepsze własności buforujące. Oznaczając Ckwas+Csól=C oraz Csól/Ckwas=x mamy:
![]()
Minimum ΔpH otrzymuje się dla x=1, gdy CHCl<<C.
2. Część praktyczna
2.1 Sporządzamy bufor octanowy korzystając z 0.1M CH3COOH
i 0.1M CH3COONa oraz bufor fosforanowy korzystają z 0,1M KH2PO4 i 0,1M Na2HPO4 wg następującego przepisu:
Nr roztworu |
CH3COOH [cm3] |
CH3COONa [cm3] |
przewidywane pH |
1 |
20 |
20 |
4.7 |
2 |
20 |
60 |
5,2 |
3 |
30 |
10 |
4.3 |
4 |
20 |
20 |
7,2 |
5 |
20 |
60 |
7,7 |
6 |
30 |
10 |
6,7 |
7 |
Roztwór(1)rozcieńczony 10 razy |
- |
|
8 |
Roztwór(4)rozcieńczony 10 razy |
- |
|
2.2 Kalibrujemy pH - metr za pomocą wzorcowego roztworu buforowego o pH=7
2.3 Mierzymy pH sporządzonych roztworów buforowych za pomocą pH - metru.
Nr roztworu |
zmierzone pH |
1 |
4.47 |
2 |
5,43 |
3 |
4,02 |
4 |
6,93 |
5 |
7,40 |
6 |
6,43 |
7 |
4,42 |
8 |
6,92 |
2.4 Badamy pojemność buforową dwóch wybranych roztworów buforowych o objętości 34,5cm3 przez zmierzenie ich pH po dodaniu HCl:
|
pH |
|
|
roztwór 2a |
roztwór 5a |
bez HCl |
5,43 |
7,40 |
0.5 cm3 0.1m HCl |
4,87 |
7,37 |
0.5 cm3 1m HCl |
4,11 |
5,32 |
3. Wyniki badań i obliczenia
3.1 Wykreślamy dla roztworów buforowych funkcję pH = f(lg x). Z otrzymanej prostej wyznaczamy stałą dysocjacji K (dla Csól/Ckwas=1) słabego kwasu CH3COOH.
-lgK = 4,64
K = 2,2*10-5
3.2 Wykreślamy dla roztworów buforowych funkcję pH = f(lg x). Z otrzymanej prostej wyznaczamy stałą dysocjacji K (dla Csól/Ckwas=1) słabego kwasu KH2PO4.
-logK=6,92
K=1,2*10-7
3.3 Obliczamy teoretyczne pH roztworów buforowych po dodaniu HCl i porównujemy z wartościami zmierzonymi oraz wykreślamy zależność pHteor.=f(pHdośw.).
|
pH |
ΔpH |
||
|
wartość teoretyczna |
wartość zmierzona |
wartość teoretyczna |
wartość zmierzona |
roztwór 2a |
||||
bez HCl |
5,2 |
5,43 |
- |
- |
0.5 cm3 0.1m HCl |
4.80 |
4,87 |
0,4000 |
0.56 |
0.5 cm3 1m HCl |
4.74 |
4,11 |
0,0596 |
0.76 |
roztwór 5a |
||||
bez HCl |
7,7 |
7,40 |
- |
- |
0.5 cm3 0.1m HCl |
7,21 |
7,37 |
0.4913 |
0.03 |
0.5 cm3 1m HCl |
7,20 |
5,32 |
0,0120 |
2,05 |
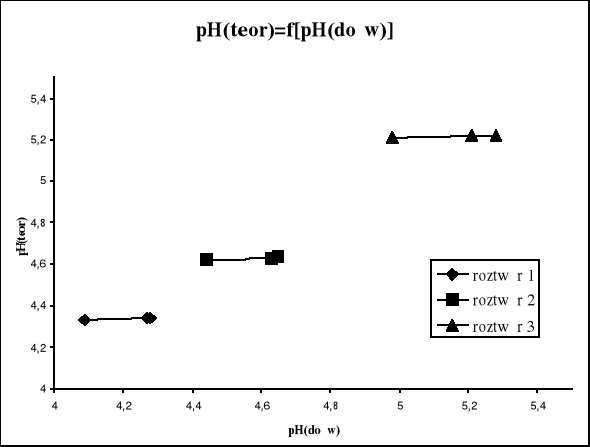
3.4 Obliczamy ΔpHteor. i wykreślamy ΔpH = f(-lgx) oraz nanosimy na tę krzywą ΔpHdośw..
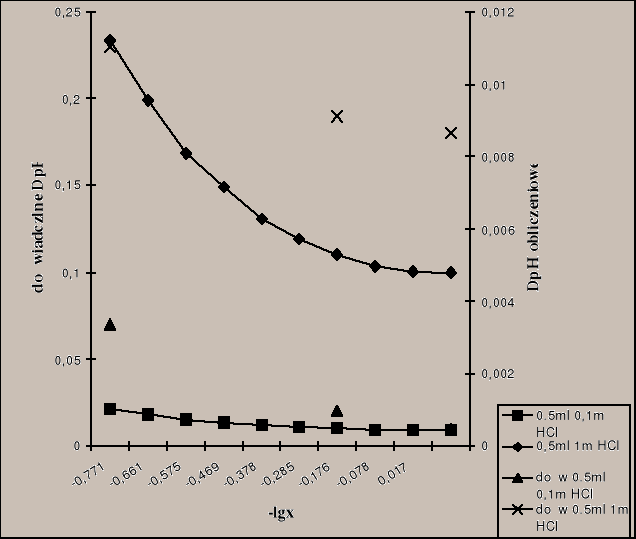
3.5 Wykreślamy zależność β(pH), gdzie ![]()
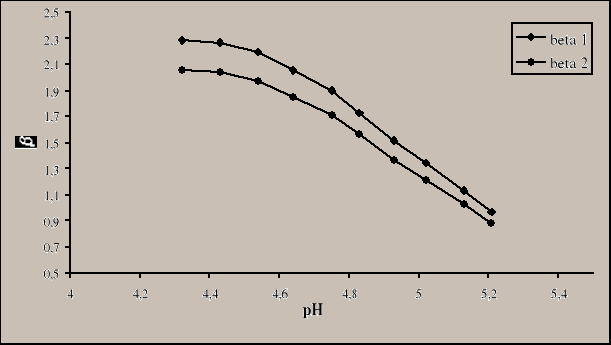
4. Wnioski
Zmierzone wartości pH roztworów buforowych różnią się od przewidywanych, ponieważ nie wykonaliśmy roztworów z precyzją analityczną i ich stężenie nie było analitycznie określone, pozatym przy pomiarze pH buforów na elektrodzie mogły się znajdować niewielkie ilości jonów H+ przez co zmierzone pH mogło być niedokładnym pH buforu te przyczyny również powodują że stałe K różnią się od tablicowych.
Wyszukiwarka