Kamil Dobrzyń gr. 3
Ćwiczenie 27: Wyznaczanie stosunku ![]()
dla powietrza.
Gaz doskonały to fikcyjny, idealny gaz, którego cząsteczki są nieskończenie małe i nie zachodzi między nimi wzajemne przyciągania, ani nie występują w nich drgania wewnętrzne.
Dla powyższego gazu energia wewnętrzna U jest równa sumie energii kinetycznej ruchu postępowego i obrotowego cząsteczek. Aby obliczyć tą energię trzeba skorzystać z pojęcia stopni swobody, czyli liczby niezależnych współrzędnych określających położenie cząsteczki w przestrzeni. I tak dla cząsteczek jednoatomowych stopień swobody i=3 odpowiadające trzem współrzędnym przestrzennym bądź też trzem składowym prędkości. Cząsteczka dwuatomowa posiada pięć stopni swobody (i=5), ponieważ do trzech stopni swobody ruchu postępowego dochodzą dwa stopnie swobody związane z obrotem cząsteczki jako ryły sztywnej wokół dwóch prostopadłych względem siebie osi. Cząsteczki trój- lub więcej atomowa posiada sześć stopni swobody (i=6) ponieważ dla takich cząsteczek możliwe są 3 osie obrotu.
Wzór ogólny na obliczenie energii kinetycznej cząsteczek:
(1) ![]()
; gdzie:
i- stopień swobody
k- stała Boltzmanna
T- temperatura w Kelwinach
Dla jednego mola gazu jego energia wewnętrzna U jest równa:
(2) U=NE; gdzie:
N- liczba Avogardo
E- energia jednej cząstki
Więc wyprowadzając:
(3) ![]()
, gdyż: ![]()
R- stała gazowa
Ilość energii potrzebna do odniesieni temperatury jednego mola cząsteczek o jeden Kelwin nosi nazwę ciepła molowego danej substancji.
Ciepło molowe danej substancji zależy od warunków, w jakich gaz jest ogrzewany, i tak w przypadku ogrzewania izochorycznego, gdzie nie zmienia się objętość (V) dostarczone ciepło służy do zwiększenia energii wew. gazu. Ponieważ V= const. Praca sił wewnętrznych gazu równa jest zeru. W tym przypadku mamy do czynienia z ciepłem molowym przy stałej objętości Cv.
Gdy ogrzewamy gaz pod stałym ciśnieniem- przemiana izobaryczna- ciepło zostaje zużyte dodatkowo na wykonanie pracy przeciw siłom zewnętrznym- gaz rozszerza się (gdyż p=const.). Mamy wtedy doczynienia z ciepłem molowym przy stałym ciśnieniu Cp.
Cv można określić jako stosunek przyrostu energii wewnętrznej jednego mola gazu do zmiany temperatury wywołanej tym przyrostem.
(4) ![]()
; gdy ![]()
otrzymujemy:
(5) ![]()
Cp jest większe od Cv o pracę W, wykonana przez mol gazu przy rozszerzaniu się podczas wzrostu temperatury o 1 stopień.
(6) Cp=Cv+W
Praca wykonana przy zwiększaniu objętości:
(7) W= p![]()
=p(V2-V1);
Za równaniem Clapeyrona:
(8) pV1=RT; pV2=R(T+1), więc W=R(T+1)-RT=R
Wynika z tego, że stała gazowa R jest liczbowo równa pracy wykonanej przez jeden mol gazu pod stałym ciśnieniem przy podwyższaniu temperatury układu o jeden Kelwin, więc:
(9) Cp= Cv+ R; podstawiając za Cv:
(10)![]()
![]()
jest stosunkiem ciepła molowego Cp do ciepła molowego Cv:
(11)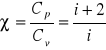
Przemiany:
Wtłoczony pod ciśnieniem gaz do balonu znajduje się pod ciśnieniem. Gaz określony jest parametrami:
1.Ciśnienie (p+ p1)- suma ciśnienia atmosferycznego i nadwyżki ciśnienia spowodowanej wtłoczeniem powietrza do balonu;
2.objętość gazu przed rozprężeniem;
3. temperaturę otoczenia.
Ciśnienie jest wprost proporcjonalne do różnicy poziomów cieczy w manometrze, ponieważ p= ρgh
Po otwarciu korka butli, w wyniku czego gaz rozpręża się adiabatycznie (oziębia się), w tym stanie parametry gazu zmieniają się:
1. ciśnienie (p) równe jest ciśnieniu adiabatycznemu
2. Objętość po rozprężeniu jest większa
3. Temperatura jest niższa
Po zamknięciu korka gaz ogrzewa się i po kilku minutach osiąga ponownie temperaturę otoczenia. W czasie zachodzącej przemiany izochorycznej powstaje nadwyżka ciśnienia, co obserwujemy na manometrze (ustala się różnica poziomów cieczy)
Stan trzeci układu określany jest przez następujące parametry:
Ciśnienie- p+p2
Objętość V2
Temperaturę otoczenia
Przejście ze stanu pierwszego w stan drugi określa równanie Poissona:
(p0+p1)V![]()
=p0V![]()
Przejście ze stanu 1 przez stan 2 w stan 3 można zastąpić przemianą izotermiczną, w której gaz przechodzi ze stanu 1 bezpośrednio w stan 3 w stałej temperaturze otoczenia.
Dla tego przejścia zastosujemy wzór Boyle'a i Mariotte'a:
(p0+p1)V1=(p0+p2)V2
Z powyższych równań obliczamy:
![]()
Pomiar:
1. Sprężyć powietrze w naczyniu i poczekać na wyrównanie temperatury między gazem i otoczeniem (ustaje wahanie cieczy w manometrze). Odczytujemy różnicę poziomów h1.
2. Wyjąć korek i po wyrównaniu ciśnienia z otoczeniem natychmiast go włożyć. Na skutek ogrzania powietrza w naczyniu powstaje nadciśnienie h2 wskazywane przez manometr.
Pomiar: |
T |
h1 |
h2 |
h1+h2 |
|
|
|
k |
mm |
mm |
mm |
- |
- |
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
6 |
|
|
|
|
|
|
7 |
|
|
|
|
|
|
8 |
|
|
|
|
|
|
9 |
|
|
|
|
|
|
10 |
|
|
|
|
|
|
Obliczenia:
Wyszukiwarka
Podobne podstrony:
Ćw. 48, Bioinżynieria Produkcji żywności, Fizyka
Sprawozdanie ćw 18, Bioinżynieria Produkcji żywności, Fizyka
promieniowanie, Bioinżynieria Produkcji żywności, Fizyka
Sprawozdanko, Bioinżynieria Produkcji żywności, Fizyka
Przewodnictwo, Bioinżynieria Produkcji żywności, Fizyka
Fizyka3, Bioinżynieria Produkcji żywności, Fizyka
Metody pomiaru współczynnika załamania światła, Bioinżynieria Produkcji żywności, Fizyka
Napięcie powierzchniowe, Bioinżynieria Produkcji żywności, Fizyka
Sprawozdanie nefelometria, Bioinżynieria Produkcji żywności, Fizyka
ćw.27, Fizyka, Skrypt do Laborek
cw.27, Politechnika Rzeszowska, Fizyka, Sprawozdania
Analiza żywności ćw 4 kwasowość, Tż, Analiza żywności II, Sprawozdania
spr cw 11, Technologia chemiczna, semestr 2, Fizyka, Laboratorium, laboratoria fizyka bincia
Dziennik Ustaw z 03 r Nr 6 poz w ROZPORZĄDZENIE w sprawie metod wewnętrznej kontroli produkcji żywn
Metody mikroskopowe w badaniach struktury produktów żywnościowych
więcej podobnych podstron