Wstęp teoretyczny.
Potencjometria należy do metod elektroanalitycznych, które obejmują szereg technik pomiarowych i procesów zachodzących miedzy elektrodami. Podstawa metod elektroanalitycznych stanowi pomiar wielkości elektrycznych związanych ze stężeniem bądź całkowitą ilością oznaczonej substancji.
Metody potencjometryczne polegaja na pomiarze siły elektromotorycznej (SEM) ogniwa złożonego z dwóch elektrod zanurzonych w badanym roztworze.
ĆWICZENIE P-1
Wyznaczanie charakterystyki elektrody szklanej.
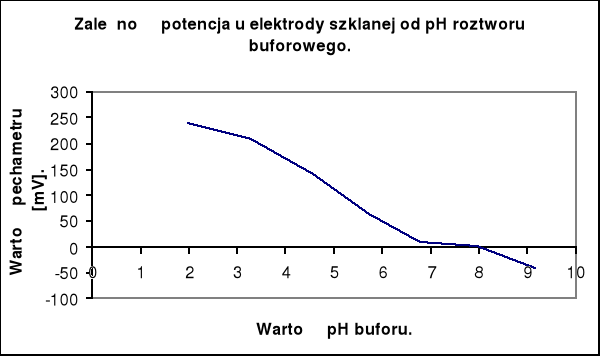
Celem ćwiczenia jest wyznaczenie zależności potencjału elektrody szklanej od pH roztworu i określenie zakresu jej stosowalności w pomiarach pH. Ćwiczenie to wykonuję w następującej kolejności:
Do siedmiu zlewek o pojemności 100cm3 odmierzam roztwór kwasów o stężeniu 0,04 mol/dm3 i roztwór wodorotlenku sodowego o stężeniu 0,2 mol/dm3 w ilościach podanych w tabeli.
Zanurzam elektrody do kolejnych roztworów, zaczynając od roztworu o najmniejszym pH i notuję wskazania pehametru w mV.
Po każdym pomiarze spłukuję elektrody wodą destylowaną, lekko ściągam z nich bibułką wiszące krople wody i zanurzam w następnym roztworze.
Opracowanie wyników.
Lp. |
pH buforu |
Objętość roztworu kwasów [cm3] |
Objętość roztworu NaOH [cm3] |
Wskazania pehametru [mV] |
1 |
1,98 |
50 |
5 |
240 |
2 |
3,29 |
50 |
10 |
210 |
3 |
4,56 |
50 |
15 |
142 |
4 |
5,72 |
50 |
20 |
62 |
5 |
6,80 |
50 |
25 |
10 |
6 |
7,96 |
50 |
30 |
2 |
7 |
9,15 |
50 |
35 |
-42 |
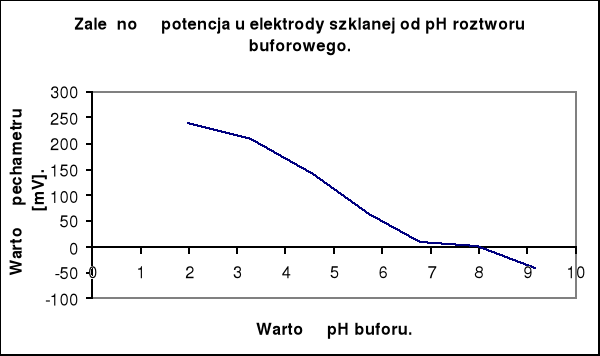
Na podstawie wykresu mogę stwierdzić, że zależność SEM od pH roztworu jest prostolinijna w zakresie pH od 1,98 do 3,29. W tym zakresie można stosować badaną elektrodę. Dla innych wartości pH czułość elektrody ulega obniżeniu, aż do granicy wykrywalności, która determinuje zakres pomiarowy każdej elektrody.
Na podstawie uzyskanych pomiarów SEM ogniwa zbudowanego z elektrod zanurzonych w wodzie destylowanej i wodociągowej, mogę odczytać wartość pH tych próbek z wykresu charakterystyki elektrody szklanej.
pH wody destylowanej wynosi 8,4 przy wskazaniu pehametru - 14 mV
pH wody wodociągowej wynosi 8,95 przy wskazaniu pehametru - 34 mV
Ćwiczenie P - 2
Oznaczanie kwasu karboksylowego (octowego) i mineralnego (solnego) występujących równocześnie w roztworze.
Celem ćwiczenia jest oznaczenie kwasów: octowego i solnego występujących razem w roztworze. W oznaczeniu wykorzystuje różniące działanie acetonu na moc tych kwasów. Ćwiczenie to wykonuje w następującej kolejności:
Roztwór kwasów otrzymany w kolbie miarowej o pojemności 250 cm3 rozcieńczam do kreski wodą destylowaną i dokładnie mieszam.
Do zlewki o pojemności 250 cm3 odpipetowuję 50 cm3 acetonu i 50 cm3 badanego roztworu.
Instaluję mieszadło i elektrody, tak aby bańka elektrody szklanej była całkowicie zanurzona podczas ruchu elementu mieszającego, aby ten element nie uszkodził elektrody.
Nad zlewką ustawiam biuretę z 0,2-molowym NaOH.
Po włączeniu mieszadła magnetycznego dodaje po 0,5 cm3 NaOH i notuję każdorazowo stan biurety i odpowiadające mu wskazania pehametru w mV.
Gdy porcja 0,5 cm3 NaOH wywoła większy skok potencjału zmniejszam ją do 0,2 cm3, po czym przy małych skokach potencjału z powrotem ją zwiększam do 0,5 cm3.
Miareczkowanie przerywam, gdy kolejne porcje NaOH wywołują małe lub równe przyrosty potencjału lub w ogóle ich nie wywołuje.
Opracowanie wyników.
a)pierwsze miareczkowanie
Objętość roztworu NaOH [cm3] |
Wskazania pehametru [mV] |
Objętość roztworu NaOH [cm3] |
Wskazania pehametru [mV] |
Objętość roztworu NaOH [cm3] |
Wskazania pehametru [mV] |
0,5 |
260 |
9,0 |
70 |
18,5 |
-7 |
1,0 |
255 |
9,5 |
66 |
19,0 |
-14 |
1,5 |
246 |
10 |
61 |
19,5 |
-28 |
2,0 |
243 |
10,5 |
55 |
20,0 |
-55 |
2,5 |
240 |
11,0 |
52 |
20,5 |
-233 |
3,0 |
237 |
11,5 |
49 |
21,0 |
-291 |
3,5 |
233 |
12,0 |
45 |
21,5 |
-310 |
4,0 |
228 |
12,5 |
42 |
22,0 |
-321 |
4,5 |
223 |
13,0 |
38 |
22,5 |
-329 |
5,0 |
215 |
13,5 |
35 |
23,0 |
-338 |
5,5 |
204 |
14,0 |
32 |
23,5 |
-345 |
6,0 |
186 |
14,5 |
28 |
24,0 |
-351 |
6,5 |
144 |
16,0 |
19 |
24,5 |
-355 |
7,0 |
110 |
16,5 |
17 |
25,0 |
-358 |
7,5 |
95 |
17,0 |
11 |
|
|
8,0 |
85 |
17,5 |
6 |
|
|
8,5 |
76 |
18,0 |
1 |
|
|
b)drugie miareczkowanie
Objętość roztworu NaOH [cm3] |
Wskazania pehametru [mV] |
Objętość roztworu NaOH [cm3] |
Wskazania pehametru [mV] |
Objętość roztworu NaOH [cm3] |
Wskazania pehametru [mV] |
0 |
257 |
9,5 |
109 |
19 |
9 |
0,5 |
257 |
10 |
100 |
19,5 |
2 |
1 |
256 |
10,5 |
86 |
20 |
-5 |
1,5 |
255 |
11 |
79 |
20,5 |
-12 |
2 |
255 |
11,5 |
72 |
21 |
-24 |
2,5 |
254 |
12 |
66 |
21,5 |
-50 |
3 |
252 |
12,5 |
60 |
22 |
-110 |
3,5 |
250 |
13 |
57 |
22,5 |
-295 |
4 |
247 |
13,5 |
53 |
23 |
-317 |
4,5 |
245 |
14 |
49 |
23,5 |
-333 |
5 |
242 |
14,5 |
44 |
24 |
-341 |
5,5 |
238 |
15 |
40 |
24,5 |
-349 |
6 |
235 |
15,5 |
38 |
25 |
-353 |
6,5 |
230 |
16 |
34 |
25,5 |
-357 |
7 |
225 |
16,5 |
30 |
26 |
-360 |
7,5 |
217 |
17 |
26 |
26,5 |
-363 |
8 |
207 |
17,5 |
22 |
27 |
-366 |
8,5 |
192 |
18 |
19 |
|
|
9 |
156 |
18,5 |
13 |
|
|
c) wartość średnia z dwóch miareczkowań
Objętość roztworu NaOH [cm3] |
Wskazania pehametru [mV] |
Objętość roztworu NaOH [cm3] |
Wskazania pehametru [mV] |
Objętość roztworu NaOH [cm3] |
Wskazania pehametru [mV] |
0 |
258 |
8,5 |
113 |
17 |
11 |
0,5 |
255 |
9 |
87 |
17,5 |
6 |
1 |
250 |
9,5 |
80 |
18 |
0 |
1,5 |
249 |
10 |
70 |
18,5 |
-9 |
2 |
247 |
10,5 |
65 |
19 |
-26 |
2,5 |
244 |
11 |
60 |
19,5 |
-119 |
3 |
241 |
11,5 |
55 |
20 |
-151 |
3.5 |
237 |
12 |
51 |
20,5 |
-167 |
4 |
234 |
12,5 |
47 |
21 |
-185 |
4,5 |
228 |
13 |
44 |
21,5 |
-219 |
5 |
221 |
13,5 |
40 |
22 |
-316 |
5,5 |
210 |
14 |
36 |
22,5 |
-331 |
6 |
187 |
14,5 |
31 |
23 |
-342 |
6,5 |
167 |
15 |
28 |
23,5 |
-348 |
7 |
156 |
15,5 |
25 |
24 |
-353 |
7,5 |
146 |
16 |
20 |
|
|
8 |
134 |
16,5 |
16 |
|
|
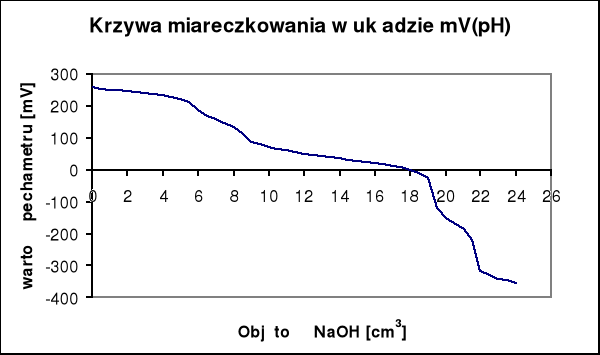
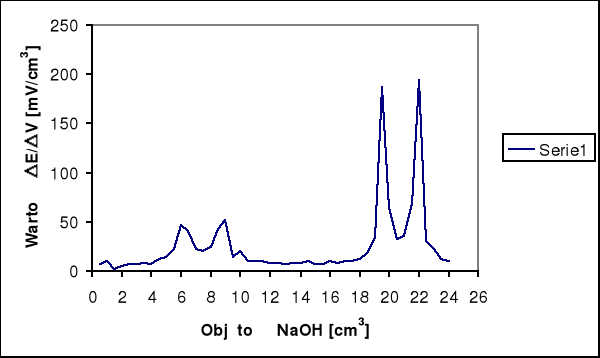
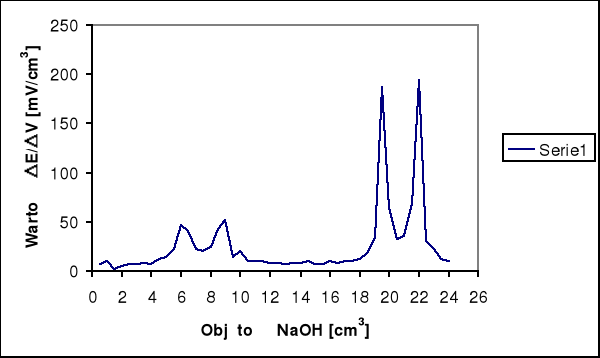
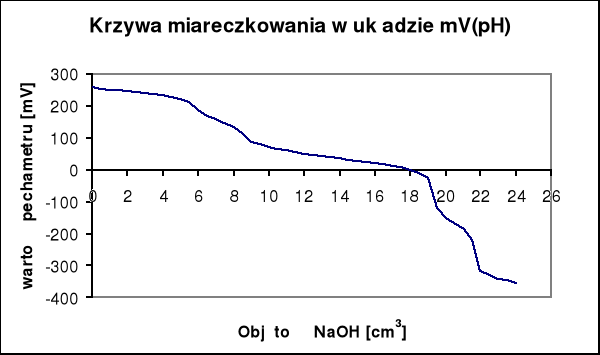
Na krzywej miareczkowania wykonanej na podstawie wyników pomiarów występują skoki potencjału.
A)
1 mol HCl reaguje z 1 molem NaOH
MHCl - 1 mol NaOH
mHCl - nNaOH
mHCl = (vNaOH * cNaOH * MHCl) / 1000 [g w próbie]
B)
1 mol CH3COOH reaguje z 1 molem NaOH
MCH3COOH - 1 mol NaOH
mCH3COOH - nNaOH
mCH3COOH = (vNaOH * cNaOH * M CH3COOH) / 1000 [g wprobie]
A) MHCl = 1 + 35,5 = 36,5 [g/mol]
cNaOH = 0,2 [mol/dm3]
vNaOH = 9 [cm3]
mHCl = (9 * 0,2 * 36,5 ) / 1000 = 0,0657 g w próbie
MCH3COOH = 12 + 3*1 + 12 + 2*16 + 1 = 60 [g/mol]
cNaOH = 0,2 [mol/dm3]
vNaOH = 13 [cm3]
mCH3COOH = (13 * 0,2 * 60) / 1000 = 0,156 g w próbie
ĆWICZENIE P - 3
Oznaczanie równocześnie występujących jodków i chlorków metodą potencjometrycznego miareczkowania.
Celem ćwiczenia jest oznaczenie zawartości jodków i chlorków w próbce otrzymanej do analizy. Podstawą tej metody są reakcje strąceniowe jodków i chlorków pod działaniem jonów srebra. Ćwiczenie to wykonuję w następującej kolejności:
Do zlewki o pojemności 250 cm3 przenoszę analizowaną próbkę i uzupełniam wodą destylowaną do objętości 150 cm3.
Zanurzam w miareczkowanym roztworze elektrodę wskaźnikowa (srebrną) i elektrodę porównawczą (nasyconą elektrodę kalomelową) z kluczem elektrolitycznym.
Miareczkuję próbkę roztworem AgNO3 o stężeniu 0,1 mol/dm3.
Roztwór AgNO3 dodaję w porcjach po 0,5 cm3 i notuję w tabeli sumaryczną liczbę dodanych cm3 i odpowiadającą jej wartość SEM ogniwa pomiarowego.
Opracowanie wyników.
Objętość roztworu AgNO3 [cm3] |
Wskazania pehametru [mV] |
Objętość roztworu AgNO3 [cm3] |
Wskazania pehametru [mV] |
Objętość roztworu AgNO3 [cm3] |
Wskazania pehametru [mV] |
0 |
-0,285 |
6,5 |
-0,095 |
13 |
0,198 |
0,5 |
-0,28 |
7 |
0,02 |
13,5 |
0,317 |
1 |
-0,279 |
7,5 |
0,051 |
14 |
0,331 |
1,5 |
-0,277 |
8 |
0,064 |
14,5 |
0,347 |
2 |
-0,275 |
8,5 |
0,075 |
15 |
0,350 |
2,5 |
-0,271 |
9 |
0,085 |
15,5 |
0,357 |
3 |
-0,269 |
9,5 |
0,091 |
16 |
0,361 |
3,5 |
-0,265 |
10 |
0,1 |
16,5 |
0,364 |
4 |
-0,259 |
10,5 |
0,107 |
17 |
0,368 |
4,5 |
-0,254 |
11 |
0,115 |
17,5 |
0,370 |
5 |
-0,245 |
11,5 |
0,124 |
18 |
0,372 |
5,5 |
-0,235 |
12 |
0,135 |
|
|
6 |
-0,275 |
12,5 |
0,155 |
|
|
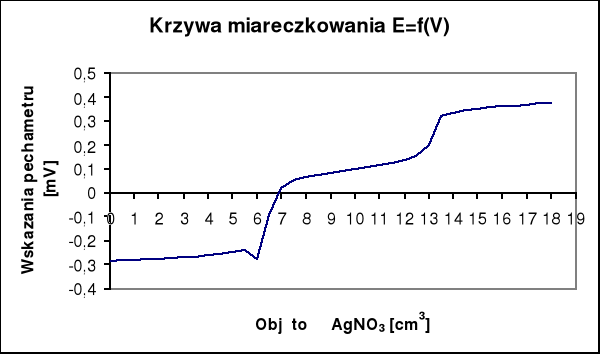
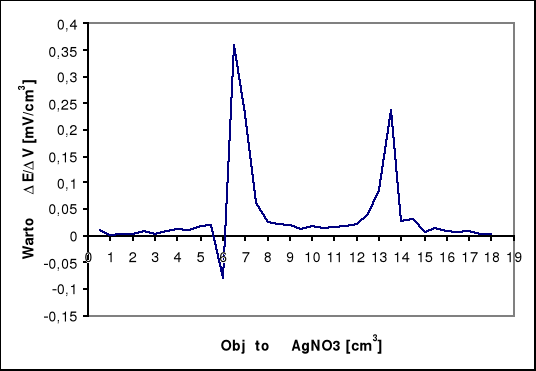
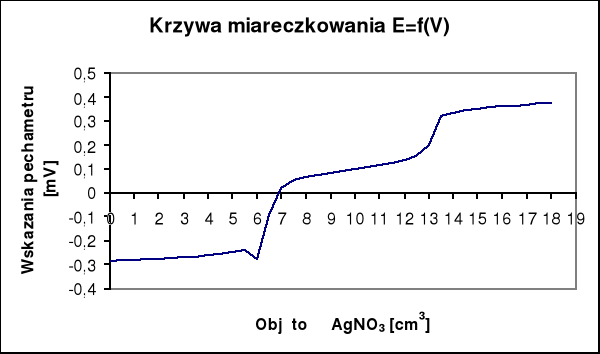
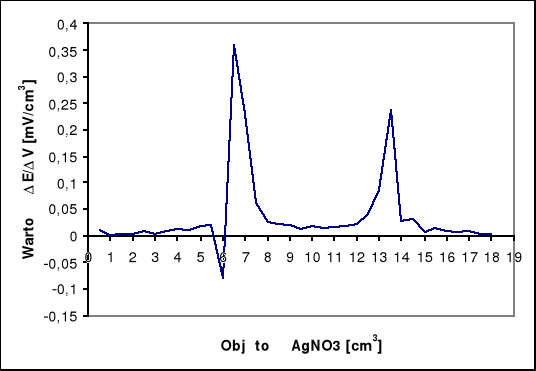
Na krzywej miareczkowania potencjometrycznego występują dwa punkty przegięcia. Pierwszy dla AgI, a drugi dla AgCl. Zawartość jodków w analizowanej próbie obliczam na podstawie ilości zużytego roztworu AgNO3 do pierwszego punktu końcowego (v1), a zawartość chlorków obliczam na podstawie ilości roztworu AgNO3 zużytego pomiędzy pierwszym i drugim punktem końcowym (v2).
A)
1 mol I- reaguje z 1 molem AgNO3
MI- - 1 mol AgNO3
mI_ - nAgNO3
mI- = (v1AgNO3 * cAgNO3 * MI-) / 1000 [g w próbie]
B)
1 mol Cl- reaguje z 1 molem AgNO3
MCl- - 1 mol AgNO3
mCl- - nAgNO3
mCl- = (v2AgNO3 * cAgNO3 * MCl-) / 1000 [g w próbie]
MI- = 126,90 [g/mol]
cAgNO3 = 0,1 [mol/dm3]
v1AgNO3 = 6,5 [cm3]
mI- = ( 6,5 * 0,1 * 126,90 ) / 1000 = 0,082 g w próbie
MCl- = 35,45 [g/mol]
cAgNO3 = 0,1 [mol/dm3]
v2AgNO3 = 7,00 [cm3]
mCl- = ( 7,00 * 0,1 * 35,45 ) / 1000 = 0,025 g w próbie
Wnioski.
Wyniki pomiarów na podstawie których wykonane zostały obliczenia zostały odczytane niedokładnie. Odczytane z wykresów punkty końcowe miareczkowania i wzięte do obliczenia zawartości substancji znajdujących się w badanym roztworze, ze względu na niedokładność wykresów mogą mieć inną wartość. Wyliczone masy substancji mogą nie wskazywać prawdziwej zawartości w badanej próbie.
1
Wyszukiwarka