OSTEOPOROZA
OSTEOPOROZA - definicja
jest układową chorobą szkieletu charakteryzującą się niską masą kostną
upośledzoną mineralizacją tkanki kostnej
i w konsekwencji zwiększoną podatnością na złamania
OSTEOPOROZA- podział
miejscowa
uogólniona
pierwotna (80%)
idiopatyczna
młodzieńcza
dorosłych
inwolucyjna
postmenopauzalna - typ I (80%)
starcza - typ II (20%)
wtórna
w przebiegu chorób ogólnoustrojowych
polekowa
OSTEOPOROZA miejscowa
zawsze wtórna
po złamaniach (unieruchomienie)
miejscowe stany zapalne
guzy kości
choroba Sudecka-Babińskiego-Leriche'a (ostry zapalny zanik kości)
OSTEOPOROZA idiopatyczna
młodzieńcza - zbyt powolne „przybywanie” masy kostnej
w stosunku do wzrostu kościmężczyźni poniżej 50 r.ż.
OSTEOPOROZA postmenopauzalna
wiek 51-75
stosunek płci K:M = 6:1
zanik głównie kości beleczkowej
złamania:
- kręgosłup
- dystalna część kości promieniowej
OSTEOPOROZA inwolucyjna
po 70 roku życia
stosunek płci (K:M=2:1)
zanik zarówno kości beleczkowej i korowej
złamania:
- szyjka kości udowej
- kręgosłup
OSTEOPOROZA wtórna
choroby endokrynologiczne
(podwzgórze, przysadka, tarczyce, nadnercza, gonady, trzustka)
OSTEOPOROZA wtórna
Choroby przewlekłe
choroby reumatologiczne
choroby nerek
choroby przewodu pokarmowego
OSTEOPOROZA wtórna
choroby nowotworowe
choroby hematologiczne
OSTEOPOROZA wtórna (polekowa)
glikokortykoidy
methotreksat
preparaty tarczycy
heparyna
tiazydy
isoniazyd
Gromadzenie i utrzymywanie masy kostnej
Okres osiągania szczytowej masy kostnej (10-20 r.ż.)
Okres utrzymywania szczytowej masy kostnej (20-50r.ż.)
Okres ubytku masy kostnej zależny od niedoboru estrogenów (50-65r.ż.)
Okres związanego z wiekiem ubytku masy kostnej (>65 r.ż.)
Zmiany masy kostnej zachodzące z wiekiem
PRZYCZYNY OSTEOPOROZY
szybka utrata masy kostnej
niska szczytowa masa kostna
SZCZYTOWA MASA KOSTNA
-Czynniki genetyczne
-Stan odżywienia
-Aktywność fizyczna
-Poziom hormonów płciowych
PRZEBUDOWA tkanki kostnej
W kościach odbywa się nieustanny proces przebudowy tkanki kostnej:
- osteoliza
- osteosynteza
Czynniki wpływające
na przebudowę kości
PTH
estrogeny
1,25(OH)2D3
IL-1, IL-6
interleukinyTNFၡ , TNFၢ
tumor necrosis factorPGE2
prostoglandynaTGF ၡ , TGFၢ
czynniki wzrostowekalcytonina
poziom wapnia
hormony tarczycy
M-CSF
GM-CSF
OPG
RANKL
RANK
hGH
IL-11
androgeny
Patogeneza osteoporozy pomenopauzalnej
Ⴏ poziomu estrogenów
Ⴍ aktywności osteoklastów
Ⴍ resorpcji tkanki kotnej
Ⴍ wzrost poziomu Ca we krwi
Ⴏ czynności przytarczyc
Ⴏ poziomu PTH
Ⴏ syntezy aktywnej postaci wit.D
Ⴏ wchłaniania Ca w jelitach
Ⴏ wchłaniania zwrotnego Ca w nerkach
Ⴍ wydalania Ca z moczem
Patogeneza osteoporozy starczej
Ⴏ syntezy aktywnej wit.D
Ⴏ wchłaniania Ca w jelitach
Ⴏ poziomu Ca we krwi
Ⴍ aktywności przytarczyc
Ⴍ poziomu PTH
Ⴍ resorpcji kości
Żeńskie hormony płciowe
estradiol - główny hormon okresu rozrodczego
estriol - główny hormon w ciąży
estron - główny hormon po menpauzie
siła działania:
estradiol > estron > estriol
Po menopauzie wytwarzane jest ok. 10% estrogenów w porównaniu do okresu rozrodczego
Żeńskie hormony płciowe
Działają poprzez receptory estrogenowe
alfa i betaRozmieszczenie receptorów estrogenowych:
OUN
jajniki
naczynia krwionośne
kości
płuca
układ moczowo-płciowy
gruczoły piersiowe
wątroba
macica
Żeńskie hormony płciowe
Jelita
Ⴍ absorpcję wapnia
Ⴍ syntezę aktywnej witaminy DNerki
Ⴏ wydalanie wapnia
Ⴍ resorpcję zwrotną Ca
Osteoblasty
podtrzymywanie liczby i przeżycia poprzez zwalnianie apoptozy
Osteoklasty
zmniejszanie liczby
i aktywnościzwiększanie apoptozy
Czynniki ryzyka osteoporozy
Wiek > zaawansowany
Płeć > żeńska
Grupa etniczna > o jasnej karnacji skóry
Czynniki genetyczne > predyspozycje rodzinne
Budowa ciała > wątła, masa ciała niska
Mała aktywność fizyczna
Dieta > zbyt małe spożycie wapnia
Niska podaż w dzieciństwie,
witaminy D w okresie wzrastania
Czynniki ryzyka osteoporozy
niedobory estrogenów / wczesna menopauza (<45 r.ż)
osteoporoza u matki
przebyte uprzednio złamania (po 50 r.ż.)
niska masa kostna
wysokie wskaźniki przebudowy kości
Czynniki ryzyka osteoporozy
mniejsza obecna masa ciała niż w wieku 25 lat
wysoki wzrost w wieku 25 lat
zły stan zdrowia w ocenie własnej
aktualna długotrwała terapia benzodiazepinami
aktualna terapia lekami p/padaczkowymi
nadmierne spożywanie kofeiny, alkoholu
palenie tytoniu
mniej niż 4 godziny dziennie „na nogach”
Tętno spoczynkowe > 80/min.
Trudności ze wstawaniem z fotela
Trudna ocena głębi widzenia
Trudna ocena kontrastu
Wywiad,
badanie przedmiotowe
i badanie dodatkowe
Obraz kliniczny
Bóle
Ograniczenie aktywności
fizycznejZniekształcenie budowy
ciałaOsłabienie mięśni
Wyczerpanie
Obraz kliniczny
Zmniejszenie wzrostu
Typowa zmiana sylwetki
Złamania trzonów kręgowych, bliższej nasady uda, ramienia, dolnej nasady przedramienia
Diagnostyka osteoporozy
Wywiad i badanie kliniczne
Badania densytometryczne
radiologiczna absorbcjometria (RA)
jednoenergetyczna absorbcjometria (SXA)
dwuenergetyczna absorbcjometria (DEXA)
Ilościowa tomografia komputerowa (QCT)
Ilościowa ultrasonografia (QUS)
Badania laboratoryjne
Badanie densytometryczne
Ocenia gęstość tkanki kostnej w badanym miejscu (Bone Mineral Density BMD) w g/cm3.
Wynik badania jest następnie oceniany metodami
statystycznymi i podawany w postaci:
Z- score (porównanie do ogółu osób tej samej
płci i w tym samym wieku)
T- score (porównanie do ogółu młodych
dorosłych tej samej płci)
T- score
> -1,0 SD norma
-1,0 - -2,5 osteopenia
> -2,5 lub poniżej osteoporoza
poniżej -2,5 i jedno lub więcej złamań - ciężka osteoporoza
Tomografia komputerowa (QCT)
pozwala mierzyć gęstość kości gąbczastej niezależnie od otaczającej ją kości zbitej czy zwapnień np. w aorcie
Badanie ultrasonograficzne
mierzone są 2 parametry:szybkość fali ultradżwiękowej w czasie jej wędrówki przez kość i osłabienie fali zależne od ilości i struktury kości
Z obu tych składników wyliczany jest parametr o nazwie „stiffness” - sztywność, będący wskaźnikiem wytrzymałości kości
Metody diagnostyczne
QCT
- kręgosłup
- szyjka kości udowejDEXA
- szyjka kości udowej
- kręgosłup lędźwiowy
- przedramięUSG
- kość piętowa
UWAGA
WYNIKI BADAŃ RÓŻNYCH METOD, A NAWET RÓŻNYCH TYPÓW APARATÓW NIE SĄ ZE SOBĄ PORÓWNYWALNE !!!
Badania laboratoryjne
Oznacza się tzw. markery informujące o nasileniu resorpcji i tworzeniu tkanki kostnej
Markery resorpcji kości
wydalanie wapnia i fosforu w moczu z uwzględnieniem kreatyniny
wydalanie hydroksyproliny (aminokwas zawarty w kolagenie)
wydalanie pirydoliny i dezoksypirydoliny (poprzeczne mostki łączące i stabilizujące długie włókna kolagenu)
aktywność kwaśnej fosfatazy w surowicy
Markery tworzenia kości
aktywność fosfatazy zasadowej w surowicy
stężenie osteokalcyny w surowicy (białko wytwarzane wyłącznie przez osteoblasty)
stężenie fragmentów prokolanenu typu I
Chorzy szybko tracący masę kostną mają wyższe wartości biomechanicznych markerów przebudowy kości
Nowe kryterium rozpoznania
Ryzyko wystąpienia
złamania szyjki kości udowej u danej osoby w ciągu najbliższych 5 lat.
LECZENIE
Kość beleczkowa stanowi tylko 20% całkowitej powierzchni kości, ale dysponuje trzykrotnie większą powierzchnią sięgającą 10m2 od kości korowej
Powszechnie przyjęta
i zaakceptowana definicja charakteryzuje osteoporozę jako schorzenie związane
z obniżeniem masy kostnej
i jakości kości prowadzące do zwiększonej łamliwości tkanki kostnej i wystąpienia złamań.
Ilość i częstość złamań jest wykładnikiem zaawansowania osteoporozy, a ich częstość dokumentuje postęp zmian osteoporotycznych.
Zagrożenie złamaniami dotyczy najczęściej trzonów kręgosłupa, następnie szyjki kości udowej.
Jako próg złamań przyjmuje się wartość masy kostnej, w której dominują złamania
- co odpowiada wartości dwóch odchyleń standardowych poniżej szczytowej masy kostnej, bądź 35% ubytkowi tkanki kostnej.
(dane WHO)
Przewidywane ryzyko złamań można podzielić na 2 kategorie:
ryzyko złamań ograniczone do określonego miejsca kośćca
ryzyko złamań obojętnej lokalizacji
Ryzyko względne złamań przeliczone na wartość 1 SD
Wartości T-score są bardzo różne w odniesieniu do ryzyka złamań w zależności od miejsca pomiaru.
Zalecenia WHO opracowano dla wartości kręgosłupa.
Odznaczają się one wysoką specyficznością odnośnie wystąpienia zagrożenia złamaniami.
Ze względu na różną dostępność do diagnostyki i leków
WHO dąży do unifikacji informacji.
Diagnostyka osteoporozy wymaga dużej wiedzy i doświadczenia klinicznego.
Dokładnie zebrany wywiad, badanie ortopedyczne, neurologiczne i funkcjonalne musi być poparte badaniami obrazowymi i laboratoryjnymi.
Szczególną uwagę należy zwrócić na ocenę radiologiczną kręgosłupa piersiowego i lędźwiowego
i w związku z tym doborze
miejsca badania densometrycznego.
Postawienie właściwej diagnozy, szczególnie w początkowym okresie choroby pozwala wdrożyć leczenie zapobiegające ubytkowi masy kostnej i postępowi deformacji narządu ruchu.
Profilaktyka
Wzmożenie aktywności fizycznej
Zaprzestanie palenia tytoniu, picia alkoholu i kawy
Zapewnienie codziennego spożycie wapnia w granicach 1200mg i 800j.wit.D
Eliminacja przyczyn upadków
Prof ilaktyki wymagają:
Osoby z osteopenią (T-score pomiędzy -1,0 a -2,5) z udziałem jednego lub więcej czynników ryzyka,
szczególnie
z przyspieszoną
przebudową kości
Hormonalna terapia zastępcza (HRT)
pod kontrolą internistyczną i ginekologiczną !
- tabletki
- plastry
- preparaty i.m. depotfitoterapeutyki (raczej do łagodzenia objawów zespołu klimakteryjnego)
analogi receptora estrogenowego (Raloxifen)
Leczenia wymagają:
wszystkie osoby ze złamaniem po niewielkim urazie, szczególnie kręgów, kości promieniowej czy bliższego końca kości udowej
osoby bez złamań, obciążone czynnikami ryzyka z masą kostną poniżej -2,5 T-score
Leczenie obejmuje
wymogi profilaktyki + HRT lub Tibolon lub Raloxifen
wymogi profilaktyki + leki hamujące resorpcję kości
witamina D stosowana wymiennie z jej aktywnym metabolitem - Alfakalcidolem lub Devisolem
Preparaty hamujące resorpcję kostną
kalcytonina
bisfosfoniany
Etindronian
Klodronian (Bonefos, Lodronat)
Alendronian (Fosamax)
Ibandronian
Rizendronian
UWAGA: Leki te nie działają profilaktycznie - nie ma sensu stosować u osób bez osteoporozy lub osteopenii
Zasady leczenia
leczenie i zapobieganie obowiązuje do końca życia
okresowa kontrola skuteczności leczenia:
BMD nie częściej niż co 12 miesięcy
wskaźniki przebudowy co 3- 6 mies.
Kalcytonina -wskazania
osteoporoza starcza z szybką przemianą kostną
złamania
bóle kostne
Kalcytonina-preparaty
kalcytonina łososiowa:
Miacalcic
Calsynar 100
Calcihexal
Kalcytonina ludzka syntetyczna:
Cibacalcin
Bisfosfoniany-działanie
Hamowanie resorpcji kości poprzez wpływ na osteoklasty
Zasady leczenia
Ulegają stałej modyfikacji
w miarę wprowadzania nowych leków
opracowywania nowych badań diagnostycznych
publikowania wyników badań uzyskanych na dużej populacji
Leczenie powikłań osteoporozy
Złamania kręgosłupa
Leczenie operacyjne
Złamania kręgosłupa
Wertebroplastyka
to bezpośrednie wstrzyknięcie cementu kostnego przez podstawy łuków do trzonu kręgowego w celu restytucji jego wysokości (kształtu)
i tym samym zniesienie dolegliwości bólowych.
Kyfoplastyka, to restytucja wysokości złamanego trzonu kręgowego za pomocą balonu wprowadzonego bezpośrednio do trzonu kręgowego przez podstawy łuków, a następnie podanie cementu kostnego i tym samym zniesienie dolegliwości bólowych.
Wskazania do stosowania Wertebroplastyki i Kyfoplastyki.
1. Osteoporoza pierwotna.
2. Osteoporoza wtórna (posterydowa).
3. Myeloma multiplex.
4. Osteolityczne przerzuty nowotworowe.
Najważniejszym wskazaniem do stosowania Wertebro i Kyfoplastyki jest ból.
Ból w złamaniach osteoporotycznych wywołany jest mikroruchami uszkodzonych beleczek kostnych trzonu kręgowego.
Ból w chorobie nowotworowej wywołany jest wzmożonym ciśnieniem mas nowotworowych wewnątrz trzonu kręgowego i ucisku na zakończenia nerwowe.
Przeciwwskazania.
1. Asymptomatyczne złamania stabilne.
2. Chorzy odpowiadający na leczenie farmakologiczne.
3. Profilaktyka u chorych z osteoporozą bez cechy ostrych złamań.
4. Stany zapalne trzonów.
5. Ostre urazowe nie osteoporotyczne złamania trzonów kręgowych zwłaszcza u ludzi młodych.
6. Złamania z większym niż 70% zapadnięciem wysokości trzonu.
7. Uszkodzenie tylnej ściany trzonu kręgowego ???
8. Koagulopathia.
Wertebro i Kyfoplastyka mogą być wykonywane dwoma metodami:
- otwartą i przezskórną.Znieczulenie :
- ogólne lub miejscowe.Ułożenie pacjenta na brzuchu.
Aktualnie preferowana jest metoda Wertebro i Kyfoplastyki przezskórnej
w znieczuleniu miejscowym.Znieczulenie ogólne stosujemy:
u chorych z dużymi dolegliwościami bólowymi,
u chorych nie potrafiących leżeć na brzuchu,
w przypadkach PV lub VCFs wykonywanej
na kilku poziomach przez zespół lekarski
z małym doświadczeniem.
Najlepsze wyniki terapeutyczne (przeciwbólowe) w złamaniach uzyskuje się w 1 tygodniu od złamania.
Stosowanie PV i VCFs powyżej 6 miesiąca od złamania daje niewielkie efekty przeciwbólowe.
Idealny pacjent, to chory z jednopoziomowym osteoporotycznym kompresyjnym złamaniem trzonu z dużymi dolegliwościami bólowymi .
Maksymalnie jednoczasowo możemy rekonstruować 3 trzony kręgowe.
Injekcje cementu winny być wykonywane zawsze obustronnie.
Złamania wielopoziomowe, złamania
we wtórnej osteoporozie (posterydowe)
i nowotworach winny być leczone
przez doświadczonych lekarzy.
Patomechanika bólu w osteoporozie.
Złamany trzon kręgowy traci swoją wytrzymałość i sztywność.
Zmniejszona wytrzymałość powoduje utratę zdolności przenoszenia sił osiowych przez trzon kręgowy oraz traci zabezpieczenie przed dalszymi złamaniami.
Zmniejszona sztywność zwiększa mikroruchy w uszkodzonym trzonie kręgowym, które są przyczyną dolegliwości bólowych.
Odtworzenie wytrzymałości i sztywności uszkodzonego trzonu kręgowego za pomocą VP lub VCFs eliminuje bolesne mikroruchy.
Od momentu pierwszego złamania ryzyko wystąpienia kolejnych
wzrasta 5 - 25 razy.Kaskada złamań jest przyczyną powstania kyfotycznej sylwetki pacjenta.
Hyperkyfotyczny kształt kręgosłupa piersiowego może być przyczyną złamań wtórnych.
Komplikacje wertebroplastyki
Wyciek cementu poza trzon kręgowy.
Embolie płucne
Efektywność terapeutyczna Wertebro i Kyfoplastyki
U 75% - 95% chorych ze złamaniami kompresyjnymi w osteoporozie znosi dolegliwości bólowe.
U 59% - 86% chorych z nowotworami wertebroplastyka znosi dolegliwości bólowe.
Wertebro i kyfoplastyka znosi ból, poprawia aktywność życiową, poprawia jakość życia
i tym samym przedłuża życie pacjenta.
Uwagi praktyczne
Czas wertebroplastyki na jeden segment wynosi ok. 30 minut.
Czas kyfoplastyki na jeden segment wynosi 45 minut.
Całkowity koszt wertebroplastyki wynosi 900 $ łącznie z hospitalizacją.
Całkowity koszt kyfoplastyki wynosi 3600 $ (sprzęt jest jednorazowy).
Podsumowanie
Wertebro i Kyfoplastyka to nowe metody leczenia osteoporotycznych kompresyjnych złamań trzonów kręgowych.
Obie procedury są mało inwazyjne
Wskaźnik zniesienia bólu w obu metodach jest bardzo wysoki i wynosi ok. 95%.
Kyfoplastyka lepiej odtwarza kształt złamanego kręgu, lecz nie ma zastosowania w leczeniu przerzutów nowotworowych do kręgosłupa.
Kyfoplastyka w większym stopniu wypełnia trzon kręgowy cementem.
Kyfoplastyka w większym stopniu zmniejsza ryzyko wypływu cementu poza trzon, embolizację płuc oraz ucisku na struktury nerwowe.
Złamania bliższego odcinka kości udowej
Stopnie zaniku beleczek bliższej nasady kości udowej wg Singha.
ZŁAMANIA BLIŻSZEGO KOŃCA KOŚCI UDOWEJ
Mechanizm urazu
Kiedyś poszukiwano zależności typu złamania od kierunku działającej siły urazu.
Siła działająca wzdłuż długiej osi szyjki miała powodować złamania podgłowowe,
prostopadle do osi szyjki od boku złamania krętarzowe lub zgniecenie szyjki,
działająca prostopadle do osi szyjki od przodu złamania przezszyjkowe.
Obecnie uważa się że kierunek działania siły nie wpływa na typ złamania
ZŁAMANIA BLIŻSZEGO KOŃCA KOŚCI UDOWEJ
Klasyfikacja
Podział Szulca
podgłowowe
przezszyjkowe
skośne, spiralne z dziobem przyśrodkowym
przykrętarzowe
ZŁAMANIA BLIŻSZEGO KOŃCA KOŚCI UDOWEJ
Podział Pauwelsa (przebieg szczeliny złamania w stosunku do linii poziomej)
do 300
30 - 500
50 i więcej stopni
ZŁAMANIA BLIŻSZEGO KOŃCA KOŚCI UDOWEJ
Leczenie zachowawcze
w złamaniach prawdziwie zaklinowanych (objaw Crawforda - brak bólu w miejscu złamania)
w złamaniach stabilnych przy znacznym obciążeniu stanu ogólnego i dużym ryzyku operacyjnym
przy bezwzględnych przeciwwskazań do leczenia operacyjnego
najlepszą metodą zachowawczą wg Tylmana jest tu leczenie czynnościowe
wyciąg nadkostkowy z obciążeniem 1/12 mc
ćwiczenia na szynie Grucy przez 6-10 tygodni
potem chodzenie bez obciążania przez 4-5 miesięcy
ZŁAMANIA BLIŻSZEGO KOŃCA KOŚCI UDOWEJ
zespolenia minimalne
gwoździe Nystroma-Szulca (3 wprowadzone stromo i przeszczepy gąbczaste w okolicę łuku Adamsa (trochanter pro Adams)
druty gwintowane Moore'a (u dzieci)
zespolenia masywne
śruba dociskowa Gardena
śrubopłytka Richardsa
operacje rekonstrukcyjne
operacja Judetta
operacja Tylmana
ZŁAMANIA BLIŻSZEGO KOŃCA KOŚCI UDOWEJ
osteotomie walgizujace
przy obecności stawu rzekomego szyjki i żywej głowie kości udowej operacja Tylmana połączona z osteotomią Pauwelsa II lub Mc Murraya
alloplastyki
alloplastyki całkowite
alloplastyki połowicze po 75 r.ż. (wg Tylmana)
POWIKŁANIA PO ZŁAMANIACH SZYJKI KOŚCI UDOWEJ
Wczesne do 3-4 tygodni od złamania lub operacji
Ogólne
niewydolność krążeniowo-oddechowa
zaburzenia wodno-elektrolitowe
zapalenia płuc
zapalenia dróg moczowych
odleżyny
zakrzepowe zapalenie żył
zatory tłuszczowe
zatory naczyń płucnych i mózgowych
zespół psychoorganiczny
POWIKŁANIA PO ZŁAMANIACH SZYJKI KOŚCI UDOWEJ
Miejscowe
ropienie rany pooperacyjnej
przemieszczenie odłamów
powikłania śródoperacyjne
POWIKŁANIA PO ZŁAMANIACH SZYJKI KOŚCI UDOWEJ
Późne
Ogólne
zakrzepowe zapalenie żył
jak wyżej
Miejscowe
martwica jałowa głowy kości udowej
staw rzekomy szyjki kości udowej
koksartroza wtórna z powodu zaburzeń krążenia i przebytej choćby częściowej martwicy
późne zakażenia rany operacyjnej
POWIKŁANIA PO ZŁAMANIACH SZYJKI KOŚCI UDOWEJ
Późne
Ogólne
zakrzepowe zapalenie żył
jak wyżej
Miejscowe
martwica jałowa głowy kości udowej
staw rzekomy szyjki kości udowej
koksartroza wtórna z powodu zaburzeń krążenia i przebytej choćby częściowej martwicy
późne zakażenia rany operacyjnej
POWIKŁANIA PO ZŁAMANIACH SZYJKI KOŚCI UDOWEJ
Jałowa martwica głowy kości udowej stanowi najczęstsze powikłanie złamania szyjki (do 30 % przypadków). Dochodzi do niej tym częściej im bliżej głowy znajduje się szczelina złamania. W obrazie rtg po około 3 miesiącach widoczne jest przewapnienie, a następnie fragmentacja i zapadniecie głowy.
POWIKŁANIA PO ZŁAMANIACH SZYJKI KOŚCI UDOWEJ
Czynniki zwiększające ryzyko wystąpienia martwicy:
Pierwotne
niekorzystny kąt szczeliny złamania (Pauwels III)
złamanie podgłowowe
przemieszczenie odłamów
Wtórne
późno dokonana repozycja
dystrakcja odłamów
traumatyczna technika operacyjna
repozycja otwarta
zbyt wczesne obciążanie stawu
ZŁAMANIA KRĘTARZOWE I PODKRĘTARZOWE
Złamania sięgające od pozatorebkowej części szyjki kości udowej do okolicy 3 cm poniżej krętarza mniejszego powstające w wyniku urazu pośredniego (siła urazu działa wzdłuż osi uda lub gwałtowna rotacja tułowia przy ustalonej kończynie) lub bezpośredniego. Do większości złamań dochodzi w wieku 70-90 lat, częściej u kobiet (2:1 do 7:1) ze względu na zmiany osteoporotyczne.
ZŁAMANIA KRĘTARZOWE I PODKRĘTARZOWE
Podział w zależności od umiejscowienia
złamania międzykrętarzowe
złamania przezkrętarzowe
złamania podkrętarzowe
ZŁAMANIA KRĘTARZOWE I PODKRĘTARZOWE
Objawy
ból biodra
zniesienie ruchów czynnych i biernych w stawie biodrowym
skrócenie kończyny
ułożenie kończyny w rotacji zewnętrznej i przywiedzeniu
ZŁAMANIA KRĘTARZOWE I PODKRĘTARZOWE
Podział złamań przez i międzykrętarzowych wg Evansa
Stabilne gdy istnieje możliwość oparcia przyśrodkowej warstwy korowej odłamu bliższego na przyśrodkowej warstwie korowej odłamu obwodowego
Niestabilne gdy powyższe nie jest możliwe z uwagi na zniszczenie warstwy korowej lub bardzo skośny przebieg szczeliny złamania
ZŁAMANIA KRĘTARZOWE I PODKRĘTARZOWE
Leczenie złamań krętarzowych
Zachowawcze
wyciąg nadkłykciowy 6-8 kg z kończyną zgiętą do 30* w biodrze i kolanie i 30* odwiedzenia przez 8-10 tygodni, wczesne usprawnianie, początek obciążania po minimum 3 miesiącach
wyciąg nadkostkowy przez 8-10 tygodni i leczenie czynnościowe
ZŁAMANIA KRĘTARZOWE I PODKRĘTARZOWE
Operacyjne (repozycja z oparciem przyśrodkowych warstw korowych odłamów i wprowadzeniem elementu zespalającego 0.5 cm od chrząstki)
zespolenie płytą kątową AO, Osteo, Mc Laughlina, Neufelda
gwoździopłytka Jewetta
śruba kompresyjna Richardsa
pręty Endera (sprężyste, zmniejszające ramię momentu sił zginających)
alloplastyka biodra
ZŁAMANIA KRĘTARZOWE I PODKRĘTARZOWE
Leczenie złamań podkrętarzowych
Odłam bliższy odwiedziony, zgięty i zrotowany na zewnątrz, odłam dalszy przywiedziony i zrotowany na zewnątrz; stabilne ze szczeliną biegnącą od góry i boku do dołu i przyśrodka, niestabilne ze szczeliną biegnącą od góry i przyśrodka do boku do dołu i boku
Zachowawcze
jednoczasowa repozycja zamknięta (90-90) i unieruchomienie w gipsie biodrowym
pionowy wyciąg nadkłykciowy przez 6-8 tygodni, potem gips biodrowy na 8-10 tygodni
leczenie czynnościowe przez 8-10 tygodni
ZŁAMANIA KRĘTARZOWE I PODKRĘTARZOWE
Operacyjne
w złamaniach stabilnych płyta kątowa z długim ramieniem pionowym, śruba kompresyjna Richardsa, płytka do złamań nadkłykciowych, płytka prosta
w złamaniach niestabilnych gwóźdź śródszpikowy Zickela, pręty Endera,
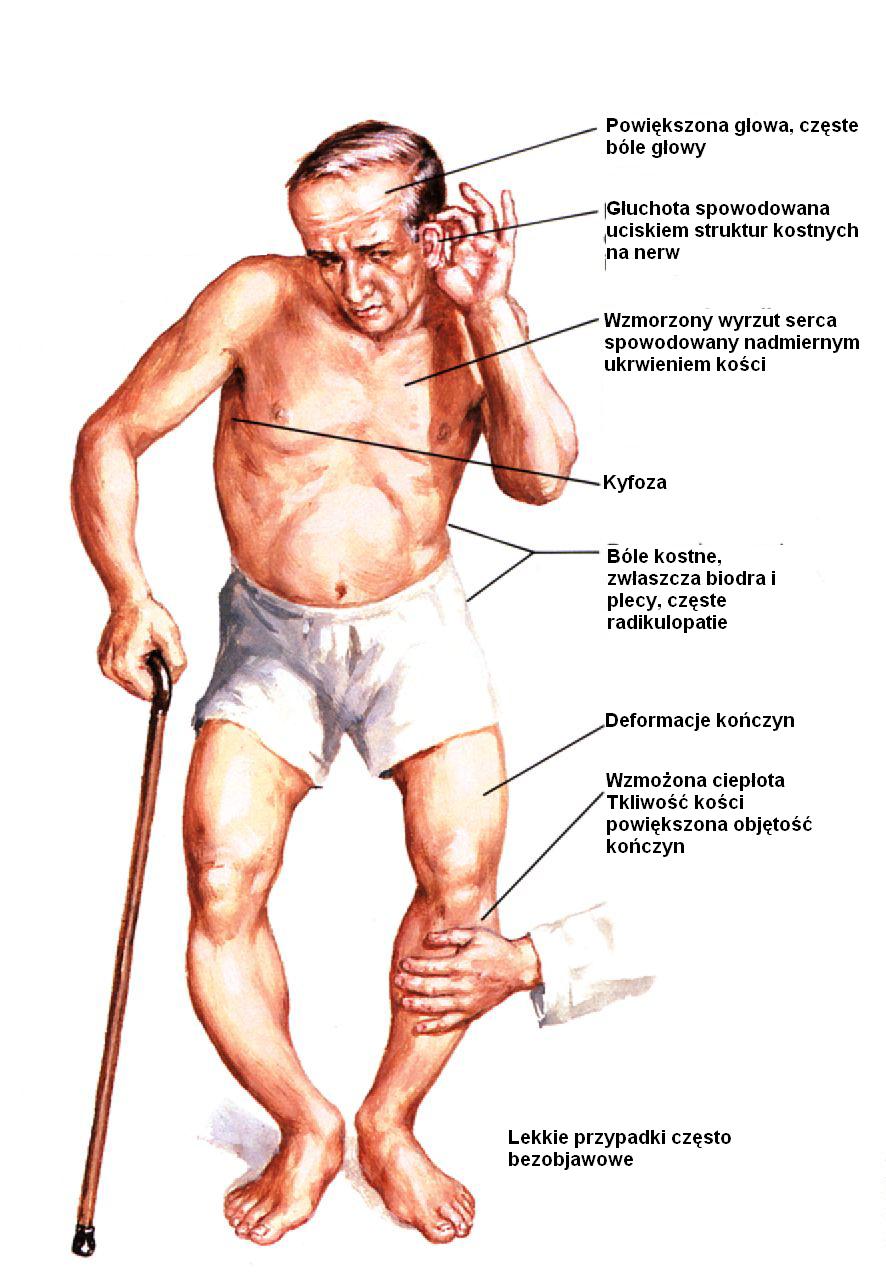
CHOROBA PAGETA
Wyszukiwarka