nr grupy : 32 nr zespołu : 10
|
ćwiczenie nr 4 |
data : 17.11.1998 |
Michałowski Sławomir Wójcik Zbigniew Czochara Grzegorz
|
Adsorpcja z fazy gazowej. |
ocena : |
WSTĘP TEORETYCZNY
Na powierzchni ciała stałego, niezależnie od rodzaju sieci krystalicznej, występują siły, które wywołują gromadzenie się cząstek z fazy gazowej do roztworu. To gromadzenie się cząstek na ciele stałym, nazywamy adsorpcją. W zależności od charakteru sił wywołujących to zjawisko rozróżniamy :
Adsorpcję fizyczną − jeżeli, siły mają charakter fizyczny
Chemisirpcję − jeżeli, siły mają charakter chemiczny
Zdolność adsorpcji ciał stałych zależy od ich natury oraz od stopnia rozwinięcia powierzchni, tj.: od ilości, rozmiaru i kształtu porów występujących w jednostce masy ciała. Gazy i pary są tym lepiej adsorbowane przez ten sam adsorbent, im niższa jest temperatura adsorbenta w równowadze z adsorbowanym gazem, wyższe ciśnienie cząstkowe adsorbatu, większy ciężar cząstkowy adsorbatu oraz wyższa temperatura krytyczna adsorbatu.
W przypadku adsorpcji wielowarstwowej wyprowadzono metodą BET, opartą na następujących założeniach teoretycznych:
− powierzchnia adsorbentu jest jednorodna tj.: każda zaadsorbowana cząstka w pierwszej mononuklearnaj warstwie adsorpcyjnej zajmuje równoważne miejsce w sensie przestrzennym i energetycznym
− cząsteczki w pierwszej monowarstwie są zlokalizowane
− każda cząsteczka w pierwszej monowarstwie jest miejscem do adsorpcji cząsteczki w drugiej monowarstwie, ta natomiast w trzeciej monowarstwie itd., oznacza to, że liczba cząstek znajdująca się w kolejnych monowarstwach jest taka sama
− nie ma oddziaływań między cząsteczkami tej samej warstwy
− energia adsorpcji pierwszej warstwy jest większa od energii przyłączenia cząsteczek warstw następnych.
Równanie izotermy adsorpcji BET
p/v(po−p)=1/vnC+(c−1)p/vnCpo
Struktura porowata oraz budowa powierzchni węgla aktywnego są związane z jego budową krystaliczną. Uporządkowanie atomów węgla w elementarnym krystalicie wykazuje znaczne podobieństwo do struktury grafitu. Występujące w węglu defekty (np. luki), oraz obecność wbudowanych heteroatomów jest efektem procesu otrzymywania (surowca, zanieczyszczeń, metod oraz warunków otrzymywania). Oprócz struktury porowatej najistotniejszym czynnikiem określającym własności adsorpcyjne jest chemiczna budowa powierzchni węgli aktywnych. Stopień rozwinięcia struktury porów odgrywa szczególną rolę w przypadku adsorpcji z fazy gazowej. Chemiczna budowa powierzchni adsorbatu ma wtedy mniejsze znaczenie (występuje głównie w przypadku adsorbatów polarnych).
PRZEBIEG ĆWICZENIA
Wyznaczamy ciśnienie równowagowe par eteru dietylowego nad adsorbentem, którym jest węgiel aktywny. Ilość wprowadzonego adsorbatu określa się przy pomocy mikrobiuretki dozującej. Wyznaczamy izotermę adsorpcji dla tego układu.
Najpierw 7 g węgla aktywnego oznaczonego symbolem Ag2n poddajemy desorpcji pod próżnią. Po 50 min. pojemnik z węglem aktywnym studzimy. Następnie podłączamy dozownik z 10 cm3 eteru dietylowego. W procesie adsorpcji dokonujemy odczytu Δp w zależności od ilości zaadsorbowanego gazu.
Temperatura otoczenia 200C, aktualne ciśnienie atmosferyczne 750 mmHg.
WYNIKI I OBLICZENIA

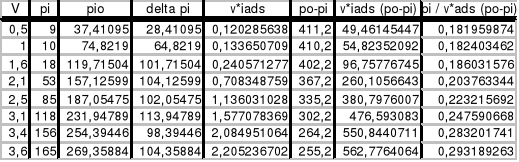
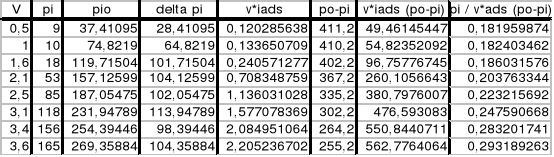
Sporządzamy wykres zależności pi = f(vi), a następnie przesuwamy prostoliniowy fragment wykresu do początku układu współrzędnych i z niego odczytujemy wartości pi0 dla danego vi. (wykres 1)
Z danych zawartych w kolumnach 2 i 8 sporządzamy wykres zależności pi / [viads∗(pi0-pi)]=f(pi), a następnie obliczamy z niego tgα. (wykres 2)
Zgodnie z równaniem izotermy BET mamy:
tgα = (c - 1) / (c ⋅ vm ⋅ po)
tgα = 6,9 ⋅ 10 −4
b = 1 / (vm ⋅ c)
c = 2,768 ; vm = 2,203
Gęstość eteru dietylowego w 200C wynosi: ρ = 0,7078 g / cm3
Masa molowa eteru M(C2H5)2O = 74,12 g / mol
Z tego obliczamy :
m = 1,5593 g
n = 0,021 mola
Powierzchnia zajmowana przez adsorbent wynosi:
S = 6,023 ⋅ 1023 ⋅ 0,021 ⋅ 52,3 A2
S = 6,615 ⋅ 1023 A2 = 6615 m2
Obliczamy powierzchnię czynną właściwą :
Sr = S / madsorbentu
S = 6,615 ⋅ 1023 / 7 = 9,45 ⋅ 1022 A2 / g
S = 945 m2 / g
WNIOSKI
Otrzymany przez nas wynik pomiaru powierzchni węgla aktywnego mieści się w przedziale podawanym przez literaturę (700 - 1100 m2 / g).
LITERATURA
H. Jankowska, A. Świątkowski, J.Choma: Węgiel aktywny
J. Ościk: Adsorpcja
1
3