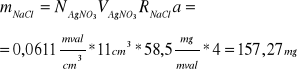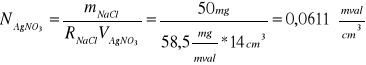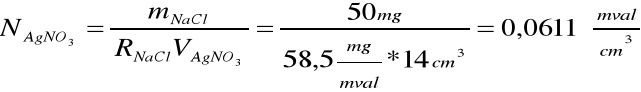
gr.10
Sprawozdanie nr 2
Temat: Argentometria.
Badanie zawartości masy NaCl w próbce roztworu nr 12.
Aby zbadać próbkę należy w pierwszej kolejności nastawić miano 0,05N roztworu AgNO3 na substancję podstawową NaCl. Oznaczony roztwór NaCl o stężeniu 1cm3 = 10mg rozcieńczono w kolbie stożkowej do około 100cm3 wodą destylowaną i dodano 1cm3 10% roztworu K2CrO4 jako wskaźnika. Następnie miareczkowano roztworem AgNO3, aż do pojawienia się trwałej zmiany zabarwienia z mlecznożółtej na żółtobrunatną.
I miareczkowanie: V(Ag NO3) = 14,4 cm3
II miareczkowanie: V(Ag NO3) = 13,6 cm3
Średnia wynosi: V(Ag NO3) = 14 cm3
W roztworze zachodziły następujące reakcje:
AgNO3 + Cl- → AgCl↓ + NO3
2AgNO3 + CrO42- → Ag2CrO4↓ + NO3-
Nastawienie miana:
Dane:
V(Ag NO3) = 14 cm3
R(NaCl) = 58,5 mg/mval
m(NaCl) = 50 mg
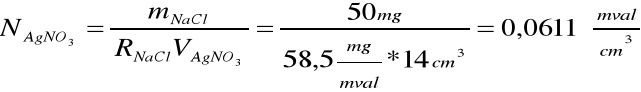
Po otrzymaniu miana AgNO3 przystąpiono do badania próbki nr 12. Badanie przeprowadzono podobnie jak nastawianie miana jednak niewiadomą jest masa NaCl w otrzymanej próbce. Po dopełnieniu wodą do kreski, pobrano pipetą 25 cm3 roztworu, wlano do kolby stożkowej i dopełniono do 100 cm3 wodą destylowaną. Następnie dodano 1 cm3 wskaźnika K2CrO4. Miareczkowano AgNO3, aż do pojawienia się zmiany zabarwienia z mlecznożółtej na żółtobrunatną.
I miareczkowanie : V(Ag NO3) = 11,1 cm3
II miareczkowanie: V(Ag NO3) = 10,9 cm3
Średnia wynosi: V(Ag NO3) = 11 cm3
Obliczanie masy NaCl:
Dane:
N(Ag NO3) = 0,0611 mval/cm3
V(Ag NO3) = 11 cm3
R(NaCl) = 58,5 mg/mval
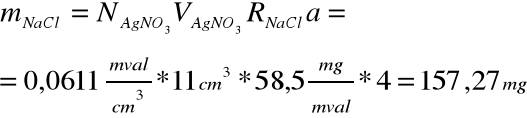
a = 4 (bo wlano 25 cm3 na 100 cm3)