Stopien dysocjacji zależy od:
-rodzaju rozpuszczalnika
-stezenia roztworu
-od temp.
Od rodzaju elektrolitu
-od obecności innych elektrolitów
Stopien dysocjacji:
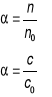
Stała dysocjacji:stosunek
iloczynu stezen jonów powstałych
podczas procesu dysocjacji do
stężenia czasteczek niezdysocjowanych
w stanie równowagi chemicznej.
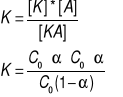
Zad1.Stała dys. NH4OHw temp
25C wynosi 1,8*10^(-5).Oblicz stężenie jonów.
K=1,8*10^(-5) C=?
![]()
![]()
![]()
PH
Zad2.Obl. ph
0,03M roztworu H2SO4
H2SO4->2H++SO4-
3*2*0,01
-log 6*10^(-2)=2log6
Zad3.
CH3COOH 0,02M 2%
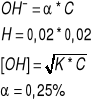
-log4*10^(-4)
Zad4.
C=0,01 NH4OH
K=1,75*10^(-5)
![]()
Zad5.
5000cm3 HCl 1,825g
1000cm3 1M- 36,5g
5000cm3 XM- 1,825g
X=0,01
pH=2
Zad6.
100cm3 0,1M KOH+900cm3 H2O
100cm3*0,1+900*0=(100+900)C
C=0,01 pOH=2 pH=12
Zad7.
0,004M NH4OH ![]()
![]()
Zad8.
Obl. pH. Rozpuszczono 0,0365g
w 100cm3.
1000cm3 1M-36,5
100cm3 XM-0,0365
X=0,01 pH=2
Stężenia
Zad9.
Obl C% 2M HNO3 o d=1,1g/cm3.
2M*63g=126g
D=mr/v =>mr=d*v =>mr=1100g
126g-1100g
xg-100g => x=11,45
zad10.
Ile wody i soli trzeba zmieszac aby
mieć 1,5kg 10% Roz.
C%=ms/mr => ms= 0,15kg
Zad11.
Ile g NaOH jest w 300cm3 2M roz.
1000cm3 1M NaOH-40g
300cm3 2M NaOH-xg
X=24g
Zad12.
Jaką objętość 0,5M HCl można
odszymac rozpuszczając 4,48cm3 gazuHCl
1000cm3 1M-22,4cm3
Xcm3 0,5M-4,48cm3 =>x=400cm3
Zad13.
5cm3 40% KOH o d=1,2g/cm3 rozcienczono
H2O I przyg. 100cm3 KOH. Ile M?
m=1,2g/cm3*5cm3=6g
100g - 40g
6g-xg =>x=3/7g
Zad14.
Ile cm3 96% H2SO4 d=1,83g/cm3
Nalezy dac do przyg. 2dm3 0,25M rozt.
1000cm3 1M-98g
2000cm3 0,25M-xg =>x=49g
100g-96g
x-49g => x=51,04g
d=m/v
1cm3- 1,83g
x- 51,04g =>x=27,7
v=m/d x=15,14cm3
Zad15.
20% H2SO4 ma d=1,1g/cm3
Obl Cmolowe.
20g- 100g
x- 1100g x=220
1000cm3 1M- 98g
1000cm3 XM-220g x=2,24M/dm3
Zad16.
2M NaOH d=1,08g/cm3 obl. C%
1000cm3 1M NaOH-40g
1000cm3 2M NaOH-80g
Mr=1,08*1000=1080
1080g- 80g
100g- x x=8%
Zad17.
Obl ile g Ca(NO3)2 nalezy roz. w H2O
Aby mieć 2dm3 o C=0,5mol/dm3.
C=m/vM M=164g
M=C*v*M =164g
Zad18.
Ile cm3 0,1 mol H2SO4 zuzyjemy na
zmiareczkowanie NaOH 20cm3 0,1M NaOH
H2SO4+NaOH->Na2SO4+2H2O
1000cm3 1M H2SO4-1000cm3 2M NaOH
Xcm3 0,1M H2SO4- 20cm3 0,1M NaOH
X= 100cm3
Zad19.
Ile g CH3COOH było jezeli na jego zobojetnienie
zuzyto 20cm3 0,2M NaOH
CH3COOH+ NaOH-> CH3COONa+ H2O
1000cm3 1M NaOH-60g CH3COOH
20cm3 0,2M NaOH-xg
X=0,24g
Zad20.
Zkolby o poj 100cm3 zaw roz Na2CO3 pobrano 20cm3
roz na zmiareczkowanie zuzyto 10cm3 0,1M HCl
Na2CO3+HCl->NaCl+H2CO3
1000cm3 3M HCl-106g Na2CO3
10cm3 0,1M HCl-xg x=0,053g
0,053 Na2CO3-20cm3
xg Na2CO3-100cm3 x=0,265g
Kompleksonometria
zad21.
Na miareczkowanie 50cm3 H2O
wobec czerni eriochromowej zuzyto
10cm3 0,01M EDTA, wobec mureksydu 8cm3 0,01M
EDTA. Oblicz ile g Ca i Mg w 1dm3
Ca-8cm3
Mg-2cm3
1000cm3 1M EDTA-40g Ca
8cm3 0,01M EDTA-xg Ca x=0,0032 w 50cm3
W 1000cm3 0,064g
1000cm3 1M EDTA-24g Mg
2cm3 0,01M EDTA-xg Mg x=0,00048 w 50cm3
W 1000cm3 0,0096g
Zad22.
10gdolomitu
Ca-4cm3 0,01M EDTA
Mg-1cm3 0,01M EDTA
1000cm3 1M EDTA-100g CaCO3
4cm3 0,01M EDTA-xg CaCO3 x=0,004g
0,004g*1000/25=0,16CaCO3
To jest 1,6%
Tak samo z Mg
Zad23.
2,05 glinu przeprowadzono do Roz. o obj. 32cm3 wody
pobrano i zuzyto wobec czernio 32cm3 0,01M EDTA,
wobec mureksydu zuzyto 18cm3 0,01M EDTA Oblicz
procentowa zawartość CaO i MgO.
Mg-14cm3
Ca-18cm3
1000cm3 1M EDTA- 56g CaO
18cm3 0,01M EDTA- xg x=0,01008*250/50=0,0504g
2,05g-0,0504g
100g-xg x=2,46%
To samo z Mg
Twardosc wody
-weglanowa (przmijajaca)
Ca(HCO3)2, Mg(HCO3)2
Sposoby zmiękczania:
1)wodorotlenek wapnia
Ca(HCO3)2+Ca(OH)2->2CaCO3+H2O
Mg(HCO3)2+Ca(OH)2->Mg(OH)2+2CaCo3+H2O
2)gotowanie wody
Ca(HCO3)2->CaCO3+H2O+CO2
Mg(HCO3)2->MgCO3+H2O+CO2
3)dodawanie NaOH
Ca(HCO3)2+NaOH->CaCO3+NaCO3+2H2O
Mg(HCO3)2+NaOH->Mg(OH)2+ NaCO3+H2O
-nieweglanowa(trwała)
CaCl2, MgCl2, CaSO4, MgSO4
Sposoby usuwania:
1)Dodawanie sodu
CaCl2+Na2CO3->CaCO3+NaCl
MgSO4+Na2CO3->MgCO3+Na2SO4
2)Mlekiem wapiennym
MgCl2+Ca(OH)2->Mg(OH)2+CaCl2
3)Dodając NaOH
MgCl2+NaOH->Mg(OH)2+2NaCl
4)fosforanem (V)Sodu(Na3PO4*12H2O)
3CaCl2+2Na3PO4->Ca3(PO4)2+ 6NaCl
Zad24.
Woda zawierajaca tylko Ca(HCO3)2 ma 15N.Oblicz ile
g Ca(OH)2 potrzeba dozmiekczenia 5L tej wody oraz ile
cm3 0,01M EDTA zuzyje się na miareczkowanie 50cm3.
15N- 150mg CaO/1dm3
56gCaO-162g Ca(HCO3)2
0,15g CaO-xg Ca(HCO3)2 x=0,43394g w 1dm3
2,16964gCa(HCO3)2 w 5dm3
Ca(OH)2+Ca(HCO3)2->2CaCO+2H2O
162g Ca(HCO3)2-74gCa(OH)2
2,16964-xg x=0,991 Ca(OH)2 trzeba do zmiękczenia
150mgCaO-1000cm3
mgCaO-50cm3
x=7,5mg
1000cm3 1M EDTA-56000g CaO
Xcm3 0,01M EDTA-7,5g CaO x=13,4cm3
Zad25.
Na zmiareczkowanie 50cm3 H2O wobec oranzu metylowego
zuzyto 5cm3 0,01M HCl, na50cm3 H2O wobec czerni
zuzyto 10cm3 0,01M EDTA. Oblicz tradosc całkowita
przmijajaca i trwala w stopniach N.
1000cm3 1M EDTA-56000mg CaO
10cm3-0,01M EDTA- xmg CaO x= 56mg
56mgCaO-50cm3
x mgCaO-1000cm3
x=112mg CaO
wiec twardosc całkowita wynosi 11,2N
2HCl+Ca(HCO3)2->CaCl2+2H2CO3
1000cm3 2M HCl-56000mg CaO
5cm3 0,01HCl-x maCaO x=1,4*1000/50=28mg
Twardosc przemijajaca wynosi 2,8N
Twardosc nieweglanowa wynosi 11,2N-2,8N=8,4N
Wyszukiwarka
Podobne podstrony:
Reakcje Hydrolizy, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki
Sprawozdanie 5 GIG B, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, S
iloslab, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, laborki
Sprawozdanie 4 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Sprawozdanie 6 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
SPRAWOZDANIE NR 3, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, redo
Sprawozdanie 3 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Sprawozdanie I GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
Sprawozdanie1 I GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemi
Wskaźnik alkacymetryczny, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Labork
chemiA, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki
Sprawozdanie 2 GIG B chemia labor, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia
krystalo sciaga(2), II Rok WIMiC inżynieria materiałowa AGH, Krystalografia i krystalochemia, krysta
chemia teoria małasxciaga, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Labor
Zagadnienia do egzaminu KiK zaoczne 2013 2014, II Rok WIMiC inżynieria materiałowa AGH, Krystalograf
Reakcje Hydrolizy, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki
Sprawozdanie 5 GIG B, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, S
iloslab, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, laborki
więcej podobnych podstron