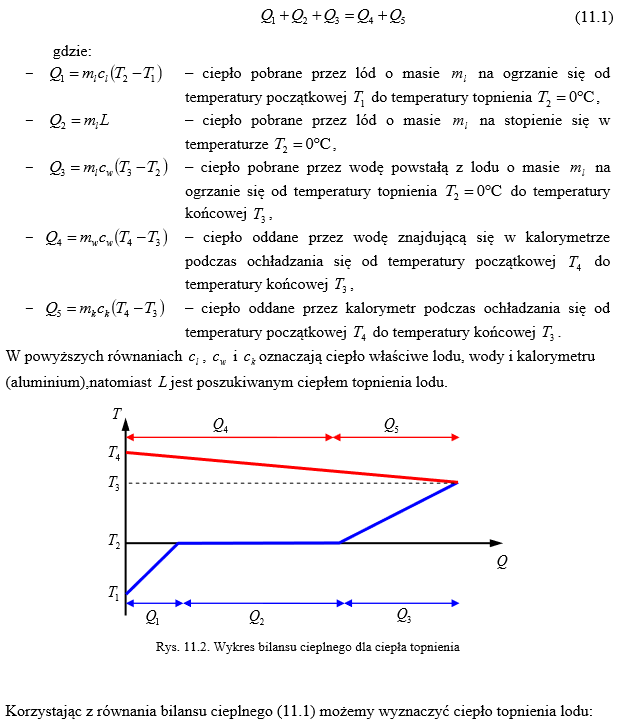
I.
Trzy podstawowe stany kupienia i przejścia fazowe miedzy nimi:
Podstawowy podział:
Stały - ciało stałe (trudno zmienić objętość i kształt)
Ciekły - ciecz (trudno zmienić objętość, kształt łatwo)
Stan lotny - gaz (łatwo zmienić objętość i kształt, ciało zajmuje cała dostępną przestrzeń)
Występowanie większości substancji w danym stanie skupienia zależy od panujących warunków termodynamicznych, czyli ciśnienia i temperatury. Niektóre substancje w identycznych warunkach mogą występować w rożnych stanach skupienia, w zależności od wcześniejszych warunków, zazwyczaj jeden stan jest uprzywilejowywany i substancja może samorzutnie przejść do tego stanu. Dostarczając energię z zewnątrz powodujemy wzrost temp. ciała, przez to powodujemy przejścia fazowe. Przejściem fazowym nazywamy więc proces termodynamiczny, polegający na przejściu jednej fazy termodynamicznej w drugą w kierunku zapewniającym zmniejszenie energii układu .
Podstawowe przejścia fazowe czyli zmiany stanow skupienia:
Strzałki przedstawiają przemiany fazowe:
-sublimacja- przejście od fazy krystalicznej do gazowej
-resublimacja- przejście od fazy gazowej do krystalicznej
- topnienie- przejście z fazy krystalicznej (lub amorficznej) do fazy ciekłej
-krzepniecie- przejście od fazy ciekłej do fazy krystalicznej lub amorficznej
-parowanie, wrzenie -przejście od fazy ciekłej do gazowej
-skraplanie- przejście od fazy gazowej do ciekłej
II.
Ciepło właściwe - ciepło potrzebne do zwiększenia temp. ciała o jednostkowej masie o jedną jednostkę
![]()
gdzie
Q- dostarczone ciepło;
m- masa ciała;
ΔT- przyrost temperatury.
To samo ciepło właściwe można zdefiniować również dla chłodzenia. W ukladzie SI jednostką ciepła właściwego jest dżul przez kilogram x kelwin.
Ciepło właściwe jest wielkością charakterystyczną dla danej substancji w danej temperaturze. Może zależeć od temperatury, dlatego precyzyjniejszy jest wzór zapisany w postaci różniczkowej
Ciepło parowania - (L) - ilość energii potrzebnej do odparowania jednostki masy danej substancji, przy stałym ciśnieniu i temp.W ukladzie SI jednowstka ciepla parowania jest J/kg. Stosuje się tez jednostke J/mol. Ciepło parowania zależy silnie od ciśnienia (temperatury) zmiany stanu skupienia, malejąc wraz ze wzrostem temperatury i osiągając 0 w punkcie krytycznym.
Jeżeli nie podano dla jakiego ciśnienia określono ciepło parowania, to uznaje się, że określono je dla ciśnienia atmosferycznego.
Ciepło topnienia- ilość energii potrzebnej do stopienia jednostki masy danej substancjii. W ukladzie SI jednostką ciepła topnienia jest J/kg ( dżul na kilogram). Zależność ciepła pobranego przez substancję od masy substancji jest wyrażona przybliżonym, doświadczalnym wzorem:
gdzie:
Q- ilość dostarczonego ciepła,
m- masa ciała,
q- ciepło topnienia.
III.
Bilans cieplny: Równanie opisujące sumę procesów cieplnych określonego układu termodynamicznego. W pewnym sensie kompletny zapis bilansu cieplnego jest równoważny sformułowaniu I zasady termodynamiki dla szczególnego przypadku analizowanego układu. Bilans cieplny uwzglednia:
- sumę ciepła dostarczonego do układu z otoczenia
- sumę ciepła, którą układ wydziela na zewnątrz
- efekt cieplny procesu zachodzących wewnątrz układu
Zasada zachowania energii, którą w nauce o cieple nazywamy zasadą bilansu cieplnego, wymaga, aby ilość energii cieplnej Q1 oddanej przez ciało cieplejsze była równa energii cieplnej Q2 pobranej przez ciało zimniejsze: Q1 = Q2
Każdy bilans ciepła można zapisać z „punktu widzenia” układu lub otoczenia. Tradycyjnie - bilans ciepła pisze się zawsze „z punktu widzenia” analizowanego układu. Stąd ciepło wydzielone przez układ zapisana jest ujemnie, a ciepło dostarczone, jako wartość dodatnia. Zatem układy egzotermiczne mają ujemny bilans ciepła, a procesy endotermiczne dodatni.
IV.
Wyznaczanie ciepła parowania i topnienia wody.
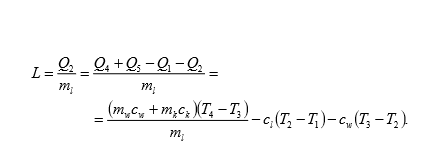
Wyznaczenie ciepła parowania wody
Wyszukiwarka
Podobne podstrony:
badanie fotokom˘rki2, MIBM WIP PW, fizyka 2, sprawka fiza 2, fizyka lab, fizyka
badanie fotokom˘rki1, MIBM WIP PW, fizyka 2, sprawka fiza 2, fizyka lab, fizyka
3 Badanie drgan wlasnych struny metoda rezonansu, Fizyka sprawka
Badanie ciepła topnienia lodu, Elektrotechnika-materiały do szkoły, Fizyka
badanie fotokom˘rki2, MIBM WIP PW, fizyka 2, sprawka fiza 2, fizyka lab, fizyka
badanie fotokom˘rki1, MIBM WIP PW, fizyka 2, sprawka fiza 2, fizyka lab, fizyka
2LAB, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, Fizyka, sprawka od Mateusza, Fizyka -
C7, 1 STUDIA - Informatyka Politechnika Koszalińska, Labki, Fizyka, sprawka od Mateusza, Fizyka - la
2 Sprawdzenie zasady zachowania energii, Fizyka sprawka
pomiary mikroskopowe, MIBM WIP PW, fizyka 2, sprawka fiza 2, fizyka lab, fizyka
fiza iii - 2, MIBM WIP PW, fizyka 2, sprawka fiza 2, fizyka, fizyka
więcej podobnych podstron