Oznaczanie kompleksometryczne miedzi.
Celem doświadczenia jest kompleksometryczne oznaczenie miedzi.
Korzystałam z pipety, pompki, kolby stożkowej oraz z następujących odczynników: przygotowany roztwór, roztwór EDTA o stężeniu 0,01040 mol/dm3, amoniak ( NH·H2O ) o stężeniu 2 mol/dm3, kwas azotowy, woda destylowana oraz mureksyd.
PPRZYGOTOWANIE PRÓBY DO OZNACZEŃ:
Określoną naważkę próby zawierającą miedź rozpuściłam w kwasie azotowym, rozcieńczyłam wodą destylowaną i przeniosłam do kolby miarowej, po czym uzupełniłam ją woda destylowaną do stałej objętości.
KOMPLEKSOMETRYCZNE OZNACZANIE MIEDZI:
Z przygotowanego roztworu pobrałam 25 cm3 próby, dodałam 5 cm3 amoniaku o stężeniu 2 mol/dm3 ( NH3⋅H2O) i szczyptę mureksydu. Miareczkowałam mianowanym roztworem EDTA do zmiany barwy z brudno żółtoczerwonej do pierwszej fioletowej. Po zmiareczkowaniu do żądanej barwy, odczytałam zużytą ilość EDTA. Miareczkowanie powtórzyłam dwa razy.
WYNIKI Z MIARECZKOWANIA:
1 próba
Vp = cm3
Vk = cm3
Vk - Vp = = cm3
Przyjmuje wynik średni cm3
OBLICZENIA:
Dane: Szukane:
V ( EDTA ) = xCu2+ = ?
MCu2+ = 63,546 g/mol
cEDTA = 0,01040 mol/dm3
vpróby = 25 cm3 = 0,025 dm3
Cu2+ + H2Y2- → CuY2- +2H+
1mol Cu ( II ) reaguje z 1 molem EDTA ( H2Y2- )![]()
MCu g reaguje z 1 molem EDTA
xCu2+ g reaguje z cEDTA · vEDTA
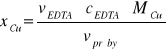
![]()
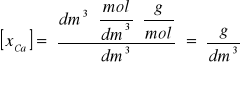
1
Wyszukiwarka
Podobne podstrony:
Spr. nr 12(1), NAUKA, chemia, lab
Spr. nr 13, Studia, Chemia, chemia7
Chemia spraw 13, NAUKA, chemia, lab
Spr. nr 1, NAUKA, chemia, lab
Spr. nr 2(2), NAUKA, chemia, lab
Spr. nr 9(1), NAUKA, chemia, lab
Spr. nr 3, NAUKA, chemia, lab
alkacymetria spr 9, NAUKA, chemia, lab
chemia10, NAUKA, chemia, lab
miareczkownie, NAUKA, chemia, lab
Spr.nr 10, Studia, Chemia, chemia7
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
pat sciąga chemia zerówka, NAUKA, chemia, lab
Masa atomowa i cząsteczkowa, NAUKA, chemia, lab
więcej podobnych podstron