![]()
Kalina Kałuska, Agnieszka Matychowiak
IRM B
Temat: Mieszaniny buforowe.
W celu wytworzenia i utrzymania właściwego stężenia jonów hydroniowych w roztworze stosujemy mieszaniny buforowe: są to mieszaniny słabych zasad lub kwasów z ich solami np. CH3COOH i CH3COOHNa lub NH4OH i NH4CL oraz mieszaniny soli słabych kwasów wieloprotonowych o różnych stopniach neutralizacji np. NaH2PO4 i Na2HPO4 lub Na2HPO4 i Na3PO4.
Mieszaniny buforowe mają określone pH, którego wartość zmienia się nieznacznie po wprowadzeniu do roztworu pewnego nadmiaru jonów H3O- lub OH-. Inaczej mówiąc, mieszaniny te wykazują „działanie buforujące”, tzn. uniemożliwiają gwałtowną zmianę pH roztworu. Podobnie rozcieńczanie czy zwiększanie stężenia roztworów buforowych nie ma wpływu na wartość ich pH. Dla buforu o charakterze kwaśnym np. CH3COONa+CH3COOH, stężenie jonów hydroniowych [H3O+] oblicz się ze wzoru
![]()
gdzie:
Kk- stała dysocjacji słabego kwasu,
Ck- stężenie kwasu,
Cs- stężenie soli.
Mechanizm działania roztworu buforującego jest taki: po dodaniu do mieszaniny buforowej kwasu anion soli zawartej w buforze tworzy z jonem H3O+ słabo zdysocjowany kwas, natomiast po dodaniu zasady jon hydroniowy kwasu zawartego w mieszaninie tworzy z jonem OH- słabo zdysocjowane cząsteczki wody. W skutek powstania słabo zdysocjowanych cząstek kwasu i wody, pH roztworu zmienia się nieznacznie. Po dodaniu do buforu octanowego CH3COOH i CH3COONa kwasu solnego anion CH3COO- z octanu sodu tworzy z jonem H3O+ kwas octowy
![]()
Po dodaniu np. wodorotlenku sodowego NaOH następuje reakcja zobojętnienia między jonami hydroniowymi z kwasu octowego a jonami hydroksylowymi z zasady
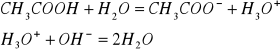
Wprowadzenie kwasu do mieszaniny buforowej powoduje wzrost stężenia słabego kwasu, wprowadzenie zasady wzrost stężenia odpowiedniej soli. Zmiany stężenia składników mieszaniny buforowej wpływają w nieznacznym stopniu na pH roztworu.
Miarą pojemności buforowej jest stosunek dodanej do roztworu ilości kwasu HCl4 lub zasady NaOH wyrażanej w molach jonów wodorowych na 1dm3 do uzyskanej przez to zmiany pH.
Pojemność buforowa wyraża się ułamkiem. W miarę zwiększania ilości dodawanego kwasu lub zasady pojemność buforowa zmniejsza się i staje się równa zero, gdy cała zawarta w roztworze sól zmieni się w słaby kwas lub też cały słaby kwas zostanie przeprowadzony w sól.
Doświadczenie 1/2.
Związek chemiczny |
Stosunek objętościowy roztworu |
||
0,1 chlorek amonowy |
1 |
1 |
16 |
0,1 wodorotlenek amonowy |
16 |
1 |
1 |
Wartość pH |
8,0 |
7,4 |
6,2 |
0,2 chlorek amonowy |
1 |
1 |
16 |
0,2 wodorotlenek amonowy |
16 |
1 |
1 |
Wartość pH |
8,0 |
7,4 |
6,2 |
Doświadczenie 3/4.
wodorofosforan (V) sodu |
1 |
1 |
16 |
dwuwofosforan (V) sodu |
16 |
1 |
1 |
pH |
5,5 |
6,7 |
8,0 |
Kwas octowy |
1 |
1 |
16 |
Octan sodowy |
16 |
1 |
1 |
Wartość pH |
4,0 |
5,0 |
6,0 |
Doświadczenie 5.
Do probówki wlaliśmy 1/5 objętości chlorku baru i dodaliśmy 5-10 kropli kwasu solnego, a następnie wlewaliśmy małymi porcjami roztwór dwuchromianu(VI) potasu do momentu wytrącenia się osadu. Wymieszaliśmy zawartość probówki i podzieliliśmy na dwie części - pozostawiając jedną jako wzorzec. Do drugiej dodaliśmy 5 cm3 octanu sodowego. Otrzymany osad należało porównać z probówką wzorcową.
![]()
pH<7
![]()
- barwa pomarańczowa
![]()
pH>7
![]()
- barwa żółta
Pod działaniem dwuchromianu(VI) potasu na rozpuszczone sole baru wydzieliły się żółte osady: chromianu barowego ![]()
rozpuszczalnego w kwasie solnym, a nierozpuszczalnego w kwasie octowym.
![]()
![]()
Dwuchromian potasowy ![]()
z roztworów soli barwnych strącił nie dwuchromian, lecz chromian baru(VI). Wyjaśniamy to tym, że ![]()
jest bardziej rozpuszczalny od ![]()
, który rozpuszcza się bardzo trudno.
W środowisku kwasu solnego osad nie strąca się, ponieważ nadmiar jonów hydroniowych zapobiega hydrolizie dwuchromianu potasowego i wówczas stężenie jonów chromianowych jest za małe, aby nastąpiło strącenie ![]()
. Wprawdzie kwas octowy również obniża stężenie jonów ![]()
, ale nie w tym stopniu, aby przeszkodzić wydzielaniu się osadu![]()
. Przy dużych stężeniach kwasu octowego pewne straty baru są możliwe.
Doświadczenie 6.
W zlewce o pojemności 25cm3 przygotowaliśmy bufor octanowy o składzie:CH3COOH i CH3COONa w składzie 1:1. Następnie rozlaliśmy go do 3 próbówek po 2cm3 i rozcieńczyliśmy je (1-dwukrotnie; 2-trzykr; 4-bez zmian). Zawartość próbówek wymieszaliśmy, a następnie dodaliśmy do każdej 5 kropli wskaźnika uniwersalnego.
Wartość pH w każdej próbówce otrzymaliśmy jednakowy.
Doświadczenie 7
Do zlewki z przygotowanym roztworem buforowym pobraliśmy po 2cm3 roztworu do czterech próbówek. Następnie dodaliśmy po 5 kropli wskaźnika uniwersalnego. Dodaliśmy do każdej próbówki kolejno po: 2,4 i 6 kropli 0,1M HCL. Wartość pH także nie ulega zmianie.
Doświadczenie 8
Do zlewki z przygotowanym roztworem buforowym pobraliśmy po 2cm3 roztworu do czterech próbówek. Następnie dodaliśmy po 5 kropli wskaźnika uniwersalnego. Dodaliśmy do każdej próbówki kolejno po 2,4 i 6 kropli 0,1M NaOH. Wartość pH także nie ulega zmianie.