![]()
Wardęcka Elżbieta
Wydział chemiczny
Technologia chemiczna
grupa II
ĆWICZENIE 95
ADSORPCJA NA WĘGLU AKTYWNYM.
Adsorpcja jest to zjawisko pochłaniania przez ciało stałe pewnych substancji zachodzące na powierzchni absorbenta. Absorpcja to zjawisko pochłaniania przez ciało stałe pewnych substancji z otoczenia zachodzące równomiernie w całej masie adsorbenta. Cechą charakterystyczną powierzchni ciała stałego jest jej zdolność do pochłaniania par i gazów oraz składników roztworów ciekłych. Proces adsorpcji jest zjawiskiem samorzutnym i egzotermicznym. Zasadniczą rolę w procesie odgrywa wielkość i charakter adsorbenta. Dobrymi adsorbentami są ciała o bardzo rozwiniętej powierzchni, porowate, o dużych powierzchniach wewnętrznych, takie jak węgiel aktywny.
Ilość substancji zaadsorbowanej przez jednostkę masy adsorbenta zależy od stężenia substancji w roztworze (po osiągnięciu równowagi adsorpcyjnej) i jest opisana równaniem Freundlicha:
![]()
gdzie: K i n - wielkości stałe charakteryzujące układ adsorbent- adsorbat.
Powyższe równanie można zlogarytmować stronami, co pozwala na wyznaczenie wartości K i n.
![]()
Nachylenie prostej log a = f ( log c) jest równe wartości n. Wartość rzędnej dla log c = 0 określa wartość log K.
Celem ćwiczenia jest prześledzenie zjawiska adsorbcji w funkcji stężenia oraz wyznaczenie stałych n i K występujących w równaniu Freundlicha.
Przed wykonaniem ćwiczenia przygotowuję cztery roztwory kwasu octowego o stężeniach 0,8 mol/dm3, 0,6 mol/dm3, 0,4 mol/dm3 i 0,2 mol/dm3 oraz odważam w czterech kolbach po 2 g węgla aktywnego. Do erlenmajerek z węglem wlewam po 50 ml poszczególnych roztworów i mieszam przez ok. 6 min. Roztwory odsączam od węgla. Roztwory wyjściowe i adsorbowane mianuję za pomocą NaOH wobec fenoloftaleiny. Wyniki przedstawione są w poniższej tabeli:
Lp. |
Roztwór kwasu |
Objętość próbki kwasu do miareczkowania (ml) |
Objętość NaOH przed adsorpcją |
Objętość NaOH po adsorpcji |
1 |
0,8 |
5 |
13,5 |
11,2 |
2 |
0,6 |
5 |
9,6 |
8,1 |
3 |
0,4 |
5 |
6,5 |
5,2 |
4 |
0,2 |
10 |
6,5 |
6,0 |
W oparciu o powyższe pomiary wyznaczam:
c1- stężenie kwasu przed adsorpcją
c2- stężenie kwasu po adsorpcji
a - ilość kwasu zaadsorbowanego przez 1 kg węgla
Obliczenia dla pierwszej próbki kwasu 0,8 molowego:
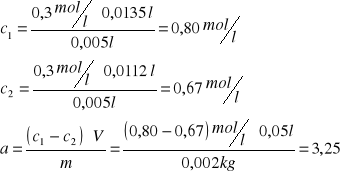
Dla pozostałych roztworów wykonuję obliczenia w ten sam sposób, wyniki przedstawione są w tabeli:
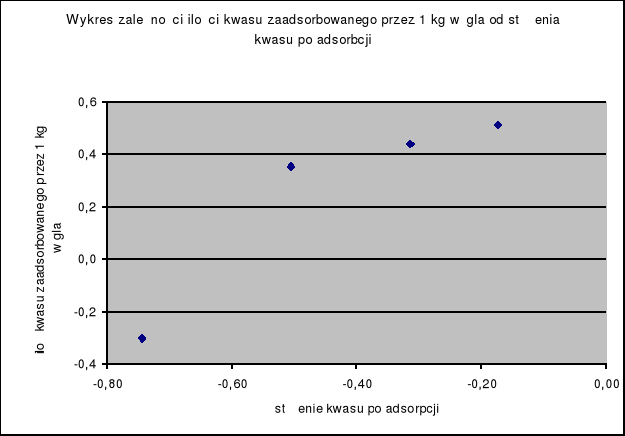
Lp. |
c1 |
c2 |
log c2 |
a |
log a |
1 |
0,80 |
0,67 |
-0,17 |
3,25 |
0,51 |
2 |
0,60 |
0,49 |
-0,31 |
2,75 |
0,44 |
3 |
0,40 |
0,31 |
-0,51 |
2,25 |
0,35 |
4 |
0,20 |
0,18 |
-0,74 |
0,50 |
-0,30 |
Na podstawie powyższych wyliczeń można wykreślić wykres zależności ilości kwasu zaadsorbowanego przez 1 kg węgla od stężenia kwasu. Wykres przedstawia izotermę adsorpcji według równania Freundlicha.
Teraz można wyznaczyć stałe n i K z równania Freundlicha
a=K٠cn
na podstawie wzorów:
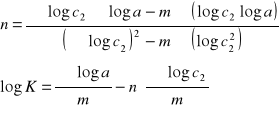
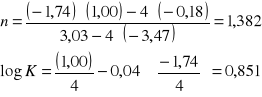
WNIOSKI:
Kształt izoterm i wielkość adsorpcji zależy od wartości wielkości K. K zależy przede wszystkim od wielkości oddziaływań adsorbat- adsorbent i rozpuszczalnik - adsorbent. Gdy oddziaływanie adsorbat- adsorbent jest silne w porównaniu z drugim to adsorpcja jest znaczna. Jeżeli rozpuszczalność adsorbatu w roztworze jest ograniczona, przy zbliżaniu się jego stężenia do granicy rozpuszczalności krzywa izotermy gwałtownie rośnie. Wpływ temperatury na adsorpcję jest różny, generalnie ze wzrostem temperatury adsorpcja zmniejsza się, bo na ogół jest to proces egzotermiczny..
STRONA 1