![]()
(4)
7.III.2003
Zakład Chemii Fizycznej
Laboratorium Studenckie
ĆWICZENIE nr 9
TEMAT:
WYZNACZANIE CIEPŁA PAROWANIA HEKSANU Z POMIARU PRĘŻNOŚCI PARY OD TEMPERATURY .
Aleksander Skrzypczak
Jacek Zdyb
Inżynieria chemiczna
Grupa III Rok II
WSTĘP
W układzie dwufazowym ciecz - para cząsteczki w warstwie powierzchniowej lustra cieczy obdarzone wystarczającą energią mogą opuścić ciecz przechodząc w fazę gazową, wypełniającą pozostałą część zamkniętego naczynia, w którym dana ciecz się znajduje. Intensywność tego procesu wzrasta ze wzrostem temperatury. W miarę wzrostu stężenia cząsteczek w fazie gazowej obserwuje się proces odwrotny tj. przechodzenie pewnej liczby cząsteczek w fazę ciekłą. Jest to proces skraplania .W miarę upływu czasu szybkość parowania maleje , a szybkość skraplania rośnie. Gdy szybkości obydwu procesów zrówna się wtedy ustali się stan równowagi dynamicznej. Równowagę tą charakteryzuje właściwa dla danej cieczy prężność pary nasyconej w danej temperaturze. Prężność pary nasyconej nie zależy od ilości substancji znajdującej się w poszczególnych fazach ani też od zajmowanych przez nią objętości Jest ona głównie funkcją temperatury i stanowi miarę stężenia substancji w fazie gazowej. Przy ponownych podgrzaniu układu zamkniętego rośnie temperatura. I zostaje zachwiany stan równowagi. Wzrasta energia cząsteczek , rośnie szybkość parowania , maleje szybkość skraplania , wzrasta prężność pary nad roztworem. Ponownie ustala się stan równowagi na innym poziomie temperatury. Każdej temperaturze T odpowiada właściwa dla niej prężność pary nasyconej p. Gdy prężność pary nad cieczą w otwartym naczyniu stanie się równa ciśnieniu zewnętrznemu, wtedy parowanie zachodzi w całej objętości cieczy, jest to proces wrzenia. Gdy ciśnienie zewnętrzne jest równe 1 atmosferze, odpowiadająca mu temperatura nosi nazwę normalnej temperatury wrzenia. Krzywa będąca miejscem geometrycznym punktów, charakteryzujących stan równowagi między fazami ciekłą i gazową nosi nazwę krzywej parowania. Krzywa ta urywa się w punkcie krytycznym, gdzie zanika różnica między cieczą i parą, a powyżej istnieje tylko jedna faza - gazowa.
Proces parowania wymaga dostarczenia do układu pewnej ilości energii na sposób ciepła , która w odniesieniu do 1 mola danej cieczy nosi nazwę molowego ciepła parowania ΔH i jest zużywana na zwiększenie energii cząsteczek opuszczających ciecz ( wewnętrzne ciepło parowania Li ) oraz na pracę A rozszerzenia układu od objętości molowej cieczy do objętości molowej pary przeciw ciśnieniu zewnętrznemu p :
A = p ( V(g) - V(c) ) (1)
Molowe ciepło parowania jest sumą obydwu tych udziałów :
L = Li + p ( V(g) - V© ) (2)
W dużym oddaleniu od punktu krytycznego V(g)>>V© wzór drugi upraszcza się do postaci :
L = Li + pV(g) = Li + RT (3)
Ciepło parowania zmniejsza się ze wzrostem temperatury.
Proces parowania jest przemianą pierwszego rzędu (pierwszego rodzaju ) tj. taką, w której skokowo zmieniają się wartości pierwszych pochodnych potencjału termodynamicznego. Inne funkcje, np. entalpia molowa, entropia molowa, molowa energia wewnętrzna, molowa objętość i molowe ciepło właściwe w punkcie przemiany wykazują nieciągłość.
Relacje między ciśnieniem równowagowym i temperaturą wyraża równanie Clausiussa - Clapeyrona :
![]()
(4)
Po rozdzieleniu zmiennych i scałkowaniu równanie to ma postać :
![]()
(5)
gdzie : ΔH jest molowym ciepłem parowania cieczy.
1. Zestawienie danych uzyskanych w trakcie wykonywania doświadczenia :
Ciśnienie atmosferyczne wynosi : patm. = 767 mm Hg.
T [C] |
T [K] |
1 / T =xi |
h1 [mmHg] |
h2 [mmHg] |
h [mmHg] |
p=patm - h |
lg p=yi |
xiyi |
xi2 |
21,1 |
294,25 |
0,00340 |
696 |
75 |
621 |
146 |
2,16435 |
0,00736 |
1,156×10-5 |
25,2 |
298,35 |
0,00335 |
686 |
88 |
598 |
169 |
2,22789 |
0,00746 |
1,122×10-5 |
29,1 |
302,25 |
0,00331 |
675 |
100 |
575 |
192 |
2,2833 |
0,00756 |
1,096×10-5 |
33,0 |
306,15 |
0,00326 |
665 |
113 |
552 |
215 |
2,33244 |
0,0076 |
1,063×10-5 |
36,9 |
310,05 |
0,00322 |
650 |
132 |
518 |
249 |
2,3962 |
0,00771 |
1,037×10-5 |
41,1 |
314,25 |
0,00318 |
630 |
155 |
475 |
292 |
2,46538 |
0,00784 |
1,011×10-5 |
SUMA |
|
0,01972 |
|
|
|
|
13,86956 |
0,04553 |
6,583×10-5 |
2. Sporządzenie wykresu ln p = f(1/T) :
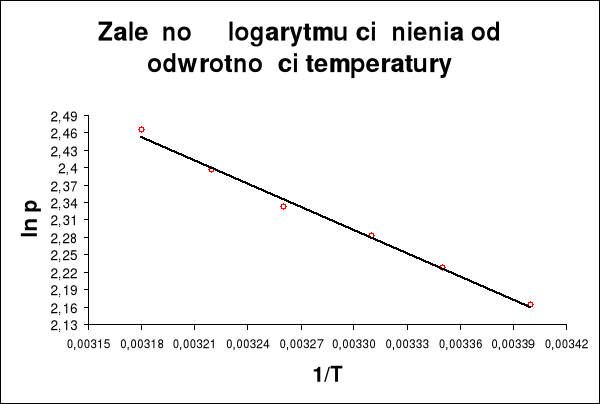
3. Obliczenie molowego ciepła parowania heksanu przy pomocy metody graficznej :
y = ax + b ![]()
![]()
gdzie: ![]()
Wybieramy dwa punkty z powyższego wykresu i przy pomocy ich współrzędnych położenia
korzystając z równania obliczamy współczynnik kierunkowy prostej :
![]()
współrzędne punktów : x1 = 0,00327 ; y1 = 2,34
x2 = 0,00336 ; y2 = 2,22
a = -1333,3
![]()
![]()
![]()
[J/mol]=25,53 [KJ/mol]
Obliczenie współczynnika a metodą najmniejszych kwadratów :
![]()
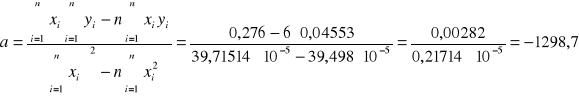
4. Obliczenie molowego ciepła parowania heksanu przy pomocy metody najmniejszych kwadratów :
![]()
[J/mol] = 24,863 [KJ/mol]
Wartość literaturowa dla Hpar=28850 [J/mol]=28,85 [KJ/mol]
5. Obliczenie odchylenia procentowego :
a). wartość wyznaczona metodą graficzną;
28,85 - 25,52 = 3,33
![]()
b). wartość wyznaczona metodą najmniejszych kwadratów:
28,85- 24,863 = 3,987
![]()