1.Definicja pracy i ciepła.
Praca- W- wielkość fizyczna skalarna związana z przemieszczaniem się ciała pod wpływem siły, określona jako iloczyn skalarny wektora tej siły F i wektora przemieszczenia r. W=F r
Jeżeli F=const., a droga jest odcinkiem linii prostej, to W=F r cosφ, gdzie φ- kąt między kierunkiem siły i drogi.
Praca w mechanice definiowana jest jako iloczyn skalarowy siły i drogi, tj. jako iloczyn drogi przez rzut siły na kierunek przesunięcia. W termodynamice konieczne jest uogólnienie pojęcia pracy, gdyż oprócz pracy mechanicznej może wystąpić praca wykonana przez prąd elektryczny, pole magnetyczne itp. Typowym w termodynamice przykładem wykonania pracy jest oddziaływanie tłoka na czynnik termodynamiczny zamknięty w cylindrze. Stosuje się przy tym umownie, że praca wykonana przez układ ma znak dodatni, natomiast wykonana przez otoczenie nad układem — znak ujemny.Jeżeli wykonanie pracy jest jedynym sposobem wzajemnego oddziaływania między układem a otoczeniem, to układ nazywamy adiabatycznym. Wykonanie pracy przez układ adiabatyczny wywołuje zmianę wartości funkcji stanu układu (energii).
L ad1,2=Eu2-Eu1
L ad1,2 - praca w procesie adiabatycznym
PRACA Jest to oddział energetyczny pomiędzy dwoma układami zamkniętymi(jeden może być otoczeniem ), podlegających takiej zamianie energii że zamiana energii jednego układu może być całkowicie wykorzystana do zamiany energii drugiego układu. Jedna z jakościowych postaci przekazywania energii (druga praca) :LX = FX * SX Gdy L>0 prace wykonuje układ gdy L<0 praca zostaje wykonana nad układem. Warunek wykonania pracy zależy od rodzaju przemiany termodynamicznej, a nie tylko od stanu początkowego i końcowego układu. Ponieważ praca graficznie przedstawiona jest jako pole przemiany ∫δL=L1,2a nie ΔL2 - L1 Występują różne rodzaje pracy:
1) praca zmiany objętości:
δL = F*ds.=p*A*ds.=pdv (bo p=F/A), L=![]()
pdx gdy dv>0 L>0 lub dv<0 L<0
2) praca użyteczna
3) praca techniczna suma prac przemian występujących w maszynie przepływowej. Całkowita praca wykonana w układzie składa się z 3 pozycji: A- praca wykonana przez gaz wchodzący do układu B- praca jaka musi być doprowadzona do układu aby gaz z niego usunąć C- praca zewnętrzna ,(praca zmiany objętości) związana ze zmianą obj.
Ciepło - Q- jedna z form przekazu energii między układami termodynamiczynymi. Dokładniej, proces przekazu energii za pośrednictwem oddziaływania termicznego nazywa się wymianą ciepła, a zmianę energii wewnętrznej układu, spowodowaną tym oddziaływaniem - ilością ciepła Q dostarczoną układowi.
Zgodnie z pierwszą zasadą termodynamiki pełna zmiana energii wewnętrznej ΔU układu zamkniętego jest równa ilości ciepła q dostarczonego układowi i pracy W wykonanej nad układem ΔU=Q+W. Jeżeli zmiana temp. Ciała ΔT spowodowana dopływem ciepła jest niewielka, to dostarczoną ciału ilość ciepła Q można wyznaczyć ze wzoru Q=mcΔT, gdzie: m- masa ciała, c-jego ciepło właściwe. W układzie SI jednostką ciepła jest dżul (J)
CIEPŁO; druga forma przekazywania energii z jednego układu do drugiego, jeżeli dwa stykające się układy nie zmieniają położenia ścianek. Przy założeniu, że nie występuje oddziaływanie między o charakterze mechanicznym mające cechy pracy. Takie oddziaływanie może występować, gdy są rożne temperatury układów. Q>0 ciepło dostarczone do układu Q<0 ciepło oddane przez układ. Warunki wymiany ciepła również zależą od przemian termodynamicznych nie zależą od stanu końcowego i początkowego
dQ=CdT C-pojemność cieplna układu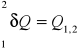
a nie
pojemność cieplna układu jest funkcja temperatury
ciepło właściwe c=c/m
Wartość opałowa
Wartość opałowa jest to ilość ciepła wydzielana przy spalaniu jednostki masy lub jednostki objętości paliwa przy jego całkowitym i zupełnym spalaniu, przy założeniu, że para wodna zawarta w spalinach nie ulega skropleniu, pomimo że spaliny osiągną temperaturę początkową paliwa.
Wd=Q-rw Q-ciepło spalania
Ciepło spalania to ilość ciepła wydzielana przy spalaniu jednostki masy lub jednostki objętości paliwa przy jego całkowitym i zupełnym spalaniu, przy założeniu, że spaliny osiągają temperaturę początkową paliwa i trwały dla nich stan skupienia w danych warunkach termodynamiczych.
Równanie kryterium przy konwekcji burzliwej.
Równanie kryterium przy konwekcji burzliwej. KONWEKCJA: Może być wymuszona lub swobodna (gdy działają siły wyporu). Zwykle konwekcja swobodna nakłada się na wymuszoną. K. wymuszona występuje w ruchu burzliwym. W urządzeniach chodzi głownie o k.α =λ/e*(T-V)*(T-V'), (bliskie jedności). Przy konwekcji wymuszonej występuje 6 par niezależnych chemicznie współczynników przenikania α(W,J,Cp,λ,V,l). A przy konwekcji swobodnej α zależy od:
α(T-V,β,J,Cp, λ,,V,l,g) β- współczynnik rozszerzalności objętościowej. Teoria podobieństwa 1) podob. geometryczne 2) podob. hydrologiczne analiza wymiarowa wykorzystuje warunek zgodności jednostek i miar w równaniach fizycznych Współczynnik α można wyrażić za pomocą szeregu funkcyjnego 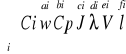
![]()
prędkość, ciepło gęstość wsp. kinematyczny lepkości każdy z tych par ma swój wymiar fizyczny.
Równanie kryterium przy konwekcji burzliwej ![]()
gdzie: Nu =(α*l/λ) Re=w*l/V Pr=(CpJV/λ)
Praca techniczna i sposób jej obliczania.
Praca techniczna - suma prac przemian występujących w maszynie przepływowej. Pierwsza zasada termodynamiki dla układów otwartych, mówi nam że praca techniczna jest równa ciepłu dostarczanemu do układu i pomniejszona o zmianę entalpii. I można to przedstawić :L1,2 = p2V2- p1V1+Lt1,2
U2-U1 = Q,1,2 - (p2V2 - p1V1+Lt1,2)
![]()
Lt1,2 = (U1+p1V1) - (U2+p2V2) + Q Lt1, 2Wyrażenie U+pV jest funkcją stanu i została wyprowadzona przez Gibsa i nazywa się entalpią I. Zaś wyrażenie pV jest określane pracą przetłaczania.Lt1,2= I 1- I 2 + Q1,2I można pracę techniczną przedstawić na wykresie p-V:
Lt1,2=∫Vdp Natomiast wyrażenie 1 zasady termodynamiki z uwzględnieniem energii kinetycznej i potencjalnej będzie miało postać:
Lt1,2 = I2*- I1* + Q1,2I*- entalpia spiętrzenia
Jakie przemiany zachodzą w obiegu Carnota.
Obieg Carnota - cykl termodynamiczny złożony z dwóch przemian izotermicznych i dwóch przemian adiabatycznych. W cyklu Carnota, z gazem jako ciałem roboczym, gaz rozpręża się po czym ochładza się przez adiabatyczne rozprężanie do temp. Chłodnicy T2, następnie spręża się izotermicznie oddając ciepło Q2 do chłodnicy i w czasie adiabatycznego sprężania powraca do stanu wyjściowego. Silnik cieplny pracujący na zasadzie cyklu Carnota nazywa się silnikiem Carnota. Jeżeli wszystkie przemiany w cyklu są odwracalne, to mówi się o odwracalnym cyklu Carnota i idealnym silniku Carnota.
Zgodnie z II zasadą termodynamiki sprawność dowolnego cyklu Carnota nie może być większa od sprawności odwracalnego cyklu Carnota równej ηc=1-T2/T1
Odwracalny cykl Carnota jest wykorzystywany do określania termodynamicznej skali temperatur. Odwrotny cykl Carnota jest podstawą pracy urządzeń chłodniczych.
Punkt potrójny wody.
Punkt potrójny- punkt równowagi termodynamicznej trzech faz substancji jednoskładnikowej, np.: wody, pary wodnej i lodu. Zgodnie z regułą Gibbsa punktowi potrójnemu odpowiada ściśle określona wartość ciśnienia i temperatury, co uzasadnia stosowanie punktu potrójnego jako stałych punktów na skalach temperatur.
Ciało doskonale szare.
Stała absorpcyjność przy różnych długościach fali. Zdolność absorpcyjna danego ciała nie zależy od długości fali padającej na to ciało.
I zasada termodynamiki.
I Zasada termodynamiki
Ciepło pobrane przez układ jest równe zmianie energii wewnętrznej i wykonanej pracyΔQ=ΔU+W lub ΔU=ΔQ+U czyli ciepło i praca są sobie równoważne.
Opisać przenikanie przez ściankę płaską.
Rodzaje wymiany ciepła:1) przez przewodzenie i odbywa się tylko i wyłącznie w ciałach stałych, nie towarzyszy transport masy konwekcje 2) transport ciepła, któremu towarzyszy transport masy 3) promieniowanie - transport ciepła za pomocą fal elektromagne. Rys
q- przejmowanie ciepła po stronie wewnętrznej i zewnętrznej α- współczynnik przejmowania ciepła 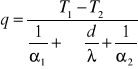
(W/m2) gdzie :![]()
![]()
- opór przejmowania ciepła po stronie wewnętrznej (dla ![]()
po stronie zewnętrznej) ![]()
R- opór
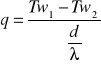
gdy podana temperatura na powierzchni ścianki i temperatura oddalona
Q= q*A (W) gdzie q- gęstość strumienia ciepła Q- strumień ciepła. Rozkład temperatur w ściance płaskiej, rozkład ten jest liniowy T(x)= ((T2 - T1)/δ)x +T1
Definicja entalpii.
Entalpia funkcja stanu wprowadzona przez Gribbsa
I=U+p*V
U- energia wewnętrzna układu
p- ciśnienie
V- objętość
W procesach izobarycznych, kiedy ponadto Wn=0 (praca nieobjętościowa), ciepło doprowadzane lub odprowadzane jest równoważne zmianie entalpii
Entalpia- to energia wewnętrzna plus praca. Jest to funkcja tych samych parametrów co energia wewnętrzna.
Dla parametrów entropii S i ciśnienia p. Nazwa „funkcja cieplna” jest związana z faktem, iż w przemianie izobarycznej (p=const.) zmiana entalpii jest równa ciepłu Q dostarczonemu układowi. Ciepło dostarczone do układu jest ze znakiem „+”, a praca wykonana nad układem „-”
Definicja entalpii parowania.
Przyrost entalpii 1 kg substancji przy przejściu od punktu pęcherzyków do punktu rosy nazywa się entalpią parowania r: r=r''-r'
Entalpia parowania zależy od temperatury parowania, czyli od ciśnienia nasycenia.
Prawo Fouriera
Inaczej prawo przewodzenia ciepla ![]()
T(x,y,z)- skalarne pole temperatury λ- przewodność ciepła (w/mK).Przepływ może być 1)ustalony - strumień ciepła jest funkcją(x,y,z) 2) nieustalony - strumień ciepła jest funkcją(x,y,z) i czasu. Najczęściej zakłada się ze przepływ jest ustalony ![]()
dla przypadku jednowymiarowego: ![]()
.Korzystanie z prawa Fouriera wymaga znajomość λ, które zależy od struktury fizycznej materii. a podstawie tego prawa można zdefiniowac λ:
λ=q/(dt/dx) wielkość ta charakteryzuje wszelkiego rodzaju metale: λ dla gazów λpow. = 0,0024 Materiały o małym λ to dobre izolatory, a o dużym dobre przewodniki
Praca bezwzględna i ciepło spalania.
Ciepło spalania to ilość ciepła wydzielana przy spalaniu jednostki masy lub jednostki objętości paliwa przy jego całkowitym i zupełnym spalaniu, przy założeniu, że spaliny osiągają temperaturę początkową paliwa i trwały dla nich stan skupienia w danych warunkach termodynamiczych.
Kiedy ciepło właściwe całkowite przemiany politropowej będzie ujemne.
Dla 1<z<χ mamy ujemne ciepło właściwe, to znaczy c=dQ/dT<0 oznacza to, że doprowadzone do układu ciepło dQ>0 powoduje obniżenie jego temperatury. Przy ujemnym cieple właściwym (c<0) ciepło termodynamiczne wykonuje pracę pdV zarówno w wyniku doprowadzonego ciepła, jak też kosztem jego energii wewnętrznej.
Współczynnik przenikania ciepła.
Wartość-K (współczynnik przenikania ciepła) jest ilością ciepła mierzoną w W/m2K, która w jednostce czasu przenika przez element budowlany o powierzchni 1m2 przy różnicy temperatur 1K, zwaną też stratą ciepła przez przenikanie.
Zasada ekwipartycji energii.
Zasada ekwipartycji energii- jedno z podstawowych twierdzeń fizyki statystycznej głoszące, że w układzie nieoddziałujących cząsteczek podlegającym prawom fizyki klasycznej i znajdującym się w stanie równowagi o temperaturze bezwzględnej T, na każdy stopień swobody cząsteczki translacyjny lub rotacyjny przypada średnio energia ½ kT, a na oscylacyjny energia kT, gdzie k - stała Boltzmanna.
Przykładowo, średnia energia kinetyczna sferycznie symetrycznej cząsteczki gazu doskonałego (3 stopnie swobody) wynosi 3/2 kT. Zasada ekwipartycji energii umożliwia wyznaczenie energii wewnętrznej i ciepła właściwego gazów doskonały
Składniki energii wewnętrznej
Energia wewnętrzna- U- ekstensywna funkcja stanu, której istnienie postuluje pierwsza zasada termodynamiki. Energia wewnętrzna jest określona z dokładnością do stałej addytywnej, ponieważ jej zmiana ΔU w przemianie adiabatycznej jest równa pracy W wykonanej nad układem ΔU=W. Z mikroskopowego punktu widzenia e. w. jest równa sumie średnich wartości energii kinetycznej bezładnego ruchu cząstek układu oraz energii oddziaływań międzycząsteczkowych i wewnątrzcząsteczkowych.Energia wewnętrzna jest funkcją stanu układu (ciała), przy czym nie zależy od parametrów określających prędkość i położenie ciała. Przyjmuje się, że zależy ona od temperatury, ciśnienia i objętości ukiadu (tylko dwa z tych parametrów mogą zmieniać się niezależnie od siebie).
Głównymi składnikami energii wewnętrznej są:
1. energia kinetyczna ruchu postępowego i rotacyjnego drobin
2. energia ruchu drgającego atomów w drobinie
3. energia potencjalna w polu wzajemnego przyciągania się drobin
4. energia chemiczna, związana z możliwością przebudowy drobin
5. energia jądrowa
Od czego zależy emisja promieniowania.
Promieniowanie cieplne - promieniowanie termiczne; promieniownaie elektromagnetyczne emitowane pod wpływem tepmperatury przez ciała znajdujązce się w stanie równowagi termodynamicznej. Uzyskanie stanu równowagi jest możliwe tylko wówczas, gdy ciało jest zamknięte nieprzezroczystymi ściankami, przy czym temp. Ścianek jest równa temp. Ciała. Zgodnie z prawem Prevosta wszystkie ciała stałe i ciekłe emitują promieniowanie cieplne bez względu na sąsiedztwo innych ciał. Promieniowanie cieplne zależy od własności fizycznych i chemicznych ciała, a w przypadku ciał stałych przede wszystkim od ich powierzchni zewnętrznej.
2
Wyszukiwarka
Podobne podstrony:
Strona tytuowa, fdff, Technika cieplna
PV, fdff, Technika cieplna
const p1, fdff, Technika cieplna
Strona tytuowa, fdff, Technika cieplna
sciaga cieplo!, SGGW Technika Rolnicza i Leśna, Technika cieplna
cieplo 2 kolos2, SGGW TRiL, Technika Cieplna Tril sggw
PWTC C2, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab moje
Badanie nagrzewnicy powietrza, Technika cieplna
Przewodzenie ciepła@-3, Technika cieplna
kinetyka moja-technika, Technika cieplna
sprawozdanie z wilgotności, studia, technika cieplna
Termoanemometr, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab wynik
Rotametr, UCZELNIA ARCHIWUM, UCZELNIA ARCHIWUM WIMiIP, Pomiary w Technice Cieplnej, lab wynik zajac
więcej podobnych podstron