PRZEBIEG REAKCJI ODWRACALNEJ
Równowaga chemiczna
PRZEBIEG REAKCJI ODWRACALNEJ
Stężenie
C (substratów)
współrzędna postępu reakcji
Prawo działania mas - (prawo Gulgberga i Waagego)
W stałej temperaturze iloczyn stężeń produktów podniesiony
do potęg równych współczynnikom stechiometrycznym w równaniu reakcji
do analogicznego stężenia substratów jest wielkością stałą i nosi nazwę
stałej równowagi reakcji chemicznej.
aA + bB cC + dD
T = constans
[C]c*[D]d
[A]a*[B]b
Rodzaje stałych równowagi
[ A]a . [B]b
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
ZALEŻNOŚCI POMIĘDZY STAŁYMI
RÓWNOWAGI REKCJI
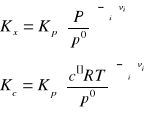
Kc - stała stężęniowa Kp - stała ciśnieniowa Kx - stała wyrażona poprzez ułamki molowe reagentów
po - ciśnienie wzorcowe c□ - stężenie wzorcowe
Σν - suma algebraiczna współczynników stechiometrycznych w równaniu reakcji (produkty odjąć substraty)
szczególna stała to I. Stała równowagi reakcji dysocjacji zwana - STAŁĄ DYSOCJACJI
Wielkości opisujące ilościowo reakcje dysocjacji:
Stopień dysocjacji - określa ułamek drobin, które rozpadły się na jony.
(α ε <0,1> lub α ε <0%, 100%>)
α =
zamiast ilości moli można używać w obliczeniach
ilości jonów lub stężenia molowe indywiduów chemicznych
α= α (rodzaju substancji i rozpuszczalnika, T, c)
gdy stężenie rośnie ═► α maleje;
gdy temperatura rośnie ═► α rośnie
dla reakcji dysocjacji typu MenAm = nMem+ + mAn- stężenia jonów wynoszą odpowiednio: [Mem+] = α * cmol * n
[An-] = α * cmol * m
Stała dysocjacji - odpowiedni stosunek stężeń jonów i cząsteczek niezdysocjowanych, zgodnie z prawem
działania mas
(wielkość tablicowa, stała dla danej temperatury)
prawo rozcienczeń Ostwalda
(podaje zależność pomiędzy stopniem i stałą dysocjacji)
dla słabego, jednoprotonowego elektrolitu
α ≤ 5% lub c/K >400 ═► α = (K:c)½
ogólnie ═► α = (α2 * cmol): (1 - α)
Uwaga: Dla wieloprotonowych elektrolitów w tablicach znajdują się kolejne stałe np.: dla H3PO4 - K1, K2, K3.
Do obliczeń stosuje się stałą K1 ponieważ największa ilość drobin ulega pierwszemu etapowi dysocjacji. NIGDY! Nie stosuj do obliczeń stałej K = K1*K2* K3 - pomimo, ze na papierze po przekształceniu
i niedozwolonym zsumowaniu stronami równań dysocjacji - stała będzie miała taką postać jak po wykonaniu mnożenia wyrażeń na stałe - wynik otrzymany w tan sposób nie ma nic wspólnego z prawdą. Jeżeli masz podać dokładny wynik, musisz liczyć etapami - jony otrzymane w pierwszym etapie są substratami do następnego etapu.
szczególna stała to II. Iloczyn jonowy wody
Dla T=22+273 [K] (220C) iloczyn jonowy* wody jest wielkością stałą i wynosi 10-14.
[H3O+] * [OH-] = 10-14
(* iloczyn jonowy - to iloczyn stężeń jonów na, które ulega dysocjacji dana substancja chemiczna;
z uwzględnieniem współczynników chemicznych z równania dysocjacji.)
pH = -log[H+]
pOH = - log [OH-]
pH + pOH = 14
stężenia jonów lub pH, pOH |
odczyn kwaśny |
odczyn obojętny |
odczyn zasadowy |
[H+] |
100, 10-1, 10-2, 10-3, 10-4, 10-5 ,10-6 |
10-7 |
10-8,10-9, 10-10, 10-11,10-12,10-13,10-14 |
[OH-] |
10-14,10-13,10-12,10-11,10-10,10-9,10-8 |
10-7 |
10-6, 10-5,10-4, 10-3, 10-2, 10-1, 100 |
pH |
0, 1, 2, 3, 4, 5, 6 |
7 |
8, 9, 10, 11, 12, 13, 14 |
pOH |
14, 13, 12, 11, 10, 9, 8 |
7 |
6, 5, 4, 3, 2, 1, 0 |
lakmus |
odczyn kwaśny |
odczyn obojętny |
odczyn zasadowy |
fenolo-ftaleina |
odczyn kwaśny |
odczyn obojętny |
odczyn zasadowy |
oranż metylowy |
odczyn kwaśny |
odczyn obojętny |
odczyn zasadowy |
Wskaźniki chemiczne -
(indykatory)
słabe zasady lub kwasy organiczne, których forma zdysocjowana
i niezdysocjowana wyraźnie różnią się barwą
a proces zachodzi przy określonej wartości pH roztworu.
szczególna stała to III. Iloczyn rozpuszczalności soli trudno rozpuszczalnej
(licznik z prawa działania mas dla soli trudno rozpuszczalnej)
MenAm = nMem+ + mAn-
IR=[Mem+]n * [An-]m dla T = constans IR = constans
gdy IR > iloczynu stężeń jonów w roztworze to wytrąca się osad
gdy IR < iloczynu stężeń jonów w roztworze to osad się nie wytrąca
gdy IR = iloczynowi stężeń jonów w roztworze to układ pozostaje
w równowadze dynamicznej
szczególna stała to IV. Stała hydrolizy
oraz związane z tym obliczanie pH soli zhydrolizowanych
stała hydrolizy soli słabego kwasu i mocnej zasady; np. NaNO2
NaNO2 Na+ + NO2-
NO2- + H2O HNO2 + OH -
KH =
Następnie mnożymy obustronnie przez:
jedynkę matematyczną i otrzymujemy:
KH =
Wiedząc, że dla reakcji dysocjacji kwasu: HNO2 H+ + NO2-
KAcid =
otrzymujemy: KH =
analogicznie wyprowadzając wzory dla soli słabej zasady i mocnego kwasu otrzymamy:
KH =
analogicznie wyprowadzając wzory dla soli słabej zasady i słabego kwasu otrzymamy:
KH =
stopień hydrolizy - β - określa ułamek drobin, które uległy hydrolizie
β =
Bufory oraz obliczanie pH roztworów buforowych
Bufory to roztwory posiadające zdolność do zachowywania
stałej wartości pH podczas dodawania niewielkich ilości mocnych kwasów i zasad
Budowa roztworu buforowego (woda + ...)
słaby kwas i jego sól z mocną zasadą (CH3COOH, CH3COONa)
słaba zasada i jej sól z mocnym kwasem (NH3, NH4Cl)
dwie sole kwasu wieloprotonowego (Na2HPO4, NaH2PO4)
sól (NH4Cl, po hydrolizie powstaje NH3)
Działanie roztworu buforowego
bufor octanowy CH3COONa ―►CH3COO- + Na+
w roztworze zachodzą reakcje: CH3COOH + H2O CH3COO- + H3O+
podczas dodawania mocnego kwasu: H3O+ + CH3COO-―► CH3COOH
podczas dodawania mocnej zasady: OH- + CH3COOH ―►H2O + CH3COO-
bufor amonowy NH4Cl ―► NH4+ + Cl-
w roztworze zachodzą reakcje: NH3 + H2O NH4+ + OH-
podczas dodawania mocnego kwasu: H3O+ + NH3 ―► NH4+ + H2O
podczas dodawania mocnej zasady: OH- + NH4+ ―► NH3 + H2O
pH roztworu buforowego
bufor octanowy
w roztworze zachodzą reakcje: CH3COOH + H2O CH3COO- + H3O+
CH3COONa ―►CH3COO- + Na+
[H3O+] * [CH3COO-]
[CH3COOH]
[CH3COOH]
[H3O+] = Ka *
[CH3COOH] = c kwasu (bo w obecności całkowicie zdysocjowanej soli cofa się dysocjacja kwasu)
[CH3COO-] = csoli
po zlogarytnowaniu
pH = pKa + log(csoli / ckwasu) gdzie pKa = - log Ka
bufor amonowy
w roztworze zachodzą reakcje: NH3 + H2O NH4+ + OH-
NH4Cl ―► NH4+ + Cl-
[OH-] * [NH4+]
[NH3]
[NH3]
[OH-] = Kb * [NH4+]
[NH3] = c zasady
[NH4+]= csoli po podstawieniu iloczynu jonowego wody (Kw=[H3O+]*[OH-]) i zlogarytnowaniu
pH = (pKb- pKw) + log(csoli / ckwasu)
( dla rozpuszczalnika Ka* Kb = Kw, gdzie „a” i „b” to układ sprzężony)
pKb- pKw = pKa
pH = pKa + log(csoli / ckwasu)
zależność stałej od temperatury
dla danej substancji i rozpuszczalnika K = K(T)
K( c )
aA + bB cC + dD
T = constant => K = constant => wzrost CC lub CD
powoduje, że CA lub CB musi wzrosnąć
Reguła przekory
(La Chateliera - Brauna)
Gdy w układzie zostanie zaburzony stan równowagi chemicznej
to rozpocznie się taka przemiana, która będzie
przeciwdziałać zmianom, które ją wywołały.
N2 + 3H2 2NH3 + Q lub ΔH= ─
Q i ΔH to ciepło reakcji chemicznej
[N2] lub [H2]![]()
rośnie reakcja biegnie w prawo
[N2] lub [H2] maleje reakcja biegnie w lewo
[NH3] rośnie reakcja biegnie w lewo
[NH3] maleje reakcja biegnie w prawo
T (temperatura) rośnie reakcja biegnie w lewo
T (temperatura) maleje reakcja biegnie w prawo
p (ciśnienie) rośnie reakcja biegnie w prawo
p (ciśnienie) maleje reakcja biegnie w lewo
UWAGA! Gdy w trakcie procesu chemicznego nie zmienia się sumaryczna ilość moli reagentów
(n substratów = n produktów) to ciśnienie nie wywiera wpływu na stan równowagi chemicznej.
Produkcja NH3:
wysokie ciśnienie, niska temperatura*, duże stężenia N2 i H2, odprowadzanie NH3
*niska temperatura w syntezie nieorganicznej to około 500 o C
Iwona K®ól - nauczyciel chemii VIII LO
„Notatki ucznia”
5
C' (produktów)
K=
[C]c . [D]d
STAŁA STĘŻENIOWA
Kc=
![]()
![]()
![]()
![]()
STAŁA wyrażona poprzez UŁAMKI MOLOWE
Kx=
![]()
![]()
STAŁA CIŚNIENIOWA
![]()
![]()
Kp=
n zdysocjowane
nwprowadzone
K
T
Ka=
Kb=
[HNO2] * [OH -]
[NO2-]
[H3O+]
[H3O+]
[HNO2] * [OH -] * [H3O+]
[NO2-] * [H3O+]
[NO2-] * [H3O+]
[HNO2]
Kw
KA
Kw
KB
A - Acid - kwas
B - base - zasada
Kw
KA * KB
[CH3COO-]
2
√ KH/cmol