Energia całkowita 
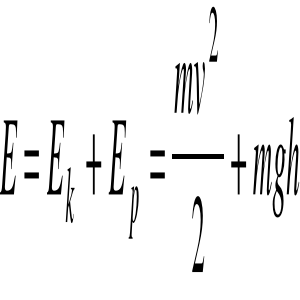
Substancja (ciśn. 1013 hPa) |
J/kg |
Alkohol etylowy |
854000 |
Aluminium (glin) |
9210000 |
Azot (N) |
198200 |
Chlor (Cl) |
288000 |
Cynk (Zn) |
1754000 |
Eter |
355000 |
Hel (He) |
25000 |
Miedź |
4800000 |
Ołów (Pb) |
871000 |
Platyna (Pt) |
110000 |
Rtęć (Hg) |
290000 |
Srebro (Ag) |
2357000 |
Tlen (O2) |
213000 |
Woda |
2300000 |
Wodór (H) |
452000 |
Wolfram (W) |
4960000 |
Żelazo (Fe) |
6300000 |
Ciepło parowania
Substancja (101325 Pa) |
Temperatura wrzenia oC |
Ciepło parowania J / kg |
Alkohol Etylowy |
78 |
854000 |
Azot |
-196 |
199000 |
Eter |
35 |
373000 |
Hel |
-296 |
25000 |
Ołów |
1750 |
871000 |
Woda |
100 |
2300000 |
Wodór |
-257 |
452000 |
Wolfram |
5900 |
400000 |
Rtęć |
356 |
296000 |
Tlen |
-183 |
213000 |
Żelazo |
3050 |
58000 |
._Jak obliczamy energię i w jakich jednostkach ją mierzymy?
Energia całkowita 
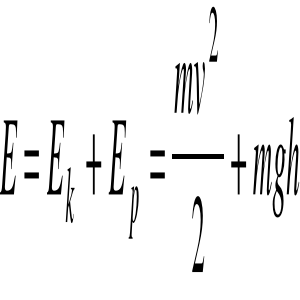
Energia w gazach 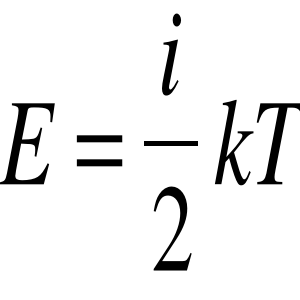
gdzie:
i - ilość stopni swobody danej cząstki (w ilu kierunkach może się poruszać)
k - stała Boltzmanna 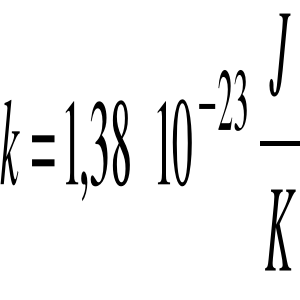
T - temperatura
Ogólnie zaś przyrost energii możemy policzyć ze wzoru
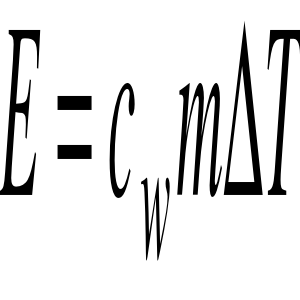
gdzie:
cw - ciepło właściwe substancji
m - masa substancji
ΔT - przyrost temperatury
Energię mierzymy w dżulach ( 1J ) albo kaloriach ( 1 cal )
sposoby obliczania ciepła, stosowane jednostki miary i związki między nimi.
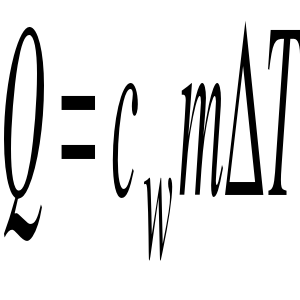
gdzie cw - ciepło właściwe
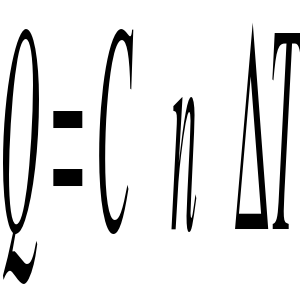
gdzie C - ciepło molowe, n - ilość moli substancji
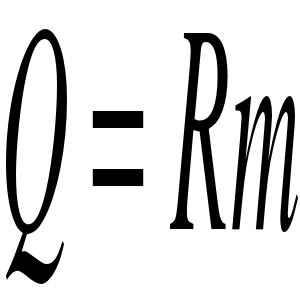
gdzie R - ciepło parowania
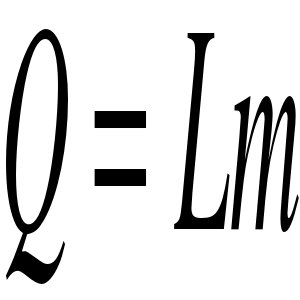
gdzie L - ciepło topnienia
Zwykle jako jednostkę miary stosuje się dżul (1J), albo kalorie (1 cal) 1cal = 4,19J
3. Ciepło parowania i skraplania.
Jeśli ciecz ogrzaną do temperatury wrzenia ogrzewamy dalej, to ciecz wrze,
ale jej temperatura nie zmienia się mimo stałego dopływu ciepła
z zewnątrz. Stąd wniosek, że parowanie wymaga dostarczenia energii (ciepła).
wykorzystywana jest ona na zwiększenie energii potencjalnej cząsteczek cieczy.
Jej ilość jest wprost proporcjonalna do ilości (masy) cieczy.
Ciepłem parowania substancji nazywamy ilość energii (ciepła), którą należy dostarczyć
1kg tej substancji, aby całkowicie wyparowała (bez zmiany temperatury).
Ciepło parowania oznaczamy literą cp.
Jego jednostką jest J / kg.
Podczas skraplania parze należy odebrać energię, aby zmienić jej stan skupienia.
Ciepłem skraplania substancji nazywamy ilość energii (ciepła), którą należy odebrać
1kg tej substancji, aby ją całkowicie skroplić (bez zmiany temperatury).
Ciepło skraplania oznaczamy literą cs.
Jego jednostką również jest J / kg.
Dla tej samej substancji i w tych samych warunkach:
cp = cs
1. Co to jest bilans cieplny?
Jeżli zetkniemy ze sobą dwa ciała o różnej temperaturze, to następuje między nimi wymiana ciepła. ciało o wyższej temperaturze oddaje (traci) ciepło, a ciało o niższej temperaturze pobiera (zyskuje) ciepło. Wymiana ciepła kończy się, gdy temperatury obu ciał wyrównają się.
Jeżli ilość ciepła pobranego przez ciało o niższej temperaturze jest równa ilości ciepła oddanego przez ciało o wyższej temperaturze, to mówimy, że zachodzi bilans cieplny.
2. Bilans cieplny.
Zysk ciepła = strata ciepła
Mamy dwa ciała:
I ciało: |
m1, c1, t1 |
II ciało: |
m2, c2, t2 |
t1 > t2
Temperatura końcowa obu ciał wynosi t.
Pierwsze ciało traci ciepło. Strata ciepła wynosi:
Q1 = m1 c1 (t1 - t)
Drugie ciało pobiera ciepło. Zysk ciepła wynosi:
Q2 = m2 c2 (t - t2)
Bilans cieplny:
|
Jest to wzór na bilans cieplny.
Korzystając z niego możemy obliczać wszystkie zawarte w nim wartości.
Jednostki ciśnienia
Nazwa jednostki |
Znak |
at |
Atm |
1mm sł. rtęci 1 tor |
1 metr sł. wody |
mb |
Atmosfera techniczna 1kG/cm2 |
at |
1 |
0,968 |
736 |
10 |
980,7 |
Atmosfera fizyczna |
Atm |
1.033 |
1 |
760 |
10,33 |
1013,2 |
1 mm Hg (1 tor) |
Tr |
0,00136 |
0,00132 |
1 |
0,013 |
1,333 |
1 m słupa wody (przy 4C) |
|
0,1 |
0,0968 |
73,55 |
1 |
98,07 |
1 paskal |
N/m2 |
0,010x10-3 |
|
|
|
|
1 milibar |
mb |
0,001019 |
0,000987 |
0,75 |
10190 |
1 |
4