Wymienić typy reakcji chemicznych z podaniem przykładu w zapisie jonowym i cząsteczkowym
Wyróżniamy trzy typy reakcji:
reakcja syntezy
2H2 + O2 2H2O
2H20 + O20 2H+ + 2OH-
reakcja analizy (rozpadu)
2H2O 2H2 + O2
2H+ + 2OH- 2H20 + O20
reakcja wymiany
wymiany pojedynczej
Na + H2SO4 Na2SO4 + H2
Na0 + 2H+ + SO42- 2Na+ + SO42- + H20
wymiany podwójnej
2NaOH + H2CO3 Na2CO3 + H2O
2Na+ + 2OH- + 2H+ + CO32- 2Na+ + CO32- + 2H+ +2OH-
Podaj charakterystykę stanu gazowego i prawa nim rządzące
Gazem doskonałym nazywamy pewien wyidealizowany stan materii (fazy gazowej) spełniający warunki:
cząsteczki gazu zachowują się jak jednorodne kule doskonale sprężyste
objętość własna jaką zajmują może być zaniedbana w stosunku do objętości gazu
cząsteczki gazu są w ciągłym ruchu, nieustannym ruchu a zderzenia między nimi są doskonale sprężyste
cząsteczki gazu nie oddziaływają na siebie do czasu zderzenia
ruch cząsteczek jest całkowicie chaotyczny.
Prawa rządzące stanem gazowym:
prawo Boyle'a
prawo Gay-Lussaca
Prawo Boyle'a mówi iloczyn ciśnienia i objętości w stałej temperaturze jest stały
pV = const, gdy T=const
Prawo Gay-Lussaca mówi o zależności objętości gazu od temperatury przy stałym ciśnieniu i brzmi następująco przy stałym ciśnieniu objętość danej masy gazu jest wprost proporcjonalna do temperatury
V = V0 (1 + αt)
Omówić I zasadę termodynamiki, wykazać różnice pomiędzy przemianami nieodwracalnymi i odwracalnymi.
Podstawę termochemii stanowi pierwsza zasada termodynamiki, która stwierdza, że w układzie izolowanym całkowita ilość energii pozostaje stała. Aby zawęzić tę zasadę wprowadzamy pojęcie energii wewnętrznej.
I zasada termodynamiki brzmi: zmiana energii wewnętrznej zależy od stanu początkowego i końcowego w jakich znajdowały się reagenty, ale nie zależy od drogi przejścia danego układu z jednego stanu do drugiego.
ΔU = U2 - U1
Gdybyśmy chcieli odwrócić przemianę nieodwracalną ciśnienie zewnętrzne będzie musiało przyjąć wartość większą od ciśnienia wewnętrznego i droga przejścia ulegnie zmianie.
W przemianie odwracalnej droga, po której następuje przemiana w obu kierunkach jest taka sama i ciśnienie praktycznie po obu stronach takie samo.
Dla reakcji mocnej zasady i słabego kwasu z wodą wyprowadzić wzór na stałą hydrolizy. Zapisać jonowo i cząsteczkowo.
CH3COONa + H2O < -- > CH3COOH + NaOH
CH3COO- + Na+ + H2O < -- > CH3COOH + Na+ + OH-
CH3COONa < -- > CH3COO- + Na+
CH3COO- + H2O < -- > CH3COOH + OH-
2H2O < -- > H3O+ + OH-
NaOH < -- > Na+ +OH-
Kh= Kw / Kk
Na czym polega zasada działania ogniwa Daniella. Podać zachodzące reakcje, uzasadnić jego działanie w oparciu o równanie Nernsta
Ogniwo Daniella to ogniwo składające się z dwóch odwracalnych półogniw. Schematycznie ogniwo to można przedstawić następująco:
Zn | ZnSO4 || CuSO4 | Cu
Znak || oznacza połączenie obu elektrod przewodnikiem jonowym. W praktyce jest to rurka wypełniona roztworem wodnym KCl i żelatyny, przez którą mogą przemieszczać się jony. Z chwilą połączenia obu metali przewodnikiem metalicznym o oporze R następuje przepływ prądu wywołany procesami elektrochemicznymi w ogniwie. Zachodzi reakcja utleniania cynku. Jony cynku oddalają się w głąb roztworu a elektrony wędrują przez przewód do elektrody miedzianej. Tam zostają zużyte w reakcji z jonami Cu2+ . W roztworach poruszają się jony: kationy w kierunku od anody do katody, natomiast aniony w kierunku katoda-anoda. W wyniku połączenia obu półogniw przewodnikiem elektronowym można zaobserwować przepływ prądu będący wynikiem różnicy potencjałów pomiędzy elektrodami. Różnica ta nosi nazwę siły elektromotorycznej ogniwa SEM. Możemy obliczyć ją za pomocą równania Nernsta:
Różnica potencjałów w ogniwie Daniella zależy więc od wzajemnego stosunku aktywności jonów miedziowych i cynkowych.
Zdefiniować proces dysocjacji dla wody w oparciu o teorię Brónsteda. Określić iloczyn jonowy wody i podać wzór dla roztworu kwasu azotowego (V) o stężeniu 0.0004g.
Zgodnie z teorią Brónsteda kwas to substancja zawierająca cząsteczki zdolne do oddawania protonów, zasada to substancja zawierająca cząsteczki zdolne do pobierania protonów. Kwas A oddając proton staje się zasadą B. Zasada łącząc się z protonem przechodzi z powrotem w kwas.
A B + H+
Zasada B jest sprzężona z kwasem A.
Cząsteczki wody wykazują zarówno zdolność pobierania protonów i oddawania. Dlatego też w czystej wodzie woda ulega autodysocjacji
H2O + H2O H3O+ + OH-
Ka = [H3O+][OH-] = 10-14
pKa = -logKa
pH = -log[H+]
pOH = -log [OH-]
pOH + pH = 14
Zapisz reakcję dysocjacji dla połączeń
Kwasu siarkowego (IV) z wodorotlenkiem wapnia
Kwasu chlorowego (VII) z wodorotlenkiem cynku.
Zapisz ich wzory strukturalne.
Na przykładzie tlenku … uzasadnij prawo stosunków
Jeżeli dwa pierwiastki tworzą więcej związków chemicznych niż jeden, to masy jednego pierwiastka, które łączą się z taką samą masą drugiego pierwiastka, mają się do siebie tak, jak proste liczby naturalne.
Np.
N2O 7:4
NO 7:8
NO2 7:16
Opisać na czym polega prawo okresowości
Okresowość zwana również prawem okresowości wynika z faktu, że liczba atomowa określa nie tylko liczbę protonów występujących w jądrze atomów, ale także liczbę elektronów atomów w stanie obojętnym.
Elektrony w atomach umiejscowione są na kolejnych powłokach, które mają określoną pojemność. Kolejne powłoki są zajmowane przez elektrony dopiero po całkowitym zapełnieniu powłok o mniejszej energii. Zjawisko to wynika z zakazu Pauliego, który stwierdza, że w atomie nie mogą występować elektrony, które nie różnią się przynajmniej jedną liczbą kwantową. Elektrony na ostatniej powłoce są najsłabiej związane z atomem i mogą się odrywać podczas tworzenia związków chemicznych. Powłoka ta może również przyjmować elektrony a energia wiązania tych dodatkowych elektronów ma kluczowe znaczenia przy powstawaniu związków chemicznych. Elektrony leżące niżej nie mogą uczestniczyć w reakcjach. Po zapełnieniu powłoki walencyjnej w obrębie okresu następuje przejście do kolejnego okresu. Można więc powiedzieć, że atomy występujące w tym samym okresie mają taką samą liczbę powłok elektronowych a występujące w tych samych grupach - taką samą ilość elektronów na powłoce walencyjnej.
Podać reakcję, uzasadnić proces elektrolizy siarczanu (VI) miedzi (II) na elektrodach grafitowych. Jakie prawo uzasadnia
Z punktu widzenia chemii elektroliza jest szeregiem reakcji prowadzących do rozpadu związków chemicznych, a następnie rozdzielenia produktów takiego rozkładu na skutek działania napięcia elektrycznego przyłożonego do roztworu dzięki przemieszczaniu się jonów w kierunku podłączonych do układu elektrod.
2H2O + 2CuSO4 -> O2 + 2Cu + 2H2SO4
2H2O + 2Cu(2+) + 2SO4(2-) -> O2 + 2Cu + 4H(+) + 2SO4(2-)
2H2O + 2Cu(2+) -> O2 + 2Cu + 4H(+)
A: 2H2O - 4e(-) -> O2 + 4H(+)
K: Cu(2+) + 2e(-) -> Cu
Pokazać , że reakcja MnO42- + H+ + Fe2+ Mn2+ + Fe3+ + H2O jest reakcją utleniania - redukcji, uzgodnić ją i wskazać utleniacz i reduktor.
Dlaczego pH roztworów buforowych nie ulega zmianie po dodaniu niewielkich ilości kwasów i zasad?
Bufory to roztwory będące mieszaniną słabego kwasu i jego soli z mocną zasadą oraz słabej zasady i soli tej zasady z mocnym kwasem. Związki buforowe wykazują właściwość, że przy dodaniu niewielkich ilości kwasu czy zasady nie powoduje zmiany pH.
Najprostszym roztworem o pewnych właściwościach buforujących może być każdy roztwór słabego kwasu lub słabej zasady.
Dla reakcji:
stała dysocjacji wynosi:
Jeżeli teraz do roztworu o tak określonej równowadze dodamy jonów wodorowych (np. kropla kwasu solnego) to w pierwszej chwili wzrost stężenia [H+] spowoduje wzrost wartości licznika we wzorze na stałą dysocjacji. Ten nadmiar kwasu powoduje cofnięcie się dysocjacji słabego kwasu (spadek stopnia dysocjacji), co w konsekwencji powoduje spadek stężenia jonów wodorowych i reszty kwasowej (maleje licznik) z jednoczesnym wzrostem stężenia niezdysocjowanego kwasu (rośnie mianownik) aż do momentu ponownego uzyskania stanu równowagi, czyli osiągnięcia wartości stałej dysocjacji K.
Jeżeli jednak do roztworu słabego kwasu dodamy odpowiednia ilość soli tego kwasu z silną zasadą (np. roztwór kwasu octowego i octanu sodu) to w ustalaniu się równowagi będą brały udział dwa czynniki - dysocjacja słabego kwasu i hydroliza soli słabego kwasu i silnej zasady. Ta ostatnia charakteryzuje się stałą hydrolizy
bowiem reakcję hydrolizy możemy zapisać jako:
We wzorze nie występuje stężenie wody, bowiem jego zmiany w tej reakcji są pomijalnie małe i jako wartość stała zostaje włączone w wartość Kh.
Względna masa molowa
Względna masa molowa to liczba wyrażająca stosunek masy danego atomu do 1/12 masy atomu izotopu 12C, czyli do 1,66*10-27kg.
Pierwiastek
Pierwiastek jest to zbiór wszystkich atomów posiadających jednakową liczbę protonów w jądrze o tej samej liczbie atomowej.
Izotop
Izotopem nazywamy odmiany jakiegoś pierwiastka różniące się masą atomową. Atomy poszczególnych izotopów noszą nazwę nuklidów. Izotopy tego samego pierwiastka mają nuklidy o tej samej liczbie atomowej, lecz o różnej masie.
Liczba masowa
Liczba masowa to liczba nuklidów ( suma protonów i neutronów ) w jądrze atomu.
Stężenie molowe
Stężenie molowe to stosunek ilości moli substancji rozpuszczonej ( n-moli ) do objętości roztworu ( Vr ).
gdzie m - masa substancji rozpuszczonej
M - masa substancji rozpuszczonej
Jednostką stężenia molowego jest mol/dm3
Stosunek wagowy
Stosunek wagowy mówi, że stosunek miarowy w każdym związku chemicznym jest stały, charakterystyczny dla danego związku chemicznego i nie zależy od sposobu powstawania związku,
np. dla związku AnBm
![]()
A,B - symbole pierwiastków
n,m - indeksy
mA,mB- miary pierwiastków A i B
Funkcje stanu
Funkcja stanu to w termodynamice funkcja zależna wyłącznie od stanu układu, czyli od aktualnych wartości jego parametrów, takich jak masa, liczność materii, temperatura, ciśnienie, objętość i inne.
Wartość funkcji stanu z definicji nie zależy od jego historii, tzn. tego co działo się z nim wcześniej. Jeśli udowodni się, że jakaś funkcja termodynamiczna jest zależna od historii układu, to wówczas nie jest to funkcja stanu, a funkcja procesu. Wynika z tego bezpośrednio inna podstawowa własność funkcji stanu:
Zmiana wartości funkcji stanu zależy tylko od stanu początkowego i końcowego układu, a nie od sposobu w jaki ta zmiana została zrealizowana.
W praktyce stosuje się zwykle następujące funkcje stanu:
Funkcje stanu są najczęściej wielkościami konceptualnymi, tj. takimi których nie możemy bezpośrednio zmierzyć
Stała równowagi chemicznej
Stała równowagi to współczynnik opisujący stan równowagi odwracalnych reakcji chemicznych. Stała ta jest równa ilorazowi reakcji w stanie doskonałej równowagi, tj. w sytuacji gdy szybkość reakcji w stronę od substratów do produktów i od produktów do substratów jest dokładnie taka sama.
wyrażenie na stałą równowagi wygląda tak:
gdzie nawiasy kwadratowe oznaczają stężenia molowe w przypadku roztworów lub molowe ciśnienia cząstkowe w przypadku gazów w stanie idealnej równowagi.
Wyrażenie to można rozszerzyć na dowolną liczbę reagentów dopisując w liczniku produkty, a w mianowniku substraty w odpowiednich wykładnikach potęgowych. Wykładniki te są równe proporcjom molowym substratów i produktów, wynikających z równania stechiometrycznego reakcji.
Liczba atomowa
Liczba atomowa to liczba dodatnich ładunków elektronowych równa liczbie elektronów skupionych w jądrze. Oznaczamy ją literą Z. Jest to wielkość, która decyduje o l. Elektronów zawartych w atomie, decyduje o jego właściwościach chemicznych, a więc o tym z jakim pierwiastkiem mamy do czynienia.
Liczba Avogadra
Liczba Avogadra(NA) to liczba cząsteczek zawartych w jednym w 1 molu substancji, która eksperymentalnie wyznaczona wynosi 6,02*1023. Znajomość tej liczby pozwala na określenie bezwzględnej masy atomu lub cząsteczki. Można tego dokonać poprzez podzielenie masy dowolnego atomu lub cząsteczki przez liczbę Avogadra.
Stężenie procentowe
Stężenie procentowe - procent miarowy (wagowy) - podaje liczbę jednostek wagowych substancji zawartej w 100 jednostkach wagowych roztworu 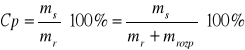
ms- miara substancji rozpuszczanej
mr- miara roztworu
mrozp- miara rozpuszczalnika
Reguła Hunda
Reguła Hunda mówi, że orbitale zdegenerowane, a więc orbitale o tej samej energii przyporządkowywane są kolejno elektronom w taki sposób, by liczba niesparowanych elektronów w stanie podstawowym atomu była możliwie największa.
Reakcje nieodwracalne
Reakcje nieodwracalne zachodzą w określonym kierunku, odwrotny proces nie zachodzi bez występowania zmian w otoczeniu.
Energia wewnętrzna układu
Energia wewnętrzna układu to suma energii, która jest zgromadzona przez poszczególne cząsteczki wchodzące w skład układu. Wchodzą tu następujące składowe:
Energia kinetyczna poszczególnych cząsteczek układu związana z ich nieustannym ruchem
Energia stanów elektronowych w cząsteczce
Energia wewnątrzjądrowa - energia oddziaływania pomiędzy poszczególnymi nukleonami
Energia potencjalna wynikająca z oddziaływań międzycząsteczkowych
Reakcje odwracalne
Reakcje odwracalne to takie, które w obydwie strony układu zachowują bez pozostawienia zmian w otoczeniu.
Stopień utlenienia
Stopniem utlenienia pierwiastka nazywamy liczbę dodatnich lub ujemnych ładunków elementarnych, jakie przypisywalibyśmy atomom tego pierwiastka.
Przypisywanie ładunków odbywa się według następujących reguł:
Suma stopni utlenienia wszystkich atomów wchodzących w skład cząsteczki obojętnej wynosi zero
Pierwiastkom w stanie wolnym przypisuje się stopień utlenienia 0
Fluor we wszystkich swych połączeniach występuje na -1 stopniu utlenienia
Tlen we swych połączeniach występuje na stopniu utlenienia - II. Wyjątek stanowią nadtlenki (- I), podtlenki (-1/2) oraz tlenek fluoru (II).
Wodór przyjmuje w swych związkach stopień utlenienia I. Wyjątek stanowią wodorki litowców i berylowców, gdzie stopień utlenienia wynosi -I.
Właściwości, rodzaje i parametry opisujące cechy elektrolitów
Elektrolitem nazywa się substancję, która stopiona lub rozpuszczona w rozpuszczalniku, rozpada się na swobodne jony (dysocjuje), na skutek czego może ona przewodzić prąd elektryczny.
Przykładami elektrolitów są np. wodne roztwory soli, kwasów i zasad, oraz stopy tych związków. Elektrolity te dzieli się na mocne i słabe, w zależności od ich stopnia dysocjacji:
elektrolity mocne, całkowicie zdysocjowane na jony: wodorotlenki litowców i berylowców; wyłączając beryl, kwasy, np. HCl, HI, HBr, H2SO4, HNO3, HClO4, oraz większość nieorganicznych soli rozpuszczalnych w wodzie (do wyjątków należą np. sole rtęci - Hg(CN)2, Hg2Cl2 - w których wiązanie metalu z anionem jest w dużym stopniu kowalencyjne) - takie sole tworzą kryształy jonowe.
elektrolity bilarne - dysocjują na kationy i aniony w takiej samej ilości.
Rodzaje elektrolitów możemy wyodrębnić na podstawie stopnia dysocjacji. Dzielimy je na:
mocne, gdzie α>30%
wszystkie sole rozpuszczalne
wodorotlenki I i II grupy
słabe, gdzie α<30%
Teoria zderzeń, postulaty, energia aktywacji, szybkość reakcji chemicznej, reakcje egzo- i endoenergetyczne
Teoria zderzeń dotyczy reakcji zachodzących w fazie gazowej, stąd ma ograniczone zastosowanie. Teoria ta składa się z następujących postulatów:
Aby doszło do reakcji chemicznej drobiny substratów muszą zderzać się ze sobą
Aby doszło do reakcji musi dojść do aktów elementarnych
Aby zderzenie było efektywne musi być co najmniej równe energii aktywacji
Odpowiednia orientacja cząsteczek reagujących ze sobą
Energia aktywacji to minimalna wartość sumy energii, która umożliwia skuteczność chemiczną zderzenia. Nie zależy ona od temperatury lecz jedynie od rodzaju zderzających się drobin. Im większa energia tym wolniej zachodzi reakcja.
Szybkość reakcji chemicznej zależy od stężenia kompleksu aktywnego i szybkości rozpadania się kompleksu aktywnego na produkty.
Reakcja egzotermiczna to reakcja chemiczna, która ma dodatni bilans wymiany ciepła z otoczeniem. Można też powiedzieć, że jest to reakcja, w której ciepło znajduje się po stronie produktów, albo inaczej która emituje ciepło.
Reakcja endotermiczna to reakcja chemiczna, która posiada ujemny bilans wymiany ciepła z otoczeniem. Można też powiedzieć, że jest to reakcja w której ciepło znajduje się po stronie substratów, albo inaczej która pochłania ciepło z otoczenia.
Opisz wszystkie Ci znane właściwości pierwiastków bloku p
wykazują właściwości redukcyjne
mogą występować zarówno na dodatnich jak i ujemnych stopniach utlenienia
pierwiastki - niemetale mają zdolność do tworzenia prostych jonów ujemnych, ale ze wzrostem liczby atomowej maleje zdolność do przechodzenia w stan zjonizowany
fluorowce wykazują stosunkowo niską temperaturę wrzenia i topnienia wraz ze wzrostem liczby atomowej
wśród niemetali - CO i NO wykazują charakter obojętny
u metali na niższych stopniach utlenienia przeważają właściwości zasadowe a na wyższych - kwasowe
Wypisz reakcje charakterystyczne alkenów, podaj wzory strukturalne wszystkich izomerów butanu
Reakcja addycji (przyłączania)
Reakcja uwodnienia
Reakcja polimeryzacji
Budowa cząsteczki wodoru. Opisz jej model w oparciu o elektronowy model atomu: struktura elektronowa, orbitale itp.
Teoria orbitali molekularnych zakłada się w niej, że orbital cząsteczkowy powstaje w wyniku nakładania się orbitali atomowych atomów tworzących wiązanie. Pozwala to traktować funkcję falową elektronu w cząsteczce jako liniową kombinację funkcji falowych opisujących orbitale atomowe:
W równaniu stałe cA i cB dobrane są tak, by energia orbitalu cząsteczkowego osiągała minimum.
Dla dwuatomowej cząsteczki takich samych atomów typu A2 rozwiązaniem funkcji falowej elektronu w cząsteczce są dwie funkcje własne: orbital wiążący oraz orbital antywiążący. Orbitale te różnią się energią, przy czym orbital wiążący charakteryzuje się mniejszą energią od wyjściowych orbitali atomowych, a orbital antywiążący większą (rys.20).
Rysunek 20. Energia orbitali atomowych i molekularnych.
Trwałość wiązania zależy od ilości elektronów na obu typach orbitali. Jeśli ilość elektronów na orbitalach wiążących jest większa od ilości elektronów na orbitalach antywiążących, to wiązanie jest trwałe.
W przypadku atomów, które tworzą wiązania z udziałem orbitali atomowych s - s, s - p lub współliniowo leżących orbitali p (py - py; oś y jest kierunkiem zbliżania się atomów) powstaje wiążący orbital cząsteczkowy
i antywiążący orbital cząsteczkowy
*. Orbital wiążący
charakteryzuje się zwiększoną gęstością elektronów w przestrzeni między jądrami. Para elektronów zajmująca ten orbital nosi nazwę wiążącej i tworzy trwałe wiązanie. Orbital antywiążący
* charakteryzuje się mniejszą gęstością elektronów w przestrzeni między jądrami, co powoduje, że jądra atomów odpychają się. Ilustracją tworzenia wiązań
i
* są oddziaływania międzyatomowe w cząsteczce H2 i nie istniejącej cząsteczce He2. Cząsteczka H2 powstaje w wyniku utworzenia orbitalu cząsteczkowego
z orbitali 1s atomów wodoru. Przez nałożenie się dwu orbitali atomowych powstają dwa orbitale cząsteczkowe
i
*. W cząsteczce wodoru obydwa elektrony obsadzają orbital
o niższej energii, a orbital
* pozostaje nie zajęty. W czasie tworzenia wiązania wydziela się energia (energia wiązania), a układ jest trwały ze względu na uzyskanie uprzywilejowanego stanu energetycznego charakteryzującego się minimum energii. Podczas tworzenia się hipotetycznej cząsteczki He2, powstałyby orbitale cząsteczkowe
i
*, które zostałyby zajęte przez cztery elektrony 1s2 obu atomów helu. Utworzyłby się układ, w którym ilość elektronów na orbitalu wiążącym i antywiążącym byłaby taka sama. To nie spowodowałoby obniżenia energii układu, ponieważ suma energii orbitalu
i
* nie jest mniejsza od sumy energii orbitali atomowych 1s2. Cząsteczka He2 nie może być trwała, czego skutkiem jest występowanie helu w postaci atomowej.
Wiązania chemiczne realizowane za pomocą elektronów orbitali px lub pz powstające przez boczne nakładanie się tych orbitali (oś y jest kierunkiem zbliżania się atomów) polegają na utworzeniu się wiążących i antywiążących orbitali cząsteczkowych
i
*. Z orbitali px dwóch atomów powstają dwa molekularne orbitale:
i
*. Podobnie jest w przypadku orbitali pz. Kolejność zapełniania orbitali molekularnych, wynika z ich energii, która wzrasta zgodnie ze schematem:
16