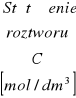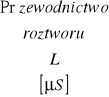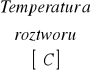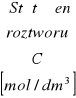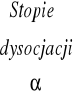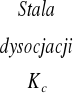POLITECHNIKA SZCZECIŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
Laboratorium studenckie

Sprawozdanie z wykonania ćwiczenia nr 17:
„Wyznaczanie zależności przewodnictwa elektrolitów od stężenia, oraz wartości stałej dysocjacji kwasu octowego metodą konduktometryczną.”
APARATURA: - konduktometr
termometr
pipeta na 20 cm3
zlewki na 100 i 250 ml
naczynko pomiarowe
ODCZYNNIKI: - 0.0625n roztwór CH3COOH
0.005n roztwór KCl
0,1n NaCl
0,1n HCl
0,1n CH3COONa
woda redestylowana
WYKONANIE:
Stopień dysocjacji słabych elektrolitów, zależy w wyraźny sposób od stężenia. Charakter tej zależności można określić na drodze rozważań termodynamicznych. Pomiędzy cząsteczkami niezdysocjowanymi powstałymi w wyniku ich dysocjacji jonami, ustala się bowiem stan równowagi termodynamicznej z charakterystyczną dla danego elektrolitu stałą dysocjacji, która nie zależy od stężenia, a jest tylko funkcją temperatury i ciśnienia.
Dla słabego elektrolitu, np. kwasu ![]()
, który dysocjuje na jony ![]()
i ![]()
termodynamiczną stałą dysocjacji ![]()
opisuje zależność:
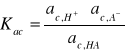
gdzie przez ![]()
, ![]()
i ![]()
oznaczone zostały aktywności stężeniowe odpowiednich jonów ![]()
, ![]()
i cząsteczek niezdysocjowanych ![]()
. Aktywność i-tego składnika roztworu ![]()
można wyrazić w postaci:
![]()
gdzie ![]()
oznacza stężenie tego składnika (mol/dm3), ![]()
- stężenie standardowe równe 1 mol/dm3, a ![]()
to współczynnik aktywności, który jest miarą oddziaływań i-tego składnika z pozostałymi składnikami roztworu. Jeśli całkowite stężenie elektrolitu oznaczyć jako ![]()
, a jego stopień dysocjacji jako ![]()
, to zgodnie z jego definicją stężenia jonów i cząsteczek niezdysocjowanych można wyrazić następująco:
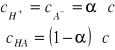
Z przedstawionych równań, w wyniku kolejnych podstawień, otrzymuje się równanie:
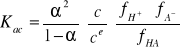
określa ono charakter zależności między stopniem dysocjacji i stężeniem roztworu.
Duże znaczenie praktyczne ma prawo rozcieńczeń Ostwalda:
![]()
gdzie ![]()
jest tzw. klasyczną stałą dysocjacji. Stałą tą, można bardzo prosto wyznaczyć eksperymentalnie. Wystarczy w tym celu określić stopień dysocjacji danego elektrolitu. W przypadkach dostatecznie rozcieńczonych roztworów można posłużyć się zależnością:
![]()
gdzie ![]()
to przewodnictwo równoważnikowe danego roztworu zdefiniowane równaniem:
![]()
w którym ![]()
oznacza przewodnictwo właściwe tego roztworu, ![]()
jego stężenie, a ![]()
jest przewodnictwem równoważnikowym w granicznie rozcieńczonym roztworze.
W przeciwieństwie do termodynamicznej stałej dysocjacji ![]()
, która zależy tylko od temperatury, stała klasyczna ![]()
zależy również od stężenia roztworu. Ponieważ w miarę rozcieńczania roztworu wzajemne oddziaływania między składnikami elektrolitu maleją i współczynniki aktywności przybierają wartości coraz bardziej zbliżone do jedności, więc nie trudno wykazać, że:
![]()
Relację tą można wykorzystać do określania termodynamicznej stałej dysocjacji ![]()
dla różnych stężeń jego roztworów.
1. Zestawienie wyników.
|
|
|
|
|
|||
1. |
0,0625 |
450 |
16,5 |
2. |
0,0313 |
320 |
|
3. |
0,0156 |
125 |
|
4. |
0,0078 |
88 |
|
5. |
0,0039 |
110 |
|
6. |
0,0020 |
73 |
|
7. |
0,001 |
50 |
|
|
|||
1. |
0,005 |
0,77 [mS] |
17,8 |
|
|||
1. |
0,1 |
17500 |
16 |
2. |
0,05 |
5600 |
|
3. |
0,025 |
3050 |
|
4. |
0,0125 |
1050 |
|
5. |
0,0063 |
790 |
|
6. |
0,0032 |
390 |
|
7. |
0,0016 |
112 |
|
|
|||
1. |
0,1 |
37 [mS] |
17 |
2. |
0,05 |
20 [mS] |
|
3. |
0,025 |
11 [mS] |
|
4. |
0,0125 |
5,5 [mS] |
|
5. |
0,0063 |
2,83 [mS] |
|
6. |
0,0032 |
0,36 [mS] |
|
7. |
0,0016 |
0,65 [mS] |
|
|
|||
1. |
0,1 |
6,7 [mS] |
16,5 |
2. |
0,05 |
3,8 [mS] |
|
3. |
0,025 |
1,9 [mS] |
|
4. |
0,0125 |
1,05 [mS] |
|
5. |
0,0063 |
0,5 [mS] |
|
6. |
0,0032 |
140 |
|
7. |
0,0016 |
130 |
|
2. Obliczenia stałej C ze wzoru:
![]()
![]()
![]()
3. Obliczenia ![]()
, ![]()
, ![]()
i ![]()
dla kwasu octowego.
|
|
|
|
|
|
1. |
0,0625 |
361,485 |
5,78376 |
0,016 |
0,016 ⋅ 10-3 |
2. |
0,0313 |
257,056 |
8,21265 |
0,023 |
0,0169 ⋅ 10-3 |
3. |
0,0156 |
100,412 |
6,43666 |
0,018 |
5,14 ⋅ 10-6 |
4. |
0,0078 |
70,690 |
9,06282 |
0,026 |
5,41 ⋅ 10-6 |
5. |
0,0039 |
88,363 |
22,6571 |
0,065 |
0,017 ⋅ 10-3 |
6. |
0,0020 |
58,640 |
29,32 |
0,085 |
0,015 ⋅ 10-3 |
7. |
0,001 |
40,165 |
40,165 |
0,116 |
0,0152 ⋅ 10-3 |
Obliczenia powyższe przeprowadzone zostały przy pomocy równań:
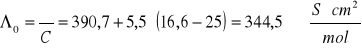
![]()
![]()
![]()
Obliczenie ![]()
potrzebne do sporządzenia wykresu:
1. 0,031 5. 0,015
2. 0,026 6. 0,013
0,016 7. 0,010
4. 0,014
Wartość ![]()
odczytana z wykonanego wykresu wynosi 14 ⋅ 10-6, natomiast wartość tej stałej odczytana z poradnika fizyko-chemicznego wynosi 1,753 ⋅ 10-5.
Obliczenia błędu pomiaru:
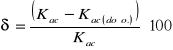
![]()
6
Wyszukiwarka