Dla gazu doskonałego:
TEST WYBORU
Aby wykonać pracę objętościową na otoczeniu, przy zachowaniu stałej energii wewnętrznej, układ musi:
pobrać energię od otocznia (Q>0)
oddać energię otoczeniu (Q<0)
nie wymieniać energii z otoczeniem
Adsorpcja chemiczna przy wzroście temperatury:
rośnie
maleje
nie zmienia się
Adsorpcja fizyczna przy wzroście temperatury:
rośnie
maleje
nie zmienia się
Azeotrop dodatni charakteryzuje występowanie na diagramach fazowych równowagi ciecz-para:
maksimum na izobarycznym
maksimum na izotermicznym
minimum na izobarycznym
minimum na izotermicznym
Całkowita entropia układu izolowanego, w którym przebiega proces ze skończoną szybkością:
zawsze wzrasta
zawsze maleje
pozostaje stała
może rosnąć lub maleć
Całkowita prężność pary roztworu doskonałego jest związana ze składem pary zależnością:
liniową
nieliniową
nie jest związana
Całkowita prężność pary roztworu doskonałego jest związana ze składem cieczy zależnością:
liniową
nieliniową
nie jest związana
Ciepło przemiany jest:
funkcją stanu
funkcjonałem drogi przemiany
różniczką zupełną
Częstość zderzeń cząsteczek gazowych Z jest powiązana z temperaturą termodynamiczną T zależnością:
Z ~ T1/2
Z ~ T
Z ~ exp(-const/T)
Z nie zależy od temperatury
Dla dowolnego procesu:
ciepło pochłonięte przez układ nie zależy od drogi reakcji
praca wykonana przez układ nie zależy od drogi reakcji
zmiana energii wewnętrznej nie zależy od drogi reakcji
Dla gazu doskonałego:
![]()
b) ![]()
c) 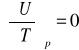
d) 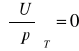
Dla reakcji ![]()
:
Kp reakcji jest równe jedności
Kp=Kc
Kp>Kc
Kp<Kc
Kp może się wyrażać się w jednostkach [N.m-2]
Dla roztworu doskonałego:
ΔHmiesz=0
ΔSmiesz=0
ΔGmiesz=0
ΔVmiesz=0
Dla większości cieczy molowa entropia parowania w normalnej temperaturze wrzenia wynosi:
8,3 [J.mol-1.K-1]
20 [J.mol-1.K-1]
25 [J.mol-1.K-1]
88 [J.mol-1.K-1]
175 [J.mol-1.K-1]
Dodatnie odchylenie od prawa Raoulta, roztworu cieczy A i B, spowodowane oddziaływaniami cząsteczek:
A-A = B-B
A-A < B-B
A-A > B-B
A-A > A-B
A-A < A-B
Dowolna ekstensywna funkcja stanu układu zamkniętego, w którym reaguje n składników, jest funkcją:
dwu zmiennych
trzech zmiennych
n zmiennych
Energia translacyjna 1 mola gazu doskonałego w temperaturze 25 oC wynosi w przybliżeniu:
600 J
1250 J
2500 J
3750 J
Energia wiązania C-H w metanie określa:
ΔH dla reakcji ![]()
ΔH dla reakcji ![]()
¼ ΔH dla reakcji a)
¼ ΔH dla reakcji b)
żadną z tych możliwości
Gdy gaz pochłania 200 J energii cieplnej i rozszerza się o 500 cm3 przeciwko stałemu ciśnieniu 2.105 [N/m2], wówczas zmiana energii wewnętrznej wynosi:
-300 J
-100 J
100 J
300 J
Gdy gaz rozszerza się adiabatycznie przeciwko skończonemu ciśnieniu, wówczas:
jego energia wewnętrzna zawsze maleje
jego temperatura zawsze się obniża
jego entropia zawsze pozostaje stała
Izoterma adsorpcji Langmuira jest oparta na założeniu:
stałego ciepła adsorpcji
płaskiej powierzchni stałej
doskonałego zachowania się gazu
zerowej energii aktywacji procesów adsorpcji i desorpcji
Jeżeli dodanie jakiejś substancji do wody obniża jej napięcie powierzchniowe to:
adsorpcja jest dodatnia
adsorpcja jest ujemna
nie ma to związku z adsorpcją
Komórka elementarna sieci prostej (prymitywnej) zawiera
jeden atom
dwa atomy
cztery atomy
osiem atomów
Kryształy izotropowe należą do układu:
regularnego
heksagonalnego
jednoskośnego
Która z następujących zależności jest oparta na założeniu doskonałości gazu?
ΔU=Q-W
![]()
dla odwracalnej adiabatycznej ekspansji lub kompresji pVκ=const.
Cp-Cv=R
pod stałym ciśnieniem ΔH=ΔU+pΔV
pV=1/3 n.m.c2
Lepkość cieczy przy wzroście temperatury:
wzrasta liniowo
maleje liniowo
maleje ekspotencjalnie
Mieszanina dwuskładnikowa stanowiąca roztwór doskonały:
charakteryzuje się tylko bardzo słabym oddziaływaniem między cząsteczkami substancji rozpuszczonej i rozpuszczalnikia
może być rozdzielona na składniki przez wielokrotną destylację
ma prężność pary pośrednią w stosunku do prężności par czystych składników
Niskie temperatury topnienia mają kryształy o wiązaniach:
atomowych
jonowych
molekularnych
metalicznych
Objętość zajmowana przez 1 mol helu pod ciśnieniem 105 [N/m2] i w temp. 1000 K wynosi w przybliżeniu:
22,4 dm3
83 dm3
108 dm3
770 dm3
0,82 m3
Opierając się na następujących wartościach ciepła tworzenia: H2O(g),ΔHtw,298K= -242 [kJ/mol]; CO(g),ΔHtw,298K= -111 [kJ/mol]; otrzymuje się ΔH298K dla reakcji H2O(g)+C(s)=H2(g)+CO(g) wartość:
-353 [kJ/mol]
-131 [kJ/mol]
131 [kJ/mol]
353 [kJ/mol]
potrzeba więcej danych
Pod ciśnieniem atmosferycznym roztwór azeotropowy:
nie może być rozdzielony na składniki przez frakcjonowaną destylację
może być rozdzielony na składniki przez frakcjonowaną destylację
może być rozdzielony na składniki przez pojedynczą destylację
Podwyższenie temperatury wrzenia występuje wskutek dodania do rozpuszczalnika:
substancji powierzchniowo czynnej
substancji nielotnej
substancji nierozpuszczalnej
Poprawne równanie stanu dla gazu rzeczywistego w wysokiej temperaturze i pod wysokim ciśnieniem (uwzględniające objętość własną cząsteczek przez wprowadzenie czynnika b) ma postać:
pV=bRT
pV=RT+b
pV=RT-b
pV=RT+bp
pV=RT-bp
Praca wytworzona przez 1 mol jednoatomowego gazu doskonałego w zamkniętym cyklu przemian wynosi 418 J. Ciepło wymienione przez gaz w czasie tych przemian wynosi:
zero
418 J
-418 J
Prężność pary cieczy A w obecności niemieszającej się z nią drugiej cieczy B jest:
proporcjonalna do ułamka molowego A w układzie
niezależna od ułamka molowego A w układzie
logarytmiczną funkcją temperatury
Prężność pary nad kroplą cieczy jest:
taka sama jak nad powierzchnią płaską
wyższa niż nad powierzchnią płaską
niższa niż nad powierzchnią płaską
Prężność pary nad roztworem po dodaniu do rozpuszczalnika substancji nielotnej ulegnie:
podwyższeniu
obniżeniu
nie zmieni się
Roztwory zeotropowe są to roztwory:
doskonałe
niedoskonałe nie wykazujące ekstremów na krzywych zależności pary od składu cieczy
niedoskonałe wykazujące ekstrema na tych krzywych
Roztwór, w którym rozpuszczalnik zachowuje się zgodnie z prawem Raoulta, a substancja rozpuszczona zgodnie z prawem Henry'ego, jest:
roztworem doskonałym
roztworem doskonałym rozcieńczontm
ani jednym ani drugim
Równanie BET umożliwia wyznaczenie:
pojemności monowarstwy adsorpcyjnej
objętości mikroporów adsorbentu
powierzchni właściwej adsorbentu
Równanie stanu jest to:
związek parametrów intensywnych
związek parametrów ekstensywnych
związek parametrów intensywnych i ekstensywnych
Równanie Van der Waalsa dla n moli gazu ma następującą postać:
![]()
![]()
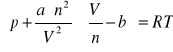
Sieć przestrzennie centrowana występuje w układzie:
regularnym
heksagonalnym
jednoskośnym
Siły Van der Waalsa to oddziaływania:
dipol-dipol
jon-jon
indukcyjne
dyspersyjne
elektrostatyczne
Stała równowagi jest funkcją:
ciśnienia
temperatury
aktualnych aktywności reagentów
początkowych aktywności reagentów
Trzy cząsteczki gazowe mają następujące prędkości: 100, 200, 300 [m/s]. Prędkość średnia kwadratowa wynosi:
190 [m/s]
200 [m/s]
216 [m/s]
400 [m/s]
467 [m/s]
W punkcie azeotropowym:
zawartość składnika lotnego w parze jest wyższa niż w cieczy
zawartość składnika lotnego w parze jest taka sama jak w cieczy
zawartość składnika lotnego w parze jest niższa niż w cieczy
W roztworach o takim samym stężeniu wzrost długości łańcucha węglowodorowego w szeregu homologicznym kwasów organicznych powoduje:
wzrost napięcia powierzchniowego
obniżenie napięcia powierzchniowego
nie ma wpływu na napięcie powierzchniowe
W temp. 400 K ciecz A ma prężność pary 4.105 [N/m2], a ciecz B - prężność pary 6.105 [N/m2]. Ciecze A i B tworzą roztwór doskonały. Ułamek molowy B w parze pozostającej w równowadze z roztworem, w którym ułamek molowy B wynosi 0,6 jest równy:
0,31
0,40
0,5
0,6
0,69
Wartość stałej krioskopowej zależy od:
rozpuszczalnika
substancji rozpuszczonej
rozpuszczalnika i substancji rozpuszczonej
Zmiana energii wewnętrznej jest równa ciepłu wymienionemu przez układ zamknięty w przemianie:
adiabatycznej
izochorycznej
izobarycznej
Napięcie powierzchniowe przy wzroście temperatury:
wzrasta
maleje
nie zmienia się
Jeżeli dwie bańki mydlane o różnych średnicach połączymy rurką, to:
mniejsza bańka się powiększy
mniejsza bańka zaniknie
nic się nie zmieni
Prawo Lamberta - Beera można przedstawić wzorem:
a) 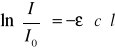
b) 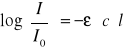
c) ![]()
d) 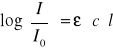
Zgodnie z prawem Lamberta - Beera natężenie światła przepuszczonego przez ośrodek o stężeniu c:
wzrasta liniowo ze stężeniem
wzrasta wykładniczo ze stężeniem
maleje liniowo ze stężeniem
maleje wykładniczo ze stężeniem
Katalizator jest to substancja, która:
przyspiesza reakcję
zmienia stałą równowagi reakcji
zmienia kierunek reakcji
Reakcja jednocząsteczkowa może zachodzić według mechanizmu reakcji II rzędu:
przy dużych ciśnieniach
przy małych ciśnieniach
dla dużych cząsteczek o skomplikowanej budowie
Ruchliwość jonu może być wyrażona w jednostkach:
[m.s-1]
[m.s-1.V-1]
[m2.s-1.V-1]
Siła jonowa wodnego roztworu chlorku barowego o stężeniu 0,1 [mol.kg-1] wynosi:
0,1 [mol.kg-1]
0,15 [mol.kg-1]
0,2 [mol.kg-1]
0,3 [mol.kg-1]
0,4 [mol.kg-1]
Stała szybkości reakcji drugiego rzędu może być wyrażona w:
[dm3.mol-1.min-1]
[cm3.cząsteczka-1.s-1]
[mol.m-3.s-1]
[cząsteczka.cm-3.s-1]
[mol2.m-6.s-1]
[m2.N-1.s-1]
Przewodność molowa roztworu jest:
iloczynem przewodności elektrolitycznej i stężenia roztworu
ilorazem przewodności elektrolitycznej i stężenia roztworu
sumą przewodności elektrolitycznej i stężenia roztworu,
Liczba przenoszenia t+ = 0 w przewodnikach:
jonowych
metalicznych
półprzewodnikach
Promień atmosfery jonowej jest:
proporcjonalny do siły jonowej,
odwrotnie proporcjonalny do siły jonowej
nie zależy od siły jonowej.
Potencjał elektrody szklanej zależy od aktywności:
jonów Na+
jonów H+
jonów Cl-
jonów OH-.
SEM ogniwa jest dodatnia gdy :
na lewej elektrodzie zachodzi reakcja redukcji
na lewej elektrodzie zachodzi reakcja utleniania
potencjał normalny elektrody lewej jest wyższy niż prawej
SEM ogniwa stężeniowego zależy od:
rodzaju elektrod
różnicy aktywności jonów potencjałotwórczych półogniw
ilorazu aktywności jonów potencjałotwórczych półogniw.
Wartość SEM pozwala na bezpośrednie wyznaczenie:
ΔG
ΔU
Q
dla reakcji zachodzącej w ogniwie.
W którym z poniższych ogniw występuje potencjał dyfuzyjny:
Ag, AgCl | ZnCl2(aq) | Zn
Zn | ZnSOĄ(aq) | | CuSO4 | Cu
Ag | AgNO3(0,01 mol-kg-1) | AgNO3(0,l mol-kg-')|Ag
W którym z następujących ogniw siła elektromotoryczna będzie niezależna od aktywności jonów chlorkowych:
Zn | ZnCI2(aq) | C12, Pt;
Zn l ZnCl2(aq) || KCl(aq),AgCl(s), Ag;
Ag | AgCI(s), KCl(aq) | Cl2|Pt
Hg | Hg2Cl2(s), KCl(aq) || AgNO3(aq) | Ag ;
Pt, H2 | HCl(aq) | Ci2, Pt.
Okres połowicznej przemiany procesu drugiego rzędu 2A = produkty jest:
niezależny od początkowego stężenia A
wprost proporcjonalny do początkowego stężenia A
odwrotnie proporcjonalny do początkowego stężenia A.
Hydroliza estru w obecności rozcieńczonego HCI przebiega zgodnie z kinetyką reakcji pierwszego rzędu, ponieważ:
kwas działa jak katalizator
szybkość hydrolizy nie zależy od stężenia jonów wodorowych
stężenie jonów wodorowych jest podczas reakcji zasadniczo stałe.
Jeżeli ΔH dla reakcji wynosi + 100 [kJ • mol-1], energia aktywacji:
musi być równa lub mniejsza niż 100 [kJ • mol-1]
musi być równa lub większa niż 100 [kJ • mol-1]
może być większa lub mniejsza niż 100 [kJ • mol-1].
Jeżeli ΔH dla reakcji wynosi -100 [kJ • mol-1], energia aktywacji:
musi być równa lub mniejsza niż 100 [kJ • mol-1]
musi być równa lub większa niż 100 [kJ • mol-1]
może być większa lub mniejsza niż 100 [kJ • mol-1]
Zależność szybkości reakcji od temperatury przedstawia równanie:
kr = A-eRT
r = A-e Kr
kr=A*e- Ea/RT
lnA:r =a-T
Szybkość reakcji jonowej w roztworze:
jest proporcjonalna do ![]()
jest funkcją wykładniczą ![]()
nie zależy od siły jonowej.
Przyczyną wybuchowego przebiegu reakcji jest:
obecność katalizatora
występowanie wielu reakcji równoległych
występowanie reakcji następczych.