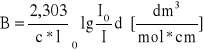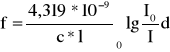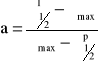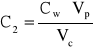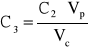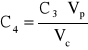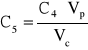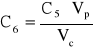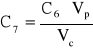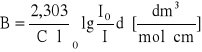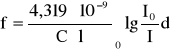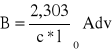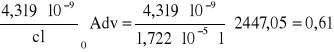Sprawozdanie z ćwiczenia nr 24: Elektronowe widma absorpcyjne.
Widmo elektronowe to widmo promieniowania elektromagnetycznego odpowiadające przejściom między różnymi stanami elektronowymi cząsteczki. W cząsteczkach stany energetyczne elektronów są kwantowane. Przejściom elektronów między tymi stanami może towarzyszyć emisja lub absorpcja promieniowania. Koniecznym warunkiem absorpcji fotonu, która wywołuje przeniesienie elektronu, jest dopasowanie wartości jego energii do różnicy poziomów energetycznych. Prawdopodobieństwo przejść elektronów między dwoma stanami energetycznymi określają reguły wyboru. Przejście zależy od:
zmiany rozkładu ładunku podczas przejścia;
zmiany multipletowości podczas przejścia (2S + 1);
nakładania się chmur elektronowych stanów, między którymi następuje przejście.
Przejścia są tym bardziej prawdopodobne, im większa zachodzi zmiana rozkładu ładunku i im większe jest wzajemne przenikanie chmur elektronowych oddziaływujących stanów. Dozwolone są tylko przejścia pomiędzy stanami o tej samej multipletowości. Układy pasm elektronowych występują w nadfiolecie oraz w widzialnej części widma. Na przejścia elektronowe nakładają się przejścia oscylacyjne i rotacyjne. Parametrami charakteryzującymi pasma absorpcyjne są:
maksimum absorpcji (l max) podane w nm lub cm-1 (kajzerach): 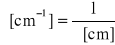
natężenie określane za pomocą molowego współczynnika absorpcji e max przy maksimum absorpcji (dm 3*mol-1*cm-1); miarą dokładniejszą jest molowe integralne natężenie: 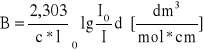
gdzie: c - stężenie roztworu [mol/dm3]; l - grubość warstwy absorbującej [cm]; I0 - natężenie promieniowania padającego; It - natężenie promieniowania przechodzącego.
Siła oscylatora jest to stosunek integralnego natężenia wyznaczonego doświadczalnie do obliczonego dla prostego modelu oscylatora harmonicznego prostego układu elektron - cząsteczka:
struktura wyrażona asymetrią pasma i składowymi przejść elektronów- może być określona jako wartość odcinków, które wyznacza n max na szerokości połówkowej:
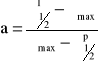
gdzie: max - liczba falowa odpowiadająca maksimum absorpcji [cm-1]; l1/2 - wartość liczby falowej z lewej strony pasma w połowie wysokości [cm-1]; p1/2 - wartość liczby falowej z prawej strony pasma w połowie wysokości [cm-1].
Widma cząsteczkowe uwidaczniają się w postaci szerokich pasm, ponieważ są badane zwykle w roztworach, w których dochodzi do dodatkowych oddziaływań między cząsteczkowych.

Rodzaje przejść elektronowych są następujące:
W związkach organicznych- absorpcja promieniowania w zakresie UV- Vis jest związana z przejściami elektronów walencyjnych oraz elektronów wolnych par elektronowych. Kolejność poziomów energetycznych poszczególnych orbitali i możliwości przejść elektronowych jest na schemacie. Wzbudzenie elektronowe następuje wówczas, gdy w wyniku absorpcji promieniowania następuje przeniesienie elektronu z orbitalu o niższej energii na wolny orbital o energii wyższej.
W kompleksach metali d- elektronowych- w przejściach elektronowych biorą udział elektrony d (teoria pola ligandów). Mogą to być przejścia typu d d, d , f f. Leżą w zakresie bliskiego UV i w obszarze widzialnym i są odpowiedzialne za barwę soli.
Przejścia typu przeniesienia ładunku- CT (charge transfer)- wewnątrz cząsteczkowe, między donorem i akceptorem, między atomem centralnym i ligandem.
Jeżeli przez ośrodek przechodzi wiązka światła to jej natężenie po przejściu ulega zmniejszeniu. Prawo Lamberta - Beera wiąże grubość warstwy roztworu absorbującego i jego stężenie jako wielkości, od których zależy absorbancja:
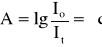
gdzie: A - absorbancja; c- stężenie roztworu [mol/dm3]; l- grubość warstwy absorbującej [cm]; - molowy współczynnik absorpcji [dm3 * mol-1 * cm-1]; I0 - natężenie promieniowania padającego; It - natężenie promieniowania przechodzącego.
Zależność absorbancji od stężenia powinna mieć charakter liniowy, jednak w rzeczywistości spotyka się odchylenia od prawa absorpcji. Są one spowodowane przez:
podstawowe ograniczenia praw- spełnione tylko dla roztworów rozcieńczonych, możliwość wystąpienia np. fluorescencji;
czynniki chemiczne- dysocjacja, asocjacja, solwatacja, polimeryzacja, kompleksowanie;
Obliczam stężenie roztworów. Stężenie wyjściowe roztworu czerwieni Kongo wynosi 0,025g/250cm3 z czego wynika, że stężenie wyrażone w [g/dm3] wynosi 0,1 g/dm3, jednak do obliczeń potrzebne będzie stężenie wyrażone w [mol/dm3]. Masa molowa wynosi 696,712 [g/mol] z tego wynika, że stężenie wynosi 1,435*10-4.
Stężenie roztworu 1 wynosi:

gdzie: Cw - stężenie wyjściowe roztworu czerwieni Kongo; Vp - objętość roztworu wyjściowego pobrana do kolby, 3 cm3; Vc - objętość całkowita po uzupełnieniu kolby do kreski wodą, 25 cm3. C1 = 1,722*10-5 [g/dm3].
Stężenie roztworu 2 wynosi:
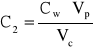
gdzie: Cw - stężenie wyjściowe roztworu czerwieni Kongo; Vp - objętość roztworu wyjściowego pobrana do kolby, 8 cm3; Vc - objętość całkowita po uzupełnieniu kolby do kreski wodą, 25 cm3. C2 = 4,592*10-5 [g/dm3].
Stężenie roztworu 3 wynosi:
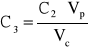
gdzie: C2 - stężenie roztworu 2 czerwieni Kongo; Vp - objętość roztworu 2 pobrana do kolby, 10 cm3; Vc - objętość całkowita po uzupełnieniu kolby do kreski wodą, 25 cm3. C3 = 1,837*10-5 [g/dm3].
Stężenie roztworu 4 wynosi:
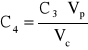
gdzie: C3 - stężenie roztworu 3 czerwieni Kongo; Vp - objętość roztworu 3 pobrana do kolby, 10 cm3; Vc - objętość całkowita po uzupełnieniu kolby do kreski wodą, 25 cm3. C4 = 7,347*10-6 [g/dm3].
Stężenie roztworu 5 wynosi:
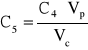
gdzie: C4 - stężenie roztworu 4 czerwieni Kongo; Vp - objętość roztworu 4 pobrana do kolby, 10 cm3; Vc - objętość całkowita po uzupełnieniu kolby do kreski wodą, 25 cm3. C5 = 2,939*10-6 [g/dm3].
Stężenie roztworu 6 wynosi:
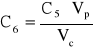
gdzie: C5 - stężenie roztworu 5 czerwieni Kongo; Vp - objętość roztworu 5 pobrana do kolby, 10 cm3; Vc - objętość całkowita po uzupełnieniu kolby do kreski wodą, 25 cm3. C6 = 1,1756*10-6 [g/dm3].
Stężenie roztworu 7 wynosi:
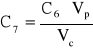
gdzie: C6 - stężenie roztworu 6 czerwieni Kongo; Vp - objętość roztworu 6 pobrana do kolby, 10 cm3; Vc - objętość całkowita po uzupełnieniu kolby do kreski wodą, 25 cm3. C5 = 4,7024*10-7 [g/dm3].
Widmo absorpcyjne barwnika - czerwieni Kongo - wyznaczam mierząc absorbancję roztworu 1 o stężeniu C1 = 0,012 [g/dm3] w zakresie 420- 650 nm co 5 nm.
Sporządzam wykres zależności A = f(), z którego odczytuje max, max, Amax i obliczam max z wzoru: 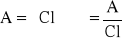
gdzie A - absorbancja; C - stężenie; l - grubość próbki; e - molowy współczynnik absorpcji. Z wykresu odczytuje również wartości związane z szerokością połówkową pasma: P, L, oraz obliczam i stopień asymetrii pasma: 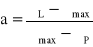
.
P = 18182 cm-1 i L = 23173 cm-1 1/2 = 4991 cm-1
Aby wyznaczyć molowe natężenie integralne pasma B:
należy zmierzyć pole pod konturem pasma. Można to zrobić posługując się techniką całkowania graficznego. Polega ona na podzieleniu pola pod konturem na szereg wycinków o odpowiednio wąskim przedziale . Pole każdego wycinka określamy jako iloczyn i średniej wartości ekstyncji.
|
Średnia wartość ekstyncji (AL + AP)/2
|
Pole [(AP + AL)/2]* [cm-1]
|
|
Średnia wartość ekstyncji (AL + AP)/2
|
Pole [(AP + AL)/2]* [cm-1]
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Suma pól wszystkich wycinków wynosi 2447,05 cm-1 wartość ta jest przybliżoną wartością całki. Stężenie roztworu czerwieni Kongo jest równe: C = 1,722*10-5. Dla wartości l = 1 cm obliczam wartość molowego integralnego natężenia pasma :
Obliczam siłę oscylatora:
f = 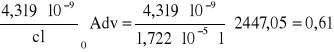
Wyznaczam wykresy dla pozostałych roztworów:
Molowe współczynniki absorpcji pozostałych roztworów odczytane z wykresów. Wartości obliczane dla 
= 505 nm.
|
Stężenie fotometrowanego roztworu C [mol/dm3]
|
|
Molowy współczynnik absorpcji 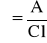
[dm3*mol-1*cm-1]
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Średni molowy współczynnik absorpcji
|
18363,20 [dm3*mol-1*cm-1]
|
Budowę cząsteczki barwnika czerwieni Kongo przedstawia następujący wzór:
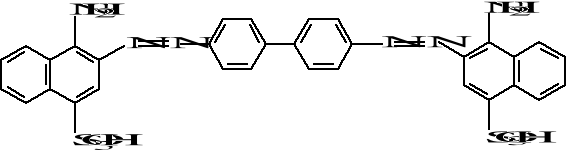
Cząsteczka czerwieni Kongo wykazuje selektywną absorpcję światła. W cząsteczce występuje cały szereg grup chromoforowych, czyli odpowiedzialnych za barwę. Grupami chromoforowymi są nienasycone ugrupowania atomów i układy sprzężonych wiązań podwójnych: azowa -N=N-, skondensowane pierścienie aromatyczne, pierścienie benzenowe. Przejścia elektronowe w grupach chromoforowych są ułatwione. Pasma absorpcyjne czerwieni Kongo pochodzą od przejść p à p* w sprzężonym układzie wiązań. Są to pasma dość intensywne. Są one również odpowiedzialne za powstawanie barwy. Czynnikiem decydującym o barwie jest jakość grup chromoforowych oraz ich wzajemne ustawienie. Większa liczba grup chromoforowych powoduje absorpcję fal dłuższych. Takie przesunięcie maksimum absorpcji nazywa się efektem batochromowym. Chromofory sprzężone powodują absorpcję światła o znacznie większych długościach fali i o większym natężeniu w porównaniu z absorpcją poszczególnych chromoforów składowych.
Z wykresu zależności absorbancji od stężenia roztworu dla czerwieni Kongo widać, że prawo Lamberta - Beera jest spełnione dla roztworów rozcieńczonych. Przy większym stężeniu występuje odchylenie od prawa Lamberta - Beera (jednak odchylenie może wynikać z niedokładności spektrofotometru).
Molowy współczynnik absorpcji charakteryzuje czułość metody. Wraz ze zmniejszaniem się stężenia roztworu czerwieni Kongo molowy współczynnik absorpcji wzrasta. Zwiększa się tym samym czułość metody. Im mniejsze stężenie tym większa czułość oznaczenia.
![]()