ZESTAW 1
Budowa chemiczna a działanie penicylin (czyli pochodnych penemu)
Wszystkie penicyliny są pochodnymi kwasu 6-aminopenicylinowego. Cykliczne dipeptydy złożone z D-β,β-dimetylocysteiny i seryny i zawierają 3 centra chiralne. Podstawniki R wpływają na właściwości penicylin:
R1- wpływa na zakres i siłę działania, wrażliwość lub oporność na działanie środowiska kwasowego i B-laktamaz
R2- gr metoksylowa w pozycji 6α zmniejsza wrażliwość na działanie B-laktamaz.
R3 zwiększa lipofilność związku co powoduje lepsze wchłanianie po podaniu doustnym
Mechanizm tetracyklin, przykłady, zastosowanie
Tetracykliny pzenikają do komórki bakteryjnej w wyniku transportu czynnego Mechanizm działania polega na zakłócaniu biosyntezy białka bakteryjnego Reagują nieodwracalnie z podjednostką 30s w taki sposób który uniemożliwia wiązanie aminoacetylo-tRNA. Ponieważ miejsce P jest zawsze zajęte przez peptydylo-tRNA lub pozbwione gruby acylowej tRNA, a miejsce A jest w gotowości do przyjęcia następnej cząsteczki aminoacetylo-tRNA, niemożliwe jest odczytanie miejsca akceptorowego, wywołującego inicjację oraz elongację. Przy wyższych stężeniach tetracyklin zahamowaniu ulega proces wydłużania łańcucha peptydowego i terminacji syntezy. Działanie bakteriobójcze jest taże wynikiem działania kompleksującego jonu magnezu i wapnia, ponieważ wymienione kationy maja istotne znaczenie w prawidłowym funkcjonowaniu rybosomów. Chloramfenikol działa na dwie fazy syntezy białka. Wiążąc się z podjednostka 50s blokuje wiązanie aminoacylo-tRNA co uniemożliwia lokalizację reszty aminoacylowej w centrum aktywnym enzymu. Zakłóca proces translacji.
Przykłady:
-naturalne - tetracyklina, oksytetracyklina, chlorotetracyklina, demeklocyklina
-półsyntetyczne - metacyklina doksycyklina minocyklina rolitetracyklina limecyklina
Zastosowanie:
Leki ostatniego wyboru w zakażeniach inwazyjnych wywołanych przez riteksje, ropnie mózgu, zakażenia wewnątrzgałkowe, u dorosłych w durach, paradurach, zapaleniu opon mózgowo-rdzeniowych, ciężkie zapalenia płuc, posocznica, zmiany martwicze w płucach, krztusiec o ciężkim przebiegu
Podział i przykłady leków przeciwwirusowych hamujących replikację kwasów nukleinowych
Analogi guanozyny- gancyklowir acyklowir famcyklowir walacyklowir pancyklowir
Analogi adenozyny widarabina
Analogi cytozyny cytarabina cydofowir Ibacytabin
Analogi tytmidyny trifluorotymidyna idoksurydyna floksurydyna
Inne rybaflawina kwasy fosfonowe: foskarnet(kw. Fosfomrówkowy) fosfonet ( kw fosfooctowy)
ZESTAW 2
Mechanizm działania, podział, przykłady leków stosowanych w infekcjach retrowirusem HIV
I. Inhibitory odwrotnej transkryptazy:
a) nukleozydowe inhibitory odwrotnej transkryptazy NRTI
analogi tymidyny- zydowudyna stawudyna
analogi cytozyny- Lamiwudyna Zalcytabina
analogi puryn- didanozyna abakawir
b) Nukleotydopodobne inhibitory odwrotnej transkryptazy- tenofowir
c) Nienukleozydowe inhibitory odwrotnej transkryptazy NNRTI - efawirenz, delawirdyna, newirapina
d) Inhibitory proteazy HIV I-PT - Sakwinawir, ritonawir, indinawir, nelfinawir, amprenawir, lapinawir
e) Inne: denotiwir, moroksydyna, metisazon, izoprynozyna
2. Pochodne cefemu: budowa chemiczna a działanie
Podstawnik R1 w C7 warunkuje aktywność przeciwbakretyjną oraz ma wpływ na spektrum działania i oporność na działanie B-laktamaz
Podstawnik R2 w C3 wpływa na aktywność, farmakokinetykę i trwałość metaboliczną
Podstawnik R3 w pozycji C7 chroni ugrupowanie B-laktamowe przed działaniem B-laktamaz
Pod\stawnik R4 zwiększa lipofilność pochodnych co ma korzystny wpływ na biodostepność
Pochodne I genereacji
Grupa OH w pozycji 4' pierścienia aromatycnzego w łańcuchu bocznym zwiększa stężenie antybiotyku w surowicy krwi, wydłuza T1/2 i zwiększa trwałość
II generacji
Podstawnik N-metylotetrazolotiometylowy w pozycji 3 zwiększa aktywność w stosunku do Gram- i hamuje proces metabolizowania ale jednocześnie powoduje brak tolerancji na alkohol , gdyż hamuje aktywność dehydrogenazy aldehydowej- reakcja disulfiramowa.
Podstawnik akrbamoiloksymetyowy ogranicza szybkość procesu metabolizowania
Podstawnik furylometylowy przycyznia się do wzrostu aktywnoścvi i oporności na dizłania B-laktamaz
Podstawnik metoksyiminowy w wysokim stpniu chroni wiązania B-laktamowe przed dizłaniem B-laktamaz
Podstawnik tiofenometylowy zwiększa aktywność w stosunku do stafylokoków
III generacja
Podstawnik karboksypropylowy połączony z ugrupowaniem iminowym w łańcuchu bocznym zwiększa aktywność w stosunku do P. aeruginosa
Podstawnikl sulfonowy podwyższa polarność cząsteczki co bardzo ułatwia penetrację szczególnie u Pseudomonas
Podstawnik 2,3 diketopiperazynowy zwiąksza aktywność w stosunku do Gram +
IV generacja
Podstawnik 2-aminotiazolowy i ugrupowanie alkoksyiminowe przy węglu a podstawnika acylowego w pozycji 7 cefemu oraz w pozycji 3 cefemu podstawnik z ugrupowaniem amoniowym zapewnie dużą aktywność wobec Gram -, oporność na B-laktamzzy i przenikanie do płynu mózgowo-rdzeniowego.
3. Leki p-trądowe - przykłady
Ryfampicyna dapson klofazymina talidomid glikokortykosteroidy
ZESTAW 3
Inhibitory beta-laktamaz: przykłady i zastosowanie
Przykłady: kwas klawulanowy, sulbaktam, tazobaktam.
Mechanizm: Leki te zmniejszają negatywne skutki działania beta-laktamaz na skuteczność leczniczą antybiotyków beta-laktamowych.
Beta-laktamazy to enzymy działające 2-stopniowo. W pierwszym etapie powstaje acyloenzym, a ten ulega deacylacji do enzymu i produktu jakim jest rozłożony antybiotyk.
Działanie:
Kwas klawulanowy: Ogranicza się głównie do penicylinaz. Głównie na Gram-dodatnie.
Sulbaktam działa silnie przeciwko cefalosporynazom.
Tazobaktam: o najszerszym spektrum działania: G+ oraz G-.
Leki przeciwwirusowe wpływające na adhezje, wnikanie i wczesną replikacje: podział, przykłady i mechanizm
Leki hamujące adhezję, wnikanie i wczesną replikację wirusów:
a) pochodne adamantanu- Amantadyna, Rimantadyna, Tromantadyna
b) interferony: α- interferon n1, interferon β-ludzki
c) inhibitory neuramidazy- zanamiwir, oseltamiwir
Mechanizm pochodnych adamantanu: Blokują białko M2 kanału jonowego i jego zdolność do modulowania wewnątrzkomórkowego pH. Białko M2 w wirusach grupy typu A jest niezbędne do uwolnienia kwasu nukleinowego i enzymów wirusa z osłonki oraz agregacji białek osłonki. Występuje w osłonce wirusa i błonie aparatu Golgiego zakażonych komórek. Białko to tworzy kanał jonowy, przez który transportowane są jony wodorowe do wirusa. Obniżenie wartości pH wewnątrz cząsteczki wirusa, prowadzi do połączenia się białek strukturalnych osłonki wirusa z błoną endosomu i w wyniku tego do usunięcia osłonki białkowej albo uwalniania wirusowego genomu.
Mechanizm interferonów: Działają antyproliferacyjnie, p-wirusowo, immunomodulująco. Uodparniają komórki na wirusy i hamują podział wirusów. Odwracalnie łączą się z określonymi receptorami komórkowymi, aktywując w ten sposób enzymy cytoplazmatyczne, które decydują o procesie translacji mRNA i syntezę białek, które hamują replikację wirusa.
Mechanizm inhibitorów neuramidazy: Neuramidaza to enzym odłączający resztę kwasu N-acetylomuraminowego, znajdującą się na nieredukcyjnym końcu łańcucha cukrowego. Enzym ten występuje u niektórych wirusów i bakterii, w osoczu krwi oraz w lizosomach zwierzęcych. Neuramidaza odczepiając kwas sialowy umożliwia nowym kopiom wirusa wędrowanie i rozszerzanie infekcji na inne komórki. Katalizuje także rozpuszczanie mucyny w śluzie błonowym.
Substancje lecznicze, zanamiwir i oseltamiwir, zawierają ujemnie naładowaną grupę karboksylanową i acetamidową, a ponadto grupę guanidową lub aminową w pozycji 4, dzięki czemu mogą oddziaływać z aminokwasami centrum aktywnego neuramidazy. Są to ogólnie inhibitory nuramidazy.
3. Inhibitory gyrazy - mechanizm działania i zastosowanie (na jakie choroby)
Gyraza DNA to inaczej topoizomeraza II. Odpowiada ona za prawidłowy przebieg replikacji DNA (transkrypcja genów, naprawa DNA, rekombinacja genów).
Topoizomeraza I ma zdolność krótkotrwałego rozcinania jednej nici, a typ II (gyraza) rozcina obie nici oraz ponownie je łączy.
Lekami hamującymi są fluorochinolony, stosowane głównie w infekcjach bakteriami Gram-.
Fluorochinolony blokując gyrazę hamują przemianę materii bakterii, gdyż utrudniają wbudowywanie nukleotydów w chromosomach. W dużych stężeniach hamują syntezę DNA i uniemożliwiają podział komórek.
ZESTAW 4
1. Mechanizm działania, działania niepożądane aminoglikozydów
Mechanizm: Leki te hamują biosyntezę białek. Biosynteza białek u bakterii:
- transkrypcja DNA w wyniku której powstaje mRNA
- transport mRNA z jądra do rybosomów i tworzenie polisomów
- transport aminokwasów przez tRNA
- synteza białka:
Inicjacja - mała podjednostka rybosomu rozpoznaje sygnał startowy na mRNA = utworzenie kompleksu inicjującego 70S
Elongacja - wydłużanie łańcucha
Terminacja - bo pojawił się kodon stop, odłączenie mRNA od rybosomu, rozpad rybosomy.
Głównym miejscem działania aminoglikozydów jest kompleks inicjacyjny (translacja). Powodują one zakłócenie interakcji kodonu z antykodonem. Wiążą się z podjednostką 30S rybosomu. Miejscem ich przyłączenia jest głównie białko S3, S5 oraz S16 rRNA. Reakcja ta jest nieodwracalna, a zahamowanie biosyntezy białka wiąże się z zajęciem miejsca A na rybosomie. W mniejszych stężeniach aminoglikozydy błędnie rozszyfrowują kod genetyczny, powodując błędną translację, w wyniku której może mieć miejsce pominięcie kodonu terminalnych syntezy białka. Prowadzi to do anormalnie długich cząsteczek białka. W większych stężeniach aminoglikozydy uszkadzają także błony komórkowe bakterii, powodując wypływ niektórych jonów i związków małocząsteczkowych z cytoplazmy na zewnątrz komórki. Faktu tego nie należy identyfikować z lizą komórki.
Działania niepożądane:
- ototoksyczne. Gentamycyna, tobramycyna, sisomycyna uszkadzają nerw przedsionkowy; kanamycyna, amikacyna nerw ślimakowy; streptomycyna oba nerwy.
- neurotoksyczne.
- hamują przekaźnictwo nerwowo-mięśniowe.
2. Podział (kryteria podziału) i przykłady pochodnych penamu (penicylin)
Podział z uwzględnieniem pochodzenia, sposobu podania, spektrum działania:
półsyntetyczne parenteralne penicylinazależne: metycylina, nafcylina
półsyntetyczne doustne penicylinazależne: oksacylina, kloksacylina, dikloksacylina
półsyntetyczne parenteralne penicylinazowrażliwe : karbenicylina, karfecylina, karyndacylina, tikarcylina, azlocylina, mezlocylina, piperacylina
półsyntetyczne doustne penicylinazowrażliwe: ampicylina, amoksycylina
kwasoodporne: fenoksymetylopenicylina, oksacylina, kloksacylina, dikloksacylina, fluksacylina, nafcylina, ampicylina, amoksycylina
Podział pod względem budowy chemicznej:
naturalne: p. benzylowa, penicylina V (fenoksymetylopenicylina)
izoksazolopenicyliny: oksacylina, kloksacylina, dikloksacylina, fluksoksacylina
karboksypenicyliny: karbenicylina, karfecylina, karyndacyklina, tikarcyklina, temocylina
aminopenicyliny: ampicylina, piwamcylina, bakampicylina, talampicylina, sultamycylina, amoksycylina
ureidopenicyliny: azlocylina, mezlocylina, piperacylina
acyloaminopenicyliny: pirbenicylina, apalcylina
penicyliny acylowe : metycylina, nafcylina
p. amidynowe: mecylinam, piwmecylinam, bakmecylinam
3. Mechanizm działania, podział, przykłady leków przeciwko retrowirusom.
Inhibitory odwrotnej transkryptazy:
a) nukleozydowe inhibitory odwrotnej transkryptazy NRTI
analogi tymidyny - zydowudyna, stawudyna
analogi cytozyny - lamiwudyna, zalcytabina
analogi puryn - didanozyna, abakawir
Leki te są pro-lekami i w ustroju ulegają 5'fofsorylacji. Te pochodne łączą się z łączą się z enzymem, analogicznie jak naturalny substrat, ale z powodu braku grupy 3'OH w części cukrowej, nukleozydowe leki anty-retrowirusowe blokują wydłużanie łańcucha kwasu nukleinowego i dlatego nie może być przepisana informacja genetyczna z RNA, w postaci DNA. Leki te nie są skuteczne na wbudowane retrowirusy.
Lamiwurdyna hamuje także namnażanie wirusów WZW B.
b) Nukleotydopodobne inhibitory odwrotnej transkryptazy - tenofowir
c) Nienukleozydowe inhibitory odwrotnej transkryptazy NNRTI - efawirenz, delawirdyna, newirapina
Mechanizm: Leki te łączą się allosterycznie z enzymem w pobliżu miejsca przyłączenia substratu i hamują enzym kompetytywnie. Związanie inhibitora z enzymem blokuje enzym. Leki te nie hamują odwrotnej transkryptazy HIV-2 i ludzkiej polimerazy.
Inhibitory proteazy HIV I-PT: Sakwinawir, ritonawir, indinawir, nelfinawir, amprenawir, lapinawir.
Mechanizm: Retrowirusowa proteaza hamuje fragmenty polipeptydowe na mniejsze odcinki białka. Te o odpowiedniej długości są lokowane w wirusie, umożliwiają jego dojrzewanie i zdolność wywoływania infekcji. Gdy ta proteaza jest uszkodzona, to cząsteczki wirusa nie mogą dojrzeć, a wirus nie wywołuje infekcji.
mechanizmy działania leków hamujących syntezę peptydoglikanu
Cytoplazma bakterii otoczona jest błoną zbudowaną z białek i fosfolipidów. Na zewnętrznej części błony znajdują się białka wiążące penicyliny - PBP. W błonie baterii Gram - jest ich około 2 tysięcy. Peptydoglikan tworzy sztywną warstwę ściany, która utrzymuje kształt komórek. Zarówno u Gram - jak i + podstawowy łańcuch peptydoglikanu to naprzemiennie ułożone cząsteczki N-acetyloglukozaminy i kwasu N-acetylomuraminowego. Każda cząsteczka NAM jest połączona z łańcuchem pentappeptydowym (u G + 3 aminokwas to lizyna, a u G - to kwas m-diaminopimelinowy).
Rożne etapy biosyntezy są hamowane przez fosfomycynę, cykloserynę, bacytracynę, wankomycynę, teikoplaninę i antybiotyki beta-laktamowe.
Biosynteza peptydoglikanu przebiega w etapach:
- biosynteza NAG i NAM w komórce. NAM powstaje w reakcji NAG z fosfoenolopirogronianem pod wpływem transferazy pirogronianowej. Enzym hamowany przez fosfomycynę.
- biosynteza jednostki NAM-pentapeptyd z udziałem racematy i syntazy D-alaninowej. Enzymy hamowane przez cykloserynę.
- połączenie UDP-NAM-pentapeptyd z lipidowym nośnikiem w błonie komórkowej (P-P-C55-lipid).
- Biosynteza cząsteczki NAG-NAM(pentapeptyd)-P-P-C55-lipid.
- Przyłączenie mostka pentaglicynowego do є-aminowej grupy lizyny.
- Transport utworzonego disacharydodekapeptydu na zew błony i odczepienie P-P-C55-lipidu pod wpływem transglikozylazy. Enzym blokowany przez wankomycynę i teikoplaninę.
- Przyłączenie disacharydodekapeptydu do wydłużającego się łańcucha peptydoglikanu pod wpływem trans peptydazy. Enzym hamowany przez antybiotyki beta-laktamowe.
ZESTAW 5
1. Budowa, działanie i zastosowanie nitrofuranów:
Budowa:
pochodne 5-nitrofuraldehydu
dla aktywności przeciwbakteryjnej konieczna jest obecność grupy nitrowej w pozycji 5 furanu. Usunięcie grupy nitrowej lub zmiana pozycji powoduje zanik aktywności.
w pozycji 2 występuje grupa azometylenowa, podstawiona przy atomie azotu gr. alifatyczną lub heterocykliczną. Najczęściej to pięcioczłonowy pierścień hydantoiny lub oksazolidonu.
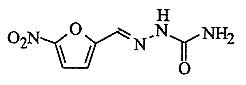
Nitrofural
Działanie:
Nitrofurany działają w małych dawkach i nie dają szczepów opornych. Nitrofurany działają na bakterie Gram-dodatnie i Gram-ujemne, takie jak:
- E. coli,
- Klebsiella,
- Enterobacter,
- Salmonella,
- Shigella,
- Enterococcae,
- Vibro cholerae,
- niektóre pierwotniaki np. Giardia lamblia.
NIE są skuteczne przeciwko: Proteus sp., Pseudomonas aeruginosa.
Zastosowanie:
- nitrofural stosuje się miejscowo jako antyseptyk skóry, uszu, oczu, śluzówek gardła i pochwy;
- furazolidon w zakażeniach jelitowych;
- nifurantel w stanach zapalnych pochwy;
- nitrofurantoinę w zakażeniach układu moczowego;
- nifuroksazyd w ostrych i przewlekłych biegunkach pochodzenia bakteryjnego, w zapaleniu okrężnicy i jelita cienkiego.
2. Antybiotyki peptydowe: mechanizmy działania i działania niepożądane
Mechanizmy działania:
I. Peptydy cykliczne
a) bacytracyna
Mechanizm działania bacytracyny polega na zakłócaniu biosyntezy ściany komórkowej bakterii. Jednostki budulcowe ściany komórkowej transportowane są za pośrednictwem nośnika lipidowego -> C55-izoprenylofosforanu. Nośnik na czas transportu przyłącza dodatkową resztę fosforanową. Aby nośnik odzyskał swoją funkcję i mógł przenosić następne jednostki budulcowe, musi ulec najpierw defosforylacji. Bacytracyna wiąże się z izoprenylofosforanem i uniemożliwia reakcję defosforylacji.
b) gramicydyna
Gramicydyna zwiększa przepuszczalność błony komórkowej poprzez tworzenie przepuszczalnych kanałów. Antybiotyk ulega sfałdowaniu w otwarta strukturę spiralną, stabilizowaną wiązaniami wodorowymi. Dzięki spiralnemu ułożeniu z 2 cząsteczek antybiotyku tworzy się 1 kanał, którym wybiórczo przenikać mogą jony potasu i niektóre inne kationy. Związki działające wg tego mechanizmu to jonofory.
c) polimyksyny
Polimyksyny zawierają ugrpowania hydrofilne i lipofilne, które ułatwiają przenikanie antybiotyku do komórek błonowych, w których integrują z fosfolipidami błonowymi. Reszta kwasu tłuszczowego antybiotyku penetruje do hydrofobowej części błony, natomiast pierścień polipeptydowy polimyksyn wiąże się z grupami fosforanowymi błony. Polimyksyny zachowują się więc jak detergenty kationowe. Ostatecznym wynikiem tego działania jest zwiększenie przepuszczalności błon, wypływ zawartości cytoplazmatycznej i zniszczenie komórki.
II. Streptograminy:
Streptograminy hamują syntezę białka. Każda ze streptogramin łączy się z inną podjednostką rybosomu. Streptograminy B uwrażliwiają bakterie na działanie streptogramin A.
III. Glikopeptydy (wankomycyna, teikoplanina):
Mechanizm działania polega na zakłócaniu biosyntezy ściany komórkowej. Miejscem działania jest acylo-D-alanino-D-alanina. W cyklu biosyntezy błony komórkowej utworzony zostaje muramylopeptyd, który zostaje przekazany do nośnika lipidowego, znajdującego się w błonie komórkowej. Tam łączy się z jednostką N-acyloglukozaminową, razem z jakimkolwiek aminokwasem potrzebnym do utworzenia mostka międzypeptydowego. Wówczas ugrupowanie podstawowe ulega przetransportowaniu przez błonę komórkową do końca powstającej cząsteczki peptydoglikanu. Ten etap przenoszenia blokowany jest przez antybiotyki glikopeptydowe, które wiążą się z acylo-D-alanylo-D-alaninowym końcem muramylopentapeptydu.
Działania niepożądane:
Wankomycyna działa oto- i nefrotoksycznie. Po podaniu dożylnym może wystąpić zakrzepowe zapalenie żył. Często obserwuje się też nadwrażliwość, co ogranicza zastosowanie.
3. Podział, mechanizmy p/grzybiczych
Podział:
Tworzące kompleksy z ergosterolem: Antybiotyki polienowe - Amfoterycyna, Nystatyna
Hamujące przebieg mitozy: Gryzeofulwina
Zakłócające biosyntezę ergosterolu
a) Alliloaminy - inhibitory skwalenoepoksydazy
Naftyfina, Terbinafina
b) Azole
Diazole - inhibitory lanosterolo-14α-demetylazy: Izokonazol, Mikonazol, Ekonazol, Tiokonazol, Oksykonazol, Sulfokonazol, Ketokonazol, Klotrimazol
Triazole - inhibitory lanosterolo-14α-demetylazy: Flukonazol, Terkonazol, Itrakonazol
c) Pochodne morfoliny - inhibitory Δ14-reduktazy i Δ7Δ8-izomerazy
Amorolfina
IV. Inhibitory tymidylosyntazy
a) Flucytozyna
V. Inne:
a) Kwasy karboksylowe
- Kwas undecylenowy
- Kwas benzoesowy i jego estry - metylowy, etylowy, propylowy (Nipaginy M, A, P)
- Kwas salicylowy i jego pochodne - amidy, anilidy
b) Pochodne chlorofenolu
- Heksachlorofen, Dichlorofen, Heksylorezorcynol
c) ochodne pirydyny
- Cyklopiroks
d) organiczne związki siarki
- Sulbentyna, Tolnaftat
ZESTAW 6
1. Budowa pochodnych cefemu, podział cefalosporyn na generacje + przykłady + cechy każdej generacji
Budowa:
Cefalosporyny są pochodnymi Δ2-cefemu. Układ ten stanowi połączenie β-laktamowo-tiazynowe, na które składa się 4-członowy pierścień β-laktamowy połączony z 6-członowym pierścieniem dihydrotiazynowym.
Podział cefalosporyn na generacje:
Cefalosporyny I generacji charakteryzują się:
małą opornością na działanie β-laktamaz
silniejszym działaniem na bakterie Gram+ niż Gram-
brakiem aktywności w stosunku do bakterii Gram- takich jak: Proteus-indolo-dodatnie, Pseudomonas aeruginosa i Enterobacter. Są również nieskuteczne w salmonellozach.
niewrażliwością na inaktywujące działanie penicylinazy gronkowcowej
są stosowane tylko pozajelitowo (nie wchłaniają się z przewodu pokarmowego)
przykłady: Cefalotine, Cefaprin, Cefazolin, Cefacetril
Cefalosporyny II generacji:
wykazują znaczną oporność na działanie β-laktamaz
silniejsze działanie na bakterie Gram- niż Gram+
są nieaktywne w stosunku do Pseudomonas i beztlenowców
działają na bakterie Proteus
stosowane wyłącznie pozajelitowo: Cefamandol, Cefuroxime, Cefonicid, Ceforanid
stosowane doustnie: Cefaclor, Cefprozil, Cefuroxime axetil
Cefalosporyny III generacji:
wykazują bardzo dużą oporność na działanie β-laktamaz
działają na Gram+ słabiej niż cefalosporyny I generacji i cefamandol, natomiast silniej na Gram- niż niż cefalosporyny II generacji
większość ma szerokie spektrum działania
stosowane pozajelitowo: Cefotaxime, Cefodizime, Latamoksef
stosowane doustnie: Cefixime, Ceftibuten
Cefalosporyny VI generacji zawierają:
podstawnik 2-aminotiazolowy i ugrupowanie alkoksyiminowe przy węglu α podstawnika acylowego w pozycji 7 cefemu
w pozycji 3 cefemu podstawnik z ugrupowaniem amoniowym
duża aktywność w stosunku do bakterii Gram-
oporność na działanie β-laktamaz
przenikanie do płynu mózgowo-rdzeniowego
przykłady: Cefepime, Cefpirome
2. Mechanizm działania antybiotyków β-laktamowych
Mechanizm działania antybiotyków β-laktamowych polega na hamowaniu biosyntezy ściany komórkowej bakterii. Działanie to jest uwarunkowane hamowaniem aktywności układu biokatalizatorów- transpeptydazy, karboksypeptydazy i endopeptydazy, czyli białek wiążących penicylinę (PBP). Antybiotyki β-laktamowe, wykazując strukturalne podobieństwo do dipeptydu D-Ala-D-Ala substratu dla transpeptydazy, wiążą się kowalencyjnie z centrum aktywnym transpeptydazy i blokują ją nieodwracalnie. Konsekwencją hamowania peptydaz jest nagromadzenie się w komórce UMP i N-acylowych pochodnych kwasu muraminowego. Powoduje to wzrost aktywności enzymów autolitycznych. Efektem autolizy jest uniemożliwienie adhezji komórki bakteryjnej do komórki gospodarza. Efektem działania białek PBP związanych z β-laktamami jest wywołanie deformacji kształtu komórki. Deformacja kształtu nie daje bakteriom szans na przeżycie, ponieważ zwiększa się ich wrażliwość na czynniki zewnętrzne i enzymy autolityczne, powodujące lizę komórki.
3. Podział leków przeciwmalarycznych + przykłady
Leki przeciwmalaryczne |
Pochodne chinoliny |
* Pochodne 4-aminochinoliny - Chlorochina, Amodiachina * Pochodna 8-aminochinoliny - Prymachina * Pochodna 4-metanolochinoliny - Meflochina |
|
Pochodne akrydyny |
Mepakryna |
|
Pochodne fenantrenu |
Halofantryna |
|
Pochodne biguanidu |
Proguanil |
|
Pochodne pirymidyny |
Pirymetamina |
ZESTAW 7
Podział, przykłady i budowa leków beta-laktamowych
Pochodne azetydynonu (monobaktamy): aztreonam, tigemonam, carumonam
Pochodne penamu (penicyliny):
Podział z uwzględnieniem pochodzenia, sposobu podania, spektrum działania:
półsyntetyczne parenteralne penicylinazależne: metycylina, nafcylina
półsyntetyczne doustne penicylinazależne: oksacylina, kloksacylina, dikloksacylina
półsyntetyczne parenteralne penicylinazowrażliwe : karbenicylina, karfecylina, karyndacylina, tikarcylina, azlocylina, mezlocylina, piperacylina
półsyntetyczne doustne penicylinazowrażliwe: ampicylina, amoksycylina
kwasoodporne: fenoksymetylopenicylina, oksacylina, kloksacylina, dikloksacylina, fluksacylina, nafcylina, ampicylina, amoksycylina
Podział pod względem budowy chemicznej:
naturalne: p. benzylowa, penicylina V (fenoksymetylopenicylina)
izoksazolopenicyliny: oksacylina, kloksacylina, dikloksacylina, fluksoksacylina
karboksypenicyliny: karbenicylina, karfecylina, karyndacyklina, tikarcyklina, temocylina
aminopenicyliny: ampicylina, piwamcylina, bakampicylina, talampicylina, sultamycylina, amoksycylina
ureidopenicyliny: azlocylina, mezlocylina, piperacylina
acyloaminopenicyliny: pirbenicylina, apalcylina
penicyliny acylowe : metycylina, nafcylina
p. amidynowe: mecylinam, piwmecylinam, bakmecylinam
Pochodne karbapenemu: imipenem, meropenem, ertapenem
Pochodne oksapemu: kwas klawulanowy
Pochodne cefemu (cefalosporyny):
I generacja: pozajelitowo: cefalotyna, cefapiryna, cefazolina, cefacetril
Doustnie: cefaleksyna, cefradyna, cefadroksil, cefaglicyna, cefroksadyna
II generacja: pozajelitowo: cefamandol, cefuroksyma, cefonicyd, cefotiam, ceforanid, cefmetazol, cefoksytyna
Doustnie: cefaklor, cefprozil, lorakarbef
III generacja: pozajelitowo: cefotaksyma, ceftiakson, cefodizime, cefmenoksime, ceftazidyma, cefoperazon, cefsulodyna, latamoksef, flomoksef
Doustnie: cefixime, ceftibuten, cefpodoxime proxetil, cefetamet piwoxil
IV generacja: cefepime, pefpirome
Pochodne karbacefemu: tienamycyna, imipenem, meropenem, ertapenem
Pochodne oksacefemu: latamoksef
Mechanizm działania leków blokujących syntezę białek
Biosynteza białek u bakterii:
- transkrypcja DNA w wyniku której powstaje mRNA
- transport mRNA z jądra do rybosomów i tworzenie polisomów
- transport aminokwasów przez tRNA
- synteza białka:
Inicjacja - mała podjednostka rybosomu rozpoznaje sygnał startowy na mRNA =, utworzenie kompleksu inicjującego 70S
Elongacja - wydłużanie łańcucha
Terminacja - bo pojawił się kodon stop, odłączenie mRNA od rybosomu, rozpad rybosomu
Tutaj działają aminoglikozydy, które zakłócają interakcję kodonu z antykodonem, bo wiążą się z podjednostką 30S. Jest to reakcja nieodwracalna. W mniejszych stężeniach aminoglikozydy błędnie odczytują kod genetyczny, co może skutkować pominięciem kodonów stop i powstają wtedy anormalnie długie białka. W większych stężeniach amino glikozydy uszkadzają także błony komórkowe, bo powodują wypływ jonów i związków małocząsteczkowych z cytoplazmy na zewnątrz komórki.
Streptomycyna niszczy kompleks rybosomy i mRNA (polysom), a więc przerywa translację, uniemożliwia powstanie białka.
Antybiotyki tetracyklinowe (tetracykliny) reagują nieodwracalnie z podjednostką 30S, uniemożliwiają wiązanie aminoacylo-tRNA. W dużych stężeniach hamują wydłużanie łańcucha peptydowego i germinację syntezy. Magnez i wapń działają kompleksotwórczo, przez co zaburzają funkcjonowanie rybosomów.
Chloramfenikol wiąże się z podjednostką 50S rybosomu, blokuje wiązanie aminoacylo-tRNA z rybosomom, jest więc inhibitorem peptydotranserazy. Wpływa również na uwalnianie oligopeptydylo-tRNA z rybosomów, a więc zakłóca translację.
Antybiotyki makrolidowe i linkozamidy reagują z podjednostką 50S rybosomy, zakłócają translokację.
Odsyłam do schematu na stronie 475 w podręczniku.
3. Podział i mechanizmy działania leków antyseptycznych i dezynfekcyjnych
Antyseptyki = leki przeznaczone do odkażania żywych tkanek ustroju). Leki dezynfekujące działają w środowisku otaczającym człowieka. Mechanizm działania odkażającego zależy od charakteru chemicznego środka chemicznego.
Tlenek etylenu i aldehydy alkilują białka; alkohole i fenole powodują dehydratację białek, jod utlenia białka, kationity zmieniają przepuszczalność błon komórkowych.
Związki jodu najpierw muszą przeniknąć do rany i dopiero tam jako substancje aktywne działają odkażająco.
Aldehydy |
Glutaral |
Fenole |
Heksachlorofen |
Związki jodu |
Jodopowidon, Kadeksomer jodu |
Pochodne 8-hydroksychinoliny |
Chlorchinaldyna, Kliokwinol |
Pochodne akrydyny |
Etakrydyna i pochodne |
Tenzydy (Detergenty) |
Benzododecyna, Bromek cetrymonium, Bromek domifenu, Chlorek cetylopirydyniowy, Chlorek dekwalinium, Chlorowodorek octenidyny, Chlorheksydyna, Ambazon |
ZESTAW 8
Chinolony i fluorochinolony - budowa a działanie + przykłady leków
Związki te zawierają w swojej cząsteczce chinolinowy układ pierścieni, ale wyjątkiem jest tutaj 1,8-naftochydryna. Układ chinolinonu lub naftychydryny jest zasadniczym elementem szkieletu. Inne elementy:
- ugrupowanie karbonylowe w pozycji 4
- w pozycji 3 grupa karboksylowa (te grupy położone w jednej płaszczyźnie = powinowactwo do DNA)
- rożne podstawniki w pozycjach 1, 5, 6, 7 (decydują o aktywności)
W pozycji 1: liofilowe: etylowy, fluoroetylowy, difluoroetylowy, cyklopropylowy, tertbutylowy, mono i difluorofenylowy.
- fluor warunkuje działanie p-bakteryjne, może być w pozycji 5, 6 i 8 lub w podstawnikach zajmujących pozycję 1
- grupa amoniowa w pozycji 5 warunkuje działanie p-bakteryjne;
- podstawnik 4-metylo-piperazowy w pozycji 7 wydłuża okres półtrwania; inne heterocykliczne podstawniki w tej pozycji wzmacniają siłę działania
I generacja (tylko na G -): kwas nalidyksowy, pipemidowy, oksolinowy
II generacja (słabiej na Gram + niż na Gram -): rosoksacyna
III generacja (fluorochinony): norfoksacyna, perfloksacyna, ciprofloksacyna, ofloksycyna, fleroksacyna, sparfloksacyna, enoksacyna, tosufloksacyna
Otrzymano także dimery połączone łańcuchem alkilowym, np. dimer norgoksacyny.
Otrzymuje się także pro-leki o korzystnych właściwościach, np. Ro 23-9424.
2. podział i przykłady antybiotyków hamujących syntezę białek
antybiotyki aminoglikozydowe
gentamycyna i analogi: sisomycyna, netelmicyna
streptomycyna
kanamycyny i analogi: amikacyna, tobramycyna, dibekacyna
neomycyny i analogi: paromycyna
spektynomycyna
tetracykliny: tetracyklina, oksytetracyklina, chlortetracyklina, demeklocyklina, metacyklina, doksycyklina, minocyklina, limecyklina
chloramfenikol i pochodne: tiamfenikol, azidamfenikol
antybiotyki makrolidowe (niepolienowe): erytromycyna, roksytromycyna, klarytromycyna, azytromycyna
linkozamidy: linkomycyna, klindamycyna
antybiotyki pochodne oksazolidynonu: linezolid, eperezolid
inne: mupirocyna, kwas fusydowy, streptograminy
3. Działania niepożądane i mechanizmy leków przeciwgruźliczych
Etambutanol działa bakteriobójczo. Ubocznie wywołuje: zaburzenia wzroku, zaburzenia przewodu pokarmowego, bóle i zawroty głowy.
b) Izoniazyd:
- blokuje syntezę kwasów mykolonowych powstających w błonie komórkowej
- zakłóca aktywność układów oksydacyjno-redukcyjnych w prątkach, bo żelazo ma właściwości chelatujące oraz kwas izonikotynowy tworzy fałszywy NAD.
Ubocznie: obwodowa neuropatia (parastezja), hepatotoksyczność, nieprawidłowe zachowania, drgawki, neuropatie wzrokowe, nadpobudliwość, gorączka.
Refampicyna hamuje syntezę RNA zależnej od DNA, uniemożliwia transkrypcję
RNA na matrycy DNA. Ryfampicyna wiąże się bowiem nieodwracalnie z podjednostką beta polimerazy RNA.
Ubocznie: nudności, wymioty, pobudzenie, gorączka.
Streptomycyna działa bakteriobójczo na prątki poza komórkami ustroju.
Ubocznie: neurotoksyczność, poraża nerw słuchowy.
Cykloseryna blokuje racemazę i syntazę D-alaninową przez co uniemożliwia
powstanie D-alanylo-D-alaniny i dalej hamuje syntezę ściany komórkowej.
Ubocznie: zaburzenia OUN, zwiększenie częstości napadów padaczki, obwodowe neuropatie.
PAS działa konkurencyjnie w stosunku do PABA.
Ubocznie: nudności, dyskomfort w jamie brzusznej, biegunki
ZESTAW 9
Budowa chemiczna a działanie sulfonamidów + podział i przykłady
Działają bakteriostatycznie. Wykorzystywane są w infekcjach przewodu pokarmowego, infekcjach przewodu moczowego, zakażeniach chlamydią. Są to pochodne amidu kwasu 4-aminobenzenosulfonowego.
- do działania konieczny jest pierścień benzenu, nie można go zastąpić
- niealkilowana I-rzędowa grupa aminowa w pozycji para
- grupa sulfonamidowa niealkilowana ani zastąpiona grupą sulfonową.
W zależności od podstawnika mamy:
- acylowe pochodne: sulfacetamid, sulfkarbamid, sulfadikarbamid
- N1-heterocykliczne 6-członowe pochodne (mają pirazynę lub pirymidynę w pozycji 2 lub 4; pierścień może mieć podstawniki metylowe lub metoksylowe decydujące o czasie działania): sulfadiazyna, sulfamerazyna, sulfadimidyna
- N1-hetrocykliczne 5-członowe pochodne (mają układ tiazolu, oksazolu, izoksazolu): sulfatiazol, sulfafurazol, sulfamoksazol.
- N, N4-dipodstawione: sukcynylosulfatiazol, ftalilosulfatiazol, salazosulfapirydyna
2. Leki przeciwgruźlicze podział i przykłady
Etambutanol, Izoniazyd, Streptomycyna, Cykloseryna, PAS
Ryfamycyny: ryfampicyna, ryfapentyna, ryfabutyna
3. Podział antybiotyków peptydowych + przykłady
Peptydy cykliczne: bacytracyna, gramicydyna, kapreomycyna, wiomycyna, polimyksyny B i E
Streptograminy: chinuprysyna, dalfoprystyna
Glikopeptydy: wankomycyna, teikoplanina, bleomycyna
Lipopeptydy: daptomycyna
ZESTAW 10
1. Pochodne karbapenemu i monobaktamy- przykłady i zastosowanie
Przykłady:
Pochodne karbapenemu: Imipenem, Meropenem, Ertapenem
Monobaktamy: Aztreonam, TigemonamCarumonam
Zastosowanie:
Imipenem, Meropenem- leczenie ciężkich zakażeń, zwłaszcza Pseudomonas spp., szerokie spektrum działania
Ertapenem- działa na bakterie Gram+ z wyjątkiem enterokoków i gronkowców opornych na oksacylinę; działa silniej na Gram- niż Imipenem i Meropenem, ale ma mniejszą aktywnośc w stosunku do Pseudomonas spp.
Monobaktamy- aktywność bakteriobójcza w stosunku do bakterii Gram-, z pominięciem ziarniaków i beztlenowców.
2. Antybiotyki aminoglikozydowe - podział, działanie i przykłady
Antybiotyki aminoglikozydowe |
* Gentamycyna i jej analogi - Sisomycyna, Netelmicyna * Streptomycyna * Kanamycyny i ich analogi - Amikacyna, Tobramycyna, Dibekacyna * Neomycyny i ich analogi - Paromycyna * Spektynomycyna |
Antybiotyki aminoglikozydowe działają szczególnie skutecznie w infekcjach wywołanych pzez drobnoustroje Gram- z rodziny Enterobacteriaceae (Escherichia, Klebsiella, Enterobacter, Proteus) i inne (Pseudomonas) a także Mycobacterium tuberculosis. Nie działają natomiast na Streptococcus, Fusobacterium i Clostridium. Antybiotyki aminoglikozydowe stosowane w skojarzeniu z niektórymi antybiotykami β-laktamowymi wykazują działanie synergiczne na niektóre bakterie z rodzaju Pseudomonas, Enterobacter, Enterococcus. Antybiotyki aminoglikozydowe same nie działają na paciorkowce, ale zwiększają aktywność przeciwpaciorkowcową antybiotyków β-laktamowych.
3. Makrolidy, linkozamidy - przykłady i zastosowanie
Antybiotyki makrolidowe (niepolienowe) |
Erytromycyna, Roksytromycyna, Klarytromycyna, Azytromycyna |
Linkozamidy |
Linkomycyna, Klindamycyna |
Zastosowanie:
a) makrolidy
Roksytromycyna jest zalecana w zakażeniach górnego i dolnego odcinka układu oddechowego, erytromycyna jest aktywniejsza wobec paciorkowców, klarytromycyna wobec Legionella i Corynebacterium, azytromycyna jest skuteczna w zwalczaniu szczepów Neisseria i Hemophilus.
Zastosowanie makrolidów w lecznictwie dotyczy głównie zwalczania zakażeń wywołanych przez ziarniaki Gram+, leczenia zakażeń spowodowanych przez mykoplazmy, infekcji płuc wywołanych przez beztlenowce.
ZESTAW 11
1. Zastosowanie, działanie, podział i przykłady sulfonamidów
|
|
N1-acylowe pochodne |
Sulfacetamid, Sulfakarbamid, Sulfadikramid |
N1-heterocykliczne sześcioczłonowe pochodne |
Sulfadiazyna, Sulfamerazyna, Sylfadimidyna, Sulfametoksydiazyna, Sulfadoksyna, Sulfalen |
N1-heterocykliczne pięcioczłonowe pochodne |
Sulfatiazol, Sulfafurazol, Sulfamoksol |
N1,N4-dipodstawione pochodne |
Sukcynylosulfatiazol, Ftalilosulfatiazol, Salazosylfapirydyna |
Działanie:
- Pochodne 4-aminobenzenosulfonamidu działają konkurencyjnie w stosunku do kwasu 4aminobenzoesowego (PABA), który jest koniecznym substratem w biosyntezie kwasu dihydrofoliowego. Wynika to ze znacznego podobieństwa ich budowy przestrzennej i elektronowej do PABA.
- Sulfonamidy hamują aktywność syntetazy dihydropterydynowej, współzawodnicząc z kwasem 4-aminobenzoesowym (PABA) o aktywne miejsce w enzymie
- W wyniku blokowania przez sulfonamidy syntezy dihydrofolianu mikroorganizmy, które nie wytwarzają endogennego PABA, nie syntetyzują tetrahydrofolianu i jego aktywnych form.
- Biosynteza kwasu tetrahydrofoliowego może być hamowana na dwóch etapach. Antagoniści PABA zakłócają biosyntezę kwasu 7,8-dihydropterydynowego, natomiast antagoniści kwasu dihydrofoliowego
Zastosowanie:
- Sulfonamidy z powodu narastającej oporności bakterii, niekorzystnego współczynnika terapeutycznego i niekorzystnych parametrów farmakokinetycznych straciły dużo ze swojego pierwotnego znaczenia leczniczego. Aktualnie nie ma bezwzględnych wskazań do ich stosowania.
- Dobre rezultaty uzyskuje się stosując łącznie sulfonamidy z innymi chemioterapeutykami. Zalicza się do nich:
Co-trymoxazole - mieszanina trimetoprimu i sulfametoksazolu w stosunku 1:5
Co-trifamole - mieszanina trimetoprimu i sulfamoksolu w stosunku 1:5
Co-trimazine - mieszanina trimetoprimu i sulfadiazyny w różnych
2. Leki p-pierwotniakowe - podział, przykłady, zastosowanie
|
||
Leki przeciwmalaryczne |
Pochodne chinoliny |
* Pochodne 4-aminochinoliny - Chlorochina, Amodiachina * Pochodna 8-aminochinoliny - Prymachina * Pochodna 4-metanolochinoliny - Meflochina |
|
Pochodne akrydyny |
Mepakryna |
|
Pochodne fenantrenu |
Halofantryna |
|
Pochodne biguanidu |
Proguanil |
|
Pochodne pirymidyny |
Pirymetamina |
Leki stosowane w innych chorobach wywołanych przez pierwotniaki |
Pochodne diamidyny |
Pentamidyna, Stibamidyna |
|
Pochodne dichloroacetamidu |
Diloksanid |
|
Pochodne izochinoliny |
Dehydroemetyna |
|
Pochodne 5-nitroimidazolu i 5-nitrotiazolu |
Metronidazol, Tynidazol, Ornidazol, Nimorazol, Niridazol |
Zastosowanie:
Leki przeciwmalaryczne: leczenie różnych stadiów malarii (zimnicy).
Leki stosowane w innych chorobach:
- leczenie czerwonki pełzakowatej (amebiozy), śpiączki afrykańskiej (trypanosomatozy), lambliozy, leiszmaniozy (choroby kala-azar).
3. Leki przeciwrobacze: podział, przykłady, mechanizm działania, zastosowanie
|
|
Leki porażające system nerwowo-mięśniowy pasożytów |
Pyrantel, Lewamizol, Befenium, Prazykwantel |
Leki zakłócające przemianę materii |
Niklozamid, Pirwynium, Tiabendazol, Mebendazol, Flubendazol, Albendazol |
Mechanizm działania:
Leki porażające system nerwowo-mięśniowy pasożytów:
Hamuja skurcz mięśni, wywołany działaniem robaczej acetylocholiny. Wywołany w ten sposób paraliż ułatwia usunięcie robaków z organizmu człowieka. Według innego mechanizmu, leki przeciwrobacze tej grupy zwiększają przepuszczalność błon komórkowych dla jonów wapnia. Powoduje to obniżenie ich stężenia wewnątrzkomórkowego, co wiąże się z porażeniem sprawności komórek mięśniowych.
Leki zakłócające przemianę materii:
Leki te ingerują w przemianę węglowodanów, powodując niecałkowitą oksydację substratów u robaków. Głównym źródłem pozyskiwania energii u robaków jest proces glikolizy, katalizowany przez fosfofruktokinazę. Zablokowanie fruktokinazy w procesie glikolizy powoduje nagromadzenie się substratu, którym jest fruktozo-6-P.
Zastosowanie:
Leczenie infekcji wywołanych przez pasożyty przewodu pokarmowego, należących do 3 głównych klas: Cestodes (tasiemce), Nematodes (obleńce) i Trematodes (przywry).
ZESTAW 12
Mechanizm działania sulfonamidów (z reakcją powstawania THF)
Sulfonamidy działają konkurencyjnie w stosunku do kwasu 4-aminobenzoesowego (PABA), który jest nieodzownym substratem w biosyntezie kwasu dihydrofoliowego.
Sulfonamidy hamują aktywność syntetazy dihydropterydynowej, współzawodnicząc z PABA o miejsce aktywne w enzymie. W wyniku blokowania tego enzymu, mikroorganizmy nie syntezują dihydrofolianu (DHT) i jego aktywnych form, które są donorami fragmentów jednowęglowych w biosyntezie formylometionin (umożliwiają rozpoczęcie etapu inicjacji w biosyntezie węgla), puryn i pirymidyn.
Synteza kwasu tetrahydrofoliowego jest hamowana w 2 miejscach:
- antagoniści PABA hamują syntezę kwasu 7,8-dihydropterydynowego (sulfonamid i analogi)
- antagoniści tego kwasu blokują reduktazę dihydrofolianową (trimetropim, pirymetamina, proguanil, metotreksat). Odsyłam do schematu na str. 471 w podręczniku.
2. Chloramfenikol i pochodne - charakterystyka budowy, przykłady, zastosowanie
Są to leki przeciwbakteryjne, hamują biosyntezę białek przez drobnoustroje. Działają bakteriostatycznie i bakteriobójczo.
Budowa chloramfenikolu: Jest to pochodna propandiolu. Nieodzowne do działania są grupa nitrowa i 2 atomy chloru związane kowalencyjnie z grupą acetyloaminową. Ma 2 centra chiralne. (nie ma nic o budowie reszty pochodnych)
Inne pochodne: Tiamfenikol, Azydoamfenikol.
Zastosowanie tej grupy: zakażenia inwazyjne riketsjami, ropnie mózgu, zakażenia wewnątrz gałkowe, dur, paradur, zapalenie opon mózgowo-rdzeniowych, zakażenia płuc, posocznica, zmiany martwicze w płucach, krztusiec.
Podział, przykłady leków p-grzybiczych
Tworzące kompleksy z ergosterolem |
Antybiotyki polienowe - Amfoterycyna, Nystatyna |
|||
Hamujące przebieg mitozy |
Gryzeofulwina |
|||
Zakłócające biosyntezę ergosterolu
Zakłócające biosyntezę ergosterolu - c.d. |
Alliloaminy - inhibitory skwalenoepoksydazy |
Naftyfina, Terbinafina |
||
|
Azole |
* Diazole - inhibitory lanosterolo-14α-demetylazy: Izokonazol, Mikonazol, Ekonazol, Tiokonazol, Oksykonazol, Sulfokonazol, Ketokonazol, Klotrimazol * Triazole - inhibitory lanosterolo-14α-demetylazy: Flukonazol, Terkonazol, Itrakonazol |
||
|
Pochodne morfoliny - inhibitory Δ14-reduktazy i Δ7Δ8-izomerazy |
Amorolfina |
||
Inhibitory tymidylosyntazy |
Flucytozyna |
|||
Inne |
Kwasy karboksylowe |
* Kwas undecylenowy * Kwas benzoesowy i jego estry - metylowy, etylowy, propylowy (Nipaginy M, A, P) * Kwas salicylowy i jego pochodne - amidy, anilidy |
||
|
Pochodne chlorofenolu |
Heksachlorofen, Dichlorofen, Heksylorezorcynol |
||
|
Pochodne pirydyny |
Cyklopiroks |
||
|
Organiczne związki siarki |
Sulbentyna, Tolnaftat |
||
Wyszukiwarka