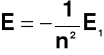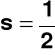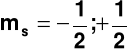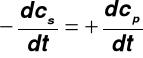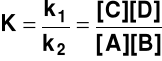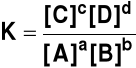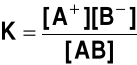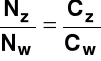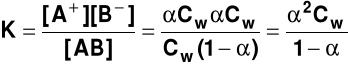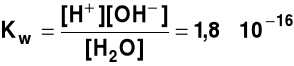Chemia - jedna z podstawowych nauk przyrodniczych, zajmująca się badaniem właściwości i przemian substancji oraz warunków i efektów tych przemian Chemia analityczna - dział chemii zajmujący się ustalaniem składu jakościowego i ilościowego substancji Chemia czysta - dział chemii obejmujący badania prowadzone w celach poznawczych Chemia fizyczna (fizykochemia) - nauka zajmująca się badaniem zależności między właściwościami fizycznymi a budową chemiczną substancji i układów, a także badaniem zjawisk fizycznych związanych z przebiegiem procesów chemicznych Chemia jądrowa - dział chemii zajmujący się zagadnieniami związanymi z jądrowymi przemianami substancji oraz z wykorzystaniem energii jądrowej Chemia kwantowa - dział chemii teoretycznej rozpatrujący i interpretujący zjawiska chemiczne w oparciu o mechanikę kwantową Chemia nieorganiczna - dział chemii obejmujący badania właściwości i przemian związków chemicznych wszystkich pierwiastków oprócz węgla (ze związków węgla chemia nieorganiczna rozpatruje tylko najprostsze: tlenki, węgliki, węglany, cyjanki itp.) Chemia ogólna - dział chemii, którego zadaniem jest formułowanie najbardziej ogólnych praw chemii Chemia organiczna - dział chemii obejmujący badania naturalnych i syntetycznych związków węgla z wyjątkiem nielicznych, tradycyjnie rozpatrywanych przez chemię nieorganiczną (tlenków węgla, węglików, węglanów, cyjanków itp.) Chemia stosowana - dział chemii zajmujący się możliwymi zastosowaniami wyników badań chemii czystej do celów praktycznych, np. opracowywanie metod produkcji na skalę przemysłową pewnych związków chemicznych Stereochemia - dział chemii zajmujący się przestrzennym rozmieszczeniem atomów w cząsteczce (wzorami strukturalnymi) Inżynieria chemiczna (i procesowa) - nauka o operacjach i procesach jednostkowych stosowanych w przemyśle chemicznym i pokrewnych; inżynieria chemiczna bada operacje i procesy jednostkowe z punktu widzenia termodynamicznego (statycznego) i kinetycznego; rozpatrując kompleksowo zjawiska przepływowe, cieplne, dyfuzyjne i chemiczne dąży do uzyskania ilościowego ujęcia, pozwalającego przewidywać przebieg operacji lub procesu w danej skali |
Operacje jednostkowe - czynności o charakterze fizycznym lub fizykochemicznym nie połączone z reakcją chemiczną, mające najczęściej na celu rozdzielenie lub oczyszczenie substancji lub zmianę właściwości fizycznych lub fizykochemicznych obrabianych materiałów; do operacji fizycznych można zaliczyć: sączenie, filtrację, wirowanie, odpylanie, a do operacji fizykochemicznych: rektyfikację, krystalizację, ekstrakcję, absorpcję, adsorpcję, flotację, suszenie Procesy jednostkowe - podstawowe procesy jakie można wyróżnić w ciągu technologicznym przemysłu chemicznego i przemysłach pokrewnych; można je dzielić wg typów reakcji chemicznych, wg rodzajów faz biorących udział w procesie (np. proces przebiegający w układzie jedno- lub dwufazowym) oraz wg warunków prowadzenia procesu (np. proces próżniowy lub ciśnieniowy) SYMBOLE, WZORY I RÓWNANIA CHEMICZNE Symbole pierwiastków chemicznych (Berzelius, 1814) - symbole literowe, które stanowią jedną lub dwie litery alfabetu łacińskiego. Pierwsza litera jest zawsze duża (i jest zawsze pierwszą literą łacińskiej nazwy pierwiastka), a druga jest mała (jest jedną z następnych liter nazwy pierwiastka) Wzór chemiczny - umowne znaki powstałe z napisania (w określonej kolejności) symboli pierwiastków, z których składa się dany związek. Jeżeli cząsteczka zawiera kilka atomów danego pierwiastka, to ich liczbę zaznacza się prawym dolnym indeksem (liczby 1 nie podaje się) Wzór sumaryczny (empiryczny, stosunkowy) - wzór typu AnBm (A, A - symbole pierwiastków; n, m - liczba atomów); określa: 1) skład stechiometryczny (skład atomowy) substancji, np. na podstawie analizy ilościowej (jest to tzw. wzór „najprostszy” - np. dla etanu: CH3); 2) masę cząsteczkową (a na jej podstawie tzw. wzór „cząsteczkowy”, „prawdziwy”, „rzeczywisty” - np. dla etenu:C2H6) Wzór strukturalny (strukturowy) - w odróżnieniu od wzoru sumarycznego określa nie tylko rodzaj i liczbę atomów każdego pierwiastka, lecz także sposób wzajemnego powiązania atomów w cząsteczce lub jonie |
POSTULATY „TEORII STRUKTURALNEJ” (OK. 1850 R.) (POSTULAT - TWIERDZENIE NIEUDOWODNIONE) 1. Atomy tworzące cząsteczki są połączone wiązaniami chemicznymi 2. Liczba wiązań chemicznych, które tworzy atom, jest cechą charakterystyczną pierwiastka i jego podstawową właściwością chemiczną 3. Pierwiastki mogą zmieniać wartościowość (liczbę wiązań) w zależności od pierwiastka, z którym tworzą związek chemiczny, lub w zależności od warunków przeprowadzenia reakcji, np. H2S - S(II); SO2 - S(IV); SO3 - S(VI) 4. Mogą istnieć związki o identycznych wzorach sumarycznych, lecz różnych wzorach strukturalnych (zjawisko izomerii), np. CH3 - CH2 - OH CH3 - O - CH3 alkohol etylowy eter dwumetylowy NOMENKLATURA(słownictwo, nazewnictwo)ZWIĄZKÓW NIEORGANICZNYCH NAZWY PIERWIASTKÓW Nazwy polskie należy używać w ich polskim brzmieniu (nie należy niepotrzebnie dodawać końcówki stosowane w językach obcych, np. „-um”; „ium” 2. ZASADY ZAPISU WZORÓW ZWIĄZKÓW NIEORGANICZNYCH Wzór związku rozpoczyna się od symbolu pierwiastka elektrododatniego, a następnie podaje się symbol składnika elektroujemnego (składnik elektrododatni - ten, który jest kationem lub atomem o elektroujemności mniejszej niż elektroujemność drugiego składnika), np. NaCl - prawidłowo; ClNa -nieprawidłowo Jeżeli związek zawiera kilka składników elektrododatnich lub kilka składników elektroujemnych, to pierwiastki w każdej z tych klas podaje się w kolejności alfabetycznej ich symboli (nie nazw), np. KMgF3 - fluorek magnezu i potasu We wzorach kwasów na początku pisze się wodór We wzorach związków składających się z trzech lub więcej pierwiastków kolejność powinna odpowiadać sposobowi powiązania atomów; jeżeli atom centralny wiąże kilka różnych atomów, to atom centralny wymienia się na początku, a pozostałe atomy podaje się w kolejności alfabetycznej symboli, np. Cl - Sb - Cl SbCl2 F
|
PRZEDROSTKI ZWIELOKROTNIAJĄCE Preferuje się stosowanie przedrostków greckich lub łacińskich (polskie są dopuszczalne) Krotność Przedrostek
grecki lub łaciński polski
1 2 mono di jedno dwu
3 4 tri tetra trój cztero
5 6 penta heksa pięcio sześcio
7 8 itd hepta okta siedmio ośmio
Uwaga: tam, gdzie nie jest to niezbędne, nie podaje się przedrostka „mono”. np.NO - tlenek azotu N2O3 - tritlenek diazotu (trójtlenek dwuazotu) N2O5 - pentatlenek diazotu (pięciotlenek dwuazotu) 4. NAZWY ZWIĄZKÓW NIEORGANICZNYCH Wyraz określający nazwę składnika elektroujemnego podaje się na pierwszym miejscu, a wyraz określający nazwę składnika elektrododatniego podaje się na drugim miejscu: system dawny: rzeczownikowo - przymiotnikowy, np. NaCl - chlorek sodowy; system obecny: rzeczownikowo - rzeczownikowy, np. NaCl - chlorek sodu. 4.1. NAZWA CZĘŚCI ELEKTROUJEMNEJ ZWIĄZKU 1)Końcówka „-ek” Stosuje się, gdy część elektroujemna składa się z jednego pierwiastka, np. NaF - fluorek sodu; NaCl - chlorek sodu, NaBr - borek sodu, KI3 - trijodek potasu. Wyjątek: jeżeli część elektroujemną stanowią związki węgla, to jej nazwa przyjmuje końcówkę „-ik”, np. SiC - węglik krzemu. |
2) Końcówka „-an” Stosuje się, gdy część elektroujemna składa się z różnych atomów (w której atom centralny otoczony jest innymi atomami - ligandami), np. Na2SO4 - siarczan(VI) sodu 4.2. NAZWA CZĘŚCI ELEKTRODODATNIEJ ZWIĄZKU Rzeczownik określający część elektrododatnią podawany jest w II przypadku (w dopełniaczu), np. CsBr - bromek cezu. 5. NAZWY KWASÓW 5.1. KWASY TLENOWE Nazwy kwasów tlenowych tworzy się z nazwy pierwiastka występującego w tlenku, z którego powstał kwas (z nazwy pierwiastka kwasotwórczego). Jeżeli ten sam pierwiastek tworzy kilka kwasów, to w nazwie (bezpośrednio po nazwie, bez odstępu!) podaje się stopień utlenienia tego pierwiastka, np. HNO2 - kwas azotowy(III) (d. kwas azotawy) HNO3 - kwas azotowy(V) (d. kwas azotowy) H2SO3 - kwas siarkowy(IV) (d. kwas siarkawy) H2SO4 - kwas siarkowy(VI) (d. kwas siarkowy) HClO - kwas chlorowy(I) (d. kwas podchlorawy) HClO2 - kwas chlorowy(III) (d. kwas chlorawy) HClO3 - kwas chlorowy(V) (d. kwas chlorowy) HClO4 - kwas chlorowy(VII) (d. kwas nadchlorowy) Jeżeli tlenek kwasowy reaguje z różną liczbą cząsteczek wody, tworząc kwasy różniące się liczbą kwasowych atomów wodoru (ale we wszystkich kwasach stopień utlenienia pierwiastka kwasotwórczego jest taki sam), to: kwasy, które powstały z przyłączenia najmniejszej liczby cząsteczek wody (o najmniejszej liczbie kwasowych atomów wodoru) mają przedrostek „meta-„,
kwasy, które powstały z przyłączenia największej liczby cząsteczek wody mają przedrostek „orto-„, np. P2O5 + 3H2O ⇒ 2H3PO4 - kwas ortofosforowy(V); kwasy powstałe z dwóch cząsteczek kwasu „orto”, po wydzieleniu (np. przez ogrzanie; z greckiego pyr - ogień) cząsteczki wody (lub z przyłączenia do tlenku kwasowego pośredniej ilości wody) mają przedrostek "„piro-„; np. 2H3PO4 ⇒ H4P2O7 + H2O |
H4P2O7 - kwas pirofosforowy(V) to samo: P2O5 + 1H2O ⇒ 2HPO3 - kwas metafosforowy(V) P2O5 + 2H2O ⇒ H4P2O7 - kwas pirofosforowy(V) P2O5 + 3H2O ⇒ 2H3PO4 - kwas ortofosforowy(V) 5.2. KWASY BEZTLENOWE Kwasy beztlenowe otrzymuje się zazwyczaj przez rozpuszczenie w wodzie wodorków niektórych niemetali, np. kwas solny (chlorowodorowy) jest wodnym roztworem chlorowodoru HCl, kwas siarkowodorowy jest wodnym roztworem siarkowodoru H2S. Nazwy kwasów beztlenowych tworzy się dodając do nazwy pierwiastka, stanowiącego resztę kwasową, końcówkę „- wodorowy”, np. HCl - kwas chlorowodorowy (kwas solny), H2S - kwas siarkowodorowy, HI - kwas jodowodorowy. 6. NAZWY SOLI Ogólnie obowiązują zasady podane w pkt.4. 6.1. SOLE ZAWIERAJĄCE WODÓR KWASOWY (WODOROSOLE) Przed nazwą anionu dodaje się przedrostek „wodoro-„ (nie należy używać nazw „kwaśny”), np. KH2PO4 - diwodorofosforan(V) potasu, K2HPO4 - wodorofosforan(V) dipotasu. 6.2. SOLE ZAWIERAJĄCE GRUPY HYDROKSYLOWE - WODOROTLENOWE (HYDROKSYSOLE) Nazwę soli poprzedza się liczebnikiem wskazującym liczbę grup hydroksylowych i przedrostkiem „hydoksy-„ (liczebnik „mono” pomija się), np. AlOHCl2 - hydroksydichlorek glinu, Al(OH)2Cl - dihydroksychlorek glinu. 6.3. NAZWY SOLI PODWÓJNYCH I POTRÓJNYCH (SOLI ZAWIERAJĄCYCH KILKA RÓŻNYCH KATIONÓW LUB ANIONÓW) kolejność jonów we wzorze podaje się w kolejności alfabetycznej symboli chemicznych pierwiastków; nazwy jonów podaje się w kolejności alfabetycznej nazw; nazwy kationów oddziela się od siebie spójnikiem „i”; nazwy anionów podaje się bez łącznika, np. MgNH4PO4 - fosforan(V) amonu i magnezu; KNaCO3 - węglan potasu i sodu. |
TEORIA ATOMISTYCZNA (1804 r. John Dalton - hipoteza o atomistycznej budowie materii) POSTULATY WSPÓŁCZESNEJ TEORII ATOMISTYCZNEJ 1. Każdy pierwiastek chemiczny jest zbiorem małych cząstek zwanych atomami. Wszystkie atomy danego pierwiastka mają identyczne właściwości chemiczne (właściwości chemiczne = zdolność łączenia się lub nie w określonych warunkach z innymi pierwiastkami) 2. Atomy różnych pierwiastków różnią się od siebie cechami chemicznymi i fizycznymi. Istnieje tyle rodzajów atomów o określonych właściwościach chemicznych ile jest pierwiastków 3. Atom danego pierwiastka nie może ulec przekształceniu w atom innego pierwiastka podczas reakcji chemicznej 4. Łączenie się pierwiastków w związki chemiczne polega na łączeniu się atomów różnych pierwiastków w większe zespoły, zwane cząsteczkami np. z pierwiastka A i B może powstać: AB - jeden atom A i jeden atom B; AB2 - jeden atom A i dwa atomy B AB3 - jeden atom A i trzy atomy B; A2B3 - dwa atomy A i trzy atomy B itd. 5. Związek chemiczny jest zbiorem cząsteczek. Wszystkie cząsteczki danego związku chemicznego zawierają tę samą liczbę tych samych rodzajów atomów i mają identyczne właściwości chemiczne 6. Rozłożenie związku chemicznego na pierwiastki polega na rozpadzie cząsteczek na atomy. Proces ten może przebiegać w kilku etapach 7. Atomy tego samego pierwiastka mogą łączyć się w cząsteczki BUDOWA ATOMU Atom (gr. „atomos” - niepodzielny) - jest to najmniejsza część pierwiastka, która ma wszystkie jego cechy charakterystyczne. Atom składa się z dodatnio naładowanego jądro atomowego, znajdujące się w środku geometrycznym atomu i pozajądrowego układu ujemnie naładowanych elektronów Jądro atomowe - protony i neutrony, tzw. nukleony (łac. „nukleus” - jądro); prawie cała masa atomu skupiona jest w jądrze (gęstość masy jądra atomowego wynosi ok. ρ = 1014 g/cm3 = 100 mln ton/cm3) Proton - cząstka elementarna trwała, dodatni ładunek elementarny 1,6022·10-19C; masa w przybliżeniu równa jednostce mas atomowych (dokładnie 1,0073u) |
Neutron - cząstka elektrycznie obojętna, masa w przybliżeniu równa jednostce mas atomowych (dokładnie 1,0087u), neutrony swobodne są nietrwałe (czas połowicznego zaniku - rozpadu wynosi 15,5s) Elektron (negaton) - cząstka trwałą, ujemny ładunek elementarny 1e, masa równa 1/1836u (w czasie 10-6s okrąża jądro atomowe ok. 6 milionów razy) 1e = 1,6022·10-19C
Liczba atomowa (Z) - liczba protonów w jądrze atomowym danego pierwiastka Liczba masowa (A) - liczba nukleonów (protonów i neutronów) w jądrze atomowym danego pierwiastka
np. Pierwiastek chemiczny - zbiór atomów o identycznej liczbie atomowej Izotopy - odmiany tego samego pierwiastka złożone z atomów o identycznych liczbach atomowych, a różnych liczbach masowych (izotopy zajmują to samo miejsce w układzie okresowym; gr. „izos” - ten sam; „topos” - miejsce) Atom może składać się z jednego lub kilku izotopów (20 pierwiastków nie ma izotopów, np. Be; F; Na; Al; P; Sc; Mn; Co; Au) Nuklid - rodzaj atomów o określonym jądrze atomowym (o tej samej liczbie protonów i neutronów w jądrze); tzn. każdy izotop jest oddzielnym nuklidem Jednostka masy atomowej (dokładniej: międzynarodowa węglowa jednostka masy atomowej) (u - unit) - 1/12 masy atomu węgla (dokładniej: izotopu węgla 12C), np. masa atomowa wodoru (pierwiastka najlżejszego) - 1,0079u; masa atomowa kurczatowa (pierwiastka najcięższego) - 261u 1u = 1,66∗10-27kg
Masa atomowa - masa atomu (dokładniej: masa średniego składu izotopowego danego pierwiastka) wyrażona w jednostkach mas atomowych [u] Masa cząsteczkowa - masa cząsteczki wyrażona w jednostkach mas atomowych [u]; jest ona sumą mas atomowych atomów wchodzących w skład cząsteczki, np. masa atomowa tlenu O: 16u; masa atomu tlenu O: 16∗1,66∗10-27kg = 2,65∗10-26kg; masa cząsteczkowa tlenu O2: 2∗16u = 32u; masa cząsteczki tlenu O2: 32∗1,66∗10-27kg = 5,3∗10-26 kg |
Model planetarny (Ernest Rutherford, pocz. XX w.) - elektrony z dużą prędkością krążą wokół jądra po orbitach kołowych lub eliptycznych (podobnie jak Ziemia i inne planety wokół Słońca). Siła przyciągania elektrostatycznego elektronu przez jądro pełni funkcję siły dośrodkowej Prawa elektrodynamiki Maxwella - jeżeli wokół dodatnio naładowanego jądra krąży ujemnie naładowany elektron, to musi on bez przerwy emitować falę elektromagnetyczną (np. w postaci światła). Elektron traci wtedy energię i szybkość, a długość wysyłanej fali musi stale rosnąć. W konsekwencji elektron musi poruszać się po torze spiralnym, aby w końcu spaść na jądro Model planetarny Nielsa Bohra (1913 r) - przyjęto, że prawa Maxwella nie dotyczą ruchu elektronu oraz postulaty: 1. Elektron w atomie może przebywać w jednym z wielu możliwych stanów energetycznych (tzw. stanów stacjonarnych), w których jego energia ma ściśle określoną wartość. W stanie stacjonarnym elektron nie wypromieniowywuje, ani nie pochłania energii 2. Elektron może pobrać kwant energii docierającej do atomu z zewnątrz i przejść do stanu stacjonarnego o wyższej energii lub może oddać kwant energii w postaci fali elektromagnetycznej i przejść do stanu energetycznego o niższej energii Przeskok elektronu z jednej orbity na inną związany jest ze stratą lub zyskiem określonej porcji energii, której wartość można obliczyć z równania (b. ważne - wprowadzono kwantowanie energii; aktualne do dziś) E = h∗ν gdzie: h - 6,625∗10-34 Js - stała Plancka ν - częstotliwość absorbowanego lub emitowanego promieniowania Stan stacjonarny (orbita stacjonarna) - ściśle określone, „dozwolone” orbity w kształcie okręgów, po których może poruszać się elektron Stan podstawowy - stan elektronu, w którym energia ma wartość najmniejszą z możliwych (w zwykłych warunkach ciśnienia i temperatury elektron jest w stanie podstawowym) Stany wzbudzone - wszystkie inne stany, niż podstawowy |
MECHANIKA KWANTOWA (początki - lata 20 XX w) PODSTAWY: 1. Dualizm korpuskularno-falowy elektronu (1924 r. Ludwik de Broglie) - podobnie, jak dla światła pewne zjawiska daje się opisać za pomocą modelu falowego, a inne za pomocą modelu korpuskularnego (z tego wynika, że ruch elektronu nie może być opisywany równaniami ruchu ciał makroskopowych, np. równaniami Newtona F=ma) 2. Pojęcie „elektronu” i „toru elektronu” - pojęcia klasyczne zostają zastąpione „chmurą ładunku elektrycznego” i „prawdopodobieństwem znalezienia elektronu w danym obszarze przestrzeni wokółjądrowej” 3. Orbitale (atomowe, cząsteczkowe) - równania falowe (równania Schrödingera) charakteryzujące stan energetyczny pojedynczego elektronu znajdującego się w atomie lub cząsteczce (terminem „orbital” nazywany jest niekiedy także obszar dużego prawdopodobieństwa znalezienia elektronu) 4. Zasada nieoznaczoności Heisenberga (Werner Carl Heisenberg, 1901 - 1976; 1932 Nagroda Nobla) - dla układu opisywanego prawami mechaniki kwantowej niemożliwe jest równoczesne i dokładne określenie pewnych par wielkości fizycznych układu, np. prędkości i położenia elektronu (wg praw mechaniki klasycznej jest to możliwe); im dokładniej określi się prędkość elektronu, tym mniej dokładnie określi się jego położenie i odwrotnie2. LICZBY KWANTOWE Liczby kwantowe są to liczby wymierne kwantujące („porcjujące”) te wielkości, które mogą przyjmować dozwolone (ale nie dowolne) wartości; w mechanice kwantowej kwantowanych jest pięć wielkości, w teorii Bohra - tylko energia np. jeżeli dysponujemy wagą odważnikową i odważnikami jednokilogramowymi, to możemy odważać „dowolną” ilość piasku, ale „dozwolone” są tylko porcje, które są krotnością 1 kg Uwaga: wszystkie rozważania w mechanice kwantowej dotyczą elektronu w atomie wodoru, czyli jednego elektronu; przyjmując jednak, że wszystkie stany dopuszczalne dla tego jednego elektronu są dopuszczalne dla wszystkich innych elektronów, teorię rozszerza się następnie na elektrony innych atomów
|
Główna liczba kwantowa (n)
Główna liczba kwantowa kwantuje energię elektronu w atomie wodoru, określoną równaniem gdzie: n - główna liczba kwantowa; E1 = 2π2e4m/h2 - wartość bezwzględna energii elektronu w stanie podstawowym (E1 = 13,6eV); e - ładunek elementarny; m - masa elektronu; h - stała Plancka (h = 6,625∗10-34Js) Dopuszczalne wartości głównej liczby kwantowej (n):
n = 1, 2, 3, ...,
gdzie: n - liczba naturalna Powłoka elektronowa - zbiór stanów kwantowych o tej samej wartości głównej liczby kwantowej 2n2
Liczba stanów kwantowych o tej samej wartości głównej liczby kwantowej (maksymalna liczba elektronów na danej powłoce) Symbole powłok elektronowych i maksymalna liczba stanów kwantowych (elektronów): powłoka 1, czyli K (n = 1) - 2∗12 = 2 stany kwantowe; powłoka 2, czyli L (n = 2) - 2∗22 = 8 stanów kwantowych; powłoka 3, czyli M (n = 3) - 2∗32 = 18 stanów kwantowych; powłoka 4, 5, 6.., czyli N, O, P,..(kolejne litery alfabetu) = 2n2 stanów kwantowych Poboczna (orbitalna) liczba kwantowa (l) Poboczna (orbitalna) liczba kwantowa kwantuje orbitalny moment pędu elektronu (Mpędu = m∗u∗r, gdzie: m - masa; u - prędkość; r - promień). Uwaga: Energię elektronów w innych atomach niż wodór określają: główna i poboczna liczba kwantowa Dopuszczalne wartości pobocznej liczby kwantowej (l): l = 0, 1, 2, 3, ..., (n - 1)
czyli gdzie: n - główna liczba kwantowa l = 0 ÷(n - 1)
|
np. w powłoce: K (n = 1) l = 0; L (n = 2) l = 0 lub l = 1 M (n = 3) l = 0 lub l = 1 lub l = 2 Podpowłoka elektronowa - zbiór stanów kwantowych opisanych tą samą wartością głównej liczby kwantowej (n) i tą samą wartością pobocznej liczby kwantowej (l) (ale zawsze n ≠ l) Symbole podpowłok elektronowych: podpowłoka 1, czyli s (l = 0); podpowłoka 2, czyli p (l = 1); podpowłoka 3, czyli d (l = 2); podpowłoka 4, czyli f (l = 3); podpowłoka 5, 6, 7, itd., czyli g (l = 4), h (l = 5), i (l = 6), itd. (kolejne litery alfabetu) Liczba podpowłok w danej powłoce: n np. w powłoce K (n = 1) jest jedna podpowłoka (s); w powłoce L (n = 2) są dwie podpowłoki (s, p) 3. Magnetyczna liczba kwantowa (m) Magnetyczna liczba kwantowa kwantuje orientację przestrzenną orbitalnego momentu pędu elektronu. Moment pędu jest wektorem. Wektor można rzutować na wybrany kierunek w przestrzeni: wektory Kwantowanie orientacji przestrzennej wektora momentu pędu polega na znalezieniu jego rzutu na kierunek zewnętrznego pola magnetycznego (przyłożonego z zewnątrz pola). Dopuszczalne wartości magnetycznej liczby kwantowej (m): m = -l; -(l - 1); -(l - 2);... ; -1; 0; +1; +2;... (l - 1); l
czyli m= -l ÷+l
gdzie: l - poboczna liczba kwantowa Liczba dopuszczalnych wartości magnetycznej liczby kwantowej (m): 2l + 1
|
Uwaga: ponieważ m = f(l) i l = f(n), to m = f(n) np. 1) l = 0 (podpowłoka s), to m = 0; 2) l = 1 (podpowłoka p), to m = -1; 0; +1 (2l + 1 =3 wartości) l = 2 (podpowłoka d), to m = -2; -1; 0; +1; +2 (2l + 1 = 5 wartości) Poziom orbitalny - zbiór stanów kwantowych opisanych tą samą wartością głównej liczby kwantowej (n), tą samą wartością pobocznej liczby kwantowej (l) i tą samą wartością magnetycznej liczby kwantowej (m) 4. Spinowa liczba kwantowa (s) Spinowa liczba kwantowa (s) kwantuje wewnętrzny moment pędu elektronu. Elektron, oprócz ruchu wokół jądra atomowego, wykonuje jednocześnie pewien ruch wewnętrzny, który nie ma makroskopowego odpowiednika w mechanice klasycznej. Odpowiadający ruchowi wewnętrznemu moment pędu nazwano spinem (ang. spin = wirować). Konsekwencją ruchu wewnętrznego elektronu są jego właściwości magnetyczne; elektron jest dipolem magnetycznym i zachowuje się jak magnes.
Dopuszczalne wartości spinowej liczby kwantowej (s): Wszystkie elektrony mają tę samą wartoścć s = ½ spinowej liczby kwantowej i w opisie stanów kwantowych można tę liczbę pominąć. 5. Magnetyczna spinowa liczba kwantowa (ms) Magnetyczna spinowa liczba kwantowa (ms) określa orientacje przestrzenną wektora spinu.
Dopuszczalne wartości magnetycznej spinowej liczby kwantowej (ms):
Każdy poziom orbitalny, to dwa stany kwantowe (opisane tymi samymi liczbami n, l, m) różniące się tylko magnetyczną spinową liczbą kwantową |
ms: podpowłoka poziom orbitalny ms = +1/2 ⇑ ⇑ ⇑ powłoka ⇒ podpowłoka ⇒ poziom orbitalny ⇓ ⇓ ⇓ podpowłoka poziom orbitalny ms = - ½ Prawdopodobieństwo [%] 10 30 50 70 90 95 99
Promień obszaru obszaru orbitalnego [pm = 10-12m]
29
51
71
96
140
166
222
3. OBSZAR ORBITALNY Obszar orbitalny - obszar przestrzeni wokółjądrowej, na zewnątrz której gęstość ładunku (gęstość chmury elektronowej jest pomijalnie mała (mniejsza od założonej wartości granicznej) i wewnątrz której gęstość ta jest odpowiednio duża. Zwykle przyjmuje taką się granicę obszaru orbitalnego, że prawdopodobieństwo znalezienia elektronu w tym obszarze wynosi 90 ÷ 95%. W zależności od przyjętej wartości prawdopodobieństwa różne są wymiary obszaru orbitalnego, ale nie zmienia się jego kształt (jego symetria), np. Kształt obszaru orbitalnego - zależy od pobocznej liczby kwantowej. Dlatego wszystkie stany kwantowe (wszystkie elektrony) danej podpowłoki mają taki sam kształt obszarów orbitalnych np.obszar orbitalny podpowłoki s jest kulą (tzw. symetria kulista, przestrzenna); obszar orbitalny podpowłoki p, to trzy równoważne obszary orbitalne (o kształcie zbliżonym do cyfry 8), których osie pokrywają się z osiami przestrzennego układu współrzędnych prostokątnych (tzw. symetria osiowa). Na parametry obszaru orbitalnego mają wpływ: główna liczba kwantowa n (decyduje o rozmiarze obszaru orbitalnego); poboczna liczba kwantowa l (decyduje o kształcie obszaru orbitalnego); magnetyczna liczba kwantowa m (decyduje o orientacji przestrzennej obszaru orbitalnego). |
4. ATOMY WIELOELEKTRONOWE Kwantomechaniczny opis rozmieszczenia elektronów w atomie: Określenie liczby elektronów w każdej powłoce. Rozmieszczenie elektronów w każdej podpowłoce. Rozmieszczenie elektronów w poziomach orbitalnych. Ad. 1. Do określenia liczby elektronów w powłokach stosuje się umowny zapis składający się z literowego symbolu powłok zajętych częściowo lub całkowicie przez elektrony górnego indeksu prawego górnego informującego o liczbie elektronów; np. dla atomu chloru 17Cl: K2L8M7 Ad.2. Do zapisu liczby elektronów w podpowłokach (do zapisu tzw. konfiguracji elektronowej) wykorzystuje się główną liczbę kwantową (wartość głównej liczby kwantowej = numer powłoki) i poboczną liczbę kwantową (symbol literowy podpowłoki); np. dla atomu chloru 17Cl: liczba elektronów w podpowłoce 1s22s22p63s23p5 gł. liczba symbol kwantowa podpowłoki
Ad.3. Rozmieszczenie elektronów w podpowłokach przedstawia się w postaci prostokątów („klatek”), w których elektrony symbolizuje się strzałkami kierowanymi w górę lub w dół (strzałki przeciwnie skierowane charakteryzują elektrony różniące się wartością magnetycznej spinowej liczby kwantowej, tzn. +1/2 lub -1/2); Elektrony sparowane (o kompensowanych spinach) - dwa elektrony obsadzające ten sam poziom orbitalny, różniące się tylko wartością liczby ms Reguła Hunda: W danej podpowłoce powinna być możliwie duża liczba elektronów niesparowanych. Niesparowane elektrony, zajmujące poziomy orbitalne danej podpowłoki, mają identyczną orientacje spinu. Pary elektronowe tworzą się dopiero po zajęciu wszystkich poziomów orbitalnych danej podpowłoki przez elektrony niesparowane. |
5. KONFIGURACJA ELEKTRONOWA A PRAWO OKRESOWOŚCI Podstawą okresowej klasyfikacji pierwiastków jest regularne powtarzanie się kreślonych typów konfiguracji elektronowej w miarę wzrostu liczby atomowej Z. Układ okresowy pierwiastków - uporządkowanie pierwiastków wg wzrastających liczb atomowych w leżące kolejno pod sobą poziome szeregi zwane okresami (ponumerowane kolejnymi liczbami arabskimi); po takim uporządkowaniu pierwiastki o podobnych właściwościach tworzą równocześnie kolumny pionowe zwane grupami.W „układzie Mendelejewa” występują grupy IA; IIA; itd. (A - grupy główne) i IB; IIB itd. (B - grupy poboczne), a w „układzie Wernera” grupy numeruje się liczbami arabskimi od 1 do 18. Grupy główne z „układu Mendelejewa” otrzymały w „układzie Wernera” numery: 1; 2; 13; 14; 15; 16; 17 i 18, przy czym cyfra na miejscu jednostek w „układzie Wernera” oznacza numer grupy głównej w „układzie Mendelejewa”. Grupy poboczne otrzymały w „układzie Wernera” numerację od 3 do 12. Pierwiastki danego okresu - mają tę samą liczbę powłok elektronowych Atom - umownie można wydzielić rdzeń atomowy (jądro tomowe i część elektronów) i elektrony walencyjne Elektrony walencyjne - elektrony o największej energii, biorące udział w procesach chemicznych i decydujące o właściwościach pierwiastka 1. Bloki energetyczne Bloki energetyczne - dodatkowy podział układu okresowego pierwiastków związany z lokalizacją tzw. elektronów walencyjnych 1) Pierwiastki bloku energetycznego s do bloku energetycznego s należą: pierwiastki grup 1 i 2 (IA i IIA)
nazwa konfiguracji elektronowej: ns
elektrony walencyjne znajdują się: podpowłoka s powłoki n (1 lub 2 elektrony)
nowo przybywające elektrony: w atomach pierwiastków bloku s nowo przybywające elektrony zajmują podpowłokę s, należącą do powłoki o numerze równym głównej liczbie kwantowej n (równej numerowi okresu, w którym znajduje się dany pierwiastek)
|
2) Pierwiastki bloku energrtycznego p do bloku energetycznego p należą: pierwiastki grup 13 do 18 (IIIA do VIIIA)
nazwa konfiguracji elektronowej: ns, np
elektrony walencyjne znajdują się: powłoka ostatnia czyli n
są to 3 ÷ 8 elektronów, z czego 2 podpowłoce s, reszta w podpowłoce p
nowo przybywające elektrony: w atomach pierwiastków bloku p nowo przybywające elektrony zajmują podpowłokę p, należącą do powłoki o numerze równym głównej liczbie kwantowej n (równej numerowi okresu, w którym znajduje się dany pierwiastek)
3) Pierwiastki bloku energetycznego d do bloku energetycznego d należą: pierwiastki grup 3 do 12 (grupy B)
nazwa konfiguracji elektronowej: (n - 1)d, ns
elektrony walencyjne znajdują się: podpowłoka s powłoki n i podpowłoka d powłoki (n - 1)
nowo przybywające elektrony: w atomach pierwiastków bloku d nowo przybywające elektrony zajmują podpowłokę d, należącą do powłoki o numerze o jeden mniejszym od numeru okresu, w którym znajduje się dany pierwiastek)
4) Pierwiastki bloku energetycznego f do bloku energetycznego f należą: lantanowce i aktynowce
nazwa konfiguracji elektronowej: (n - 2)f, (n - 1)d, ns
|
elektrony walencyjne znajdują się: podpowłoka s powłoki n i podpowłoka d powłoki (n - 1) i podpowłoka f powłoki (n - 2)
nowo przybywające elektrony: w atomach pierwiastków bloku f nowo przybywające elektrony zajmują podpowłokę f, należącą do powłoki o numerze o dwa mniejszym od numeru, w którym znajduje się dany pierwiastek)
Uwaga: „lantanowce” (nr 58 ÷ 71) rozpatruje się przed lantanem (nr 57); a „aktynowce” (nr 90 ÷103) przed aktynem (nr 89) ELEKTRONY W CZĄSTECZKACH Łączenie się atomów w cząsteczki (tworzenie wiązań chemicznych) - konsekwencja dążenia układów do obniżenia swej energii Podczas zbliżania się atomów następuje (rys. 1, 2): uwspólnianie elektronów (powoduje obniżenie energii układu) odpychanie elektrostatyczne jąder atomowych (powoduje wzrost energii układu); Uwagi: powstawaniu wiązania chemicznego towarzyszy: - zmiana rozkładu gęstości ładunku elektronowego (rys. 1) - obniżanie energii układu (rys. 2); minimum energii nie posiadają dwa atomy, które nie tworzą cząsteczki (np. dwa atomy He) Energia wiązania - różnica sumy energii atomów izolowanych (w dużym oddaleniu od siebie) oraz energii cząsteczki (w równowagowej odległości jąder) Uwaga: energia oddziaływania na siebie atomów izolowanych jest równa zero Energia wiązania: dla procesu egzotermicznego (egzoenergetycznego): znak „—” dla procesu endotermicznego (endoenergetycznego): znak „+” |
Uwaga: tworzenie każdego wiązania jest procesem egzotermicznym (ΔE < 0)
np. H + H Stan elektronów w cząsteczce opisują (podobnie jak dla atomów) funkcje falowe zwane orbitalami z tym, że: elektrony rdzeniowe (pochodzące z rdzeni atomowych) opisuje się tak, jak elektrony atomowe, tzn. orbitalami atomowymi; elektrony walencyjne (utworzone z elektronów walencyjnych atomów) opisuje się orbitalami cząsteczkowymi (molekularnymi) Drobina (cząstka chemiczna, indywiduum molekularne) - strukturalny składnik materii utworzony z jąder i elektronów (np. atom, cząsteczka, jon) Drobiny: jednojądrowe (atomy oraz jony proste, np. Fe, Na+, S2-);
wielojądrowe (cząsteczki oraz jony złożone, PRZEWIDYWANIE BUDOWY PRZESTRZENNEJ DROBIN Współczesna wiedza pozwala na przewidywanie budowy drobin wielojądrowych, składających się z pierwiastków grup głównych (jedną z najprostszych - metoda VSEPR) METODA VSEPR (Vallance Shell Electron Pair Repulsion - odpychanie par elektronowych powłoki walencyjnej) Założenia modelu uproszczonego: Drobina zbudowana jest z rdzeni atomowych i elektronów walencyjnych. Do elektronów walencyjnych zalicza się elektrony walencyjne wszystkich atomów (łącznie z nadmiarowymi anionów i ich brakiem w kationach) Rozpatrujemy drobinę wielojądrową spełniającą warunki: można z niej wyodrębnić atom centralny; atom centralny jest połączony z atomami, a nie z grupami atomów (np. OH) - istota uproszczonej wersji metody VSEPR (atomy lub grupy połączone z atomem centralnym = ligandy); O geometrii drobin (o wzajemnym położeniu jąder atomowych wchodzących w skład drobin) decyduje tzw. liczba przestrzenna Lp:
Lp = Lwpe + Lσ
|
gdzie: Lwpe - liczba wolnych par elektronowych atomu centralnego; Lσ - liczba wiązań σ łączących atom centralny z ligandami PODSTAWOWE ZASADY METODY VSEPR O geometrii drobin decyduje liczba przestrzenna Lp Parom elektronowym, decydującym o geometrii drobiny, odpowiadają określone obszary orbitalne, a ich orientacja przestrzenna jest maksymalnie symetryczna Poszczególne pary elektronowe odpychają się jednak z różną siłą: najsilniej odpychają się wolne pary elektronowe; słabiej odpychają się wolna para elektronowa i para (wiązanie) σ; najsłabiej odpychają się dwie pary σ Atomy - ligandy mają oktet elektronowy (wyjątek stanowi wodór, który ma dublet elektronowy) PODSUMOWANIE ATOM CENTRALNY - LIGANDY a) drobiny zawierające atom centralny
i ligandy
w postaci atomów: H - N - H H - C - H
I H
II O
b) drobiny zawierające atom centralny
i ligandy
w postaci grup: H - O - S - O - H H2N - C -NH2
II O
II O
c) drobiny, w których nie można wyodrębnić atomu centralnego H3C - CH3 H2C = CH2 HC≡CH
|
ELEKTRONY WALENCYJNE DROBIN
Elektrony walencyjne drobin
pary wiążące
pary niewiążące
pary σ
pary π
wolne pary ligandów
wolne pary atomu centralnego
ORIENTACJA PRZESTRZENNA OBSZARÓW ORBITALNYCH (Z ZAŁOŻENIEM PEŁNEJ SYMETRII ORIENTACJI) liczba przestrzenna Lp = 2 (symetria liniowa - diagonalna) (linia) liczba przestrzenna Lp = 3 (symetria trójkątna - trygonalna) (trójkąt równoboczny) liczba przestrzenna Lp = 4 (symetria czworościenna - tetraedryczna) (czworościan foremny) PRZYKŁADY OKREŚLANIA BUDOWY PRZESTRZENNEJ DROBIN BeF2 Określenie konfiguracji elektronowej pierwiastków tworzących związek (podkreślamy elektrony walencyjne ostatniej powłoki) 4Be: 1s22s2 ; 9F: 1s22s22p5 Ustalenie atomu centralnego F - Be -F
Narysowanie elektronów walencyjnych (w różny sposób zaznaczyć elektrony walencyjne atomu centralnego i ligandów)
|
Obliczenie liczby przestrzennej Lp Lp = Lwpe + Lσ = 0 + 2 = 2 Narysowanie struktury (budowy) przestrzennej F - Be - F UKŁAD OKRESOWY PIERWIASTKÓW PRAWO OKRESOWOŚCI 1869 r. Dymitr Mendelejew - właściwości chemiczne i fizyczne pierwiastków są funkcją okresową masy atomowej (wyjątek: argon - potas, kobalt - nikiel, tellur - jod); 1913 r. Henry Moseley - właściwości chemiczne i fizyczne pierwiastków są funkcją okresową liczby atomowej FORMA KRÓTKA - UKŁAD DYMITRA MENDELEJEWA Grupy: pionowe grupy dzielące się na główne A i poboczne B (tzw. podgrupy), oznaczone są liczbami rzymskimi; grup głównych jest 8, grup pobocznych jest 8; nazwa każdej grupy głównej (A) i każdej grupy pobocznej (B) (wspólna nazwa pierwiastków tych grup) wywodzi się od nazwy pierwszego pierwiastka w grupie; stosuje się nazwy części grup - od pierwszego pierwiastka danej części, np. chlorowce (tzn. chlor, brom, jod, astat)
|
FORMA DŁUGA - UKŁAD ALFREDA WERNERA
Pierwiastki grup pobocznych stanowią „przejście” między pierwiastkami grup głównych grupy główne:
IA, IIA
IIIA,....,VIIIA
|
grupy poboczne:
IB, IIB
IIIB, ,VIIB
VIIIB PRAWIDŁOWOŚCI W UKŁADZIE OKRESOWYM Wartościowość: maksymalna wartościowość pierwiastków grup głównych jest równa numerowi grupy (wyjątkiem jest tlen, fluor i helowce); wartościowość w związkach z wodorem i metalami pierwiastków grup głównych IA÷IVA jest równa numerowi grupy; wartościowość w związkach z wodorem i metalami pierwiastków grup głównych VA÷VIIA jest równa VIII minus numer grupy Numer grupy głównej I II III IV V VI VII
Wartościowość maksymalna I II III IV V VI VII
Wartościowość w związkach z wodorem i metalami
I
II
III
IV
III
II
I
maksymalna wartościowość pierwiastków grup pobocznych jest zwykle zgodna z numerem grupy (wyjątek gr. IB - maksymalna wartościowość bywa tam wyższa, np. CuO, Au2O3) Aktywność chemiczna: dla pierwiastków metalicznych rośnie ze wzrostem liczby atomowej; dla pierwiastków niemetalicznych maleje ze wzrostem liczby atomowej; w każdym okresie aktywność zmienia się od bardzo dużej (np. lit), poprzez małą, do bardzo dużej (np. fluor); każdy okres kończy się helowcem (pierwiastkiem nieaktywnym); na początku każdego okresu są metale, na końcu niemetale - widać to na przykładzie właściwości tlenków pierwiastków III okresu (p. tabela)
|
SYSTEMATYKA ZWIĄZKÓW NIEORGANICZNYCH Podział związków nieorganicznych: Tlenki; Wodorki; Wodorotlenki; Kwasy; Sole; Związki niemetali innych niż tlen (np. PCl, CS, SF) TLENKI EnOm
Są to związki pierwiastków z tlenem; ogólny wzór
gdzie: E - dowolny pierwiastek; n, m - współczynniki. Otrzymywanie: Bezpośrednia reakcja pierwiastka z tlenem, np.
S + O2 Utlenianie tlenków, np.
2SO2 + O2 Redukcja tlenków, np.
CO2 + C
|
Rozkład termiczny soli lub wodorotlenków, np.
CaCO3
Cu(OH)2 Spalanie związków organicznych, np.
CH4 +2O2
Właściwości fizyczne: Tlenki metali są zwykle ciałami stałymi o dużej gęstości i wysokiej temperaturze topnienia (500 ÷ 3000oC). Tlenki litowców i berylowców rozpuszczają się w wodzie, tlenki pozostałych metali nie rozpuszczają się w wodzie. Tlenki niemetali są zwykle gazami (CO, CO2, SO2, SO3, NO, NO2), rzadko są to ciała stałe (SiO2, P2O5) Właściwości chemiczne: Tlenki dzieli się ze względu na zachowanie względem kwasów, zasad i wody: 1. Tlenki zasadowe, czyli reagujące z kwasami
Są to tlenki metali, a produktem reakcji są sole, np.
Na2O + 2HCl (są także niezasadowe tlenki metali, np. CrO3, Mn2O7) Tlenki metali grup IA i IIA, zwane też bezwodnikami zasadowymi, reagują z wodą dając wodorotlenki o charakterze zasadowym, np.
Na2O + H2O Zasadowe tlenki pozostałych metali na ogół nie reagują z wodą (np. CrO, MnO). Tlenki zasadowe nie reagują z zasadami
|
Tlenki kwasowe, czyli reagujące z zasadami
Są to zwykle tlenki niemetali, a także tlenki metali na wyższym stopniu utlenienia (np. CrO3, Mn2O7). Tlenki kwasowe w reakcjach z zasadami i tlenkami zasadowymi tworzą sole, np.
2NaOH + SO3
CaO + CO2 Tlenki kwasowe, zwane są bezwodnikami kwasowymi, gdyż w reakcjach z wodą tworzą kwasy tlenowe, np.
SO3 + H2O Niektóre tlenki kwasowe nie reagują z wodą, np. SiO2.
Tlenki kwasowe nie reagują z kwasami
Tlenki amfoteryczne, czyli
tlenki reagujące zarówno z kwasami jak i z zasadami
Produktem reakcji z kwasami i zasadami jest sól, np.
ZnO + H2SO4 (cynk stał się kationem w soli)
ZnO + 2NaOH
(cynk stał się częścią anionu cynkanowego Tlenki amfoteryczne na ogół nie rozpuszczają się w wodzie. 4. Tlenki obojętne, czyli nie reagujące z kwasami i zasadami
|
Do tej grupy należą m.in. CO, NO. Tlenki te nie reagują z wodą, a mogą rozpuszczać się w wodzie jedynie fizycznie. Nie są to bezwodniki kwasów lub zasad. Podział tlenków (tlenki metali i niemetali)
TLENKI
TLENKI METALI np. Na2O, CaO, MnO, CrO3, Al2O3
TLENKI NIEMETALI np. SO3, CO2, SiO2, As2O3, NO
ZASADOWE np. Na2O, CaO, MnO
KWASOWE np. SO3, CO2, CrO3, SiO2
OBOJĘTNE np. NO
AMFOTERYCZNE np. Al2O3, As2O3
|
WODORKI Są to związki pierwiastków z wodorem, o wzorze ogólnym HnE lub EHn
gdzie: E - dowolny pierwiastek; n - współczynnik. Otrzymywanie: Większość wodorków otrzymuje się w bezpośredniej reakcji pierwiastków z wodorem, np.
H2 + Cl2
3H2 + N2 +
Ca + H2
Właściwości fizyczne: Wodorki metali są ciałami stałymi, wodorki niemetali są przeważnie gazami. Właściwości chemiczne: Wodorki metali: gwałtownie reagują z wodą tworząc zasady, wydzielając przy tym wodór, np.
CaH2 + 2H2O Wodorki niemetali: Wodorki tlenowców i fluorowców: rozpuszczają się w wodzie, a ich wodne roztwory nazywają się kwasami beztlenowymi, np. - wodny roztwór fluorowodoru HF - kwas fluorowodorowy; wodny roztwór chlorowodoru HCl - kwas chlorowodorowy (kwas solny) Amoniak: jedyny wodorek, który reagując z wodą tworzy związek zasadowy
NH3 + H2O Pozostałe wodorki niemetali nie reagują z wodą.
|
WODOROTLENKI Są to związki o wzorze ogólnym M(OH)m
gdzie: M - metal, -O-H - grupa wodorotlenowa (hydroksylowa) Otrzymywanie: Wodorotlenki litowców i berylowców otrzymuje się dwiema metodami: w reakcji tlenku z woda, np.
Li2O + H2O w reakcji metalu z wodą, np.
2Na + 2H2O Inne metale i ich tlenki w większości przypadków nie reagują z wodą. Wodorotlenki otrzymuje się wtedy z połączenia rozpuszczalnej w wodzie soli danego metalu i silnie zasadowego wodorotlenku, np.
CuSO4 +2NaOH Właściwości fizyczne: Wodorotlenki są na ogół ciałami stałymi. Wodorotlenki litowców i berylowców rozpuszczają się w wodzie [wyjątek Be(OH)2 i Mg(OH)2]. Wodorotlenki o silnych właściwościach zasadowych (przede wszystkim NaOH i KOH) nazywane są alkaliami, a ich wodne roztwory - ługami. Ługi powodują bolesne, trudno gojące się oparzenia skóry. Właściwości chemiczne: Wszystkie wodorotlenki reagują z kwasami, a niektóre także z zasadami. Wodorotlenki zasadowe, czyli reagujące z kwasami, a nie reagujące z zasadami
Są to wodorotlenki metali grup IA i IIA [wyjątek Be(OH)2 - amfoteryczny] i kilku innych metali. |
Wodorotlenki amfoteryczne, czyli reagujące z kwasami i zasadami
Są to np.
Zn(OH)2 + H2SO4 (cynk stał się kationem w soli)
Zn(OH)2 + 2NaOH
(cynk stał się częścią anionu cynkanowego Większość wodorotlenków amfoterycznych jest nierozpuszczalnych w wodzie KWASY Są to związki o wzorze ogólnym HnR
gdzie R - reszta kwasowa prosta (np. Otrzymywanie: Kwasy „tlenowe” można uzyskać rozpuszczając w wodzie odpowiedni bezwodnik kwasowy (tlenek kwasowy), np.
SO3 + H2O
P2O5 + 3H2O Jeżeli bezwodnik kwasowy nie reaguje z wodą (np. SiO2), to kwas można otrzymać działają na rozpuszczalną sól kwasu innym kwasem, np.
Na2SiO3 + HCl
|
Kwasy beztlenowe otrzymuje się rozpuszczając w wodzie odpowiednie wodorki Właściwości fizyczne: są to głównie ciecze żrące, powodujące groźne oparzenia Właściwości chemiczne: 1. Podstawową cechą jest zdolność do reagowania z zasadami z utworzeniem soli, np.
NaOH + HCl 2. Większość kwasów reaguje niemal z wszystkimi metalami
kwas + metal
Zn + 2HCl Kwasy reagują z większością tlenków metali z wytworzeniem soli, np.
CuO + H2SO4 Są to związki o wzorze ogólnym MnRm lub Mn(HkR)m lub [M(OH)kRm
gdzie: M - metal, R - reszta kwasowa Otrzymywanie: Reakcja kwasów z zasadami
zasada + kwas
NaOH + HCl Reakcja tlenku zasadowego z kwasem
tlenek zasadowy + kwas
FeO + H2SO4 Reakcja zasady z tlenkiem kwasowym
zasada + tlenek kwasowy
2NaOH + CO2
|
Reakcja tlenku zasadowego z tlenkiem kwasowym
tlenek zasadowy + tlenek kwasowy
CaO + CO2 Reakcja kwasu z niektórymi metalami
metal + kwas
Zn + H2SO4 Reakcja niektórych metali z niektórymi niemetalami
metal + niemetal
Hg + S Reakcja soli z kwasami
sól + kwas
CaCO3 + H2SO4 (H2O + CO2) PODZIAŁ SOLI
SOLE
SOLE OBOJĘTNE
WODOROSOLE
HYDROKSYSOLE
Sole obojętne, wzór ogólny MnRm
np. Al2(SO4)3
|
Wodorosole (d. „sole kwaśne”), wzór ogólny
Mn(HkR)m
np. NaHSO4 ; Na2HPO4 ; Wodorosole są to sole wywodzące się z kwasów wielowodorowych, w których nie wszystkie kwasowe atomy wodoru zostały zastąpione metalem. Kwasy jednowodorowe nie tworzą wodorosoli
Hydroksysole (d. „sole wodorotlenkowe”, „sole zasadowe”), wzór ogólny M(OH)kRm
np. Ca(OH)Cl ; Al(OH)Cl2 ; Al(OH)2Cl Hydroksysolami nazywamy sole wywodzące się z zasad dwu lub więcej wodorotlenowych, w których nie wszystkie grupy wodorotlenowe (hydroksylowe) zostały zastąpione resztami kwasowymi. Zasady jednowodorotlenowe nie tworzą hydroksysoli
ELEKTROUJEMNOŚĆ PIERWIASTKÓW Reakcje chemiczne (tworzenie wiązań chemicznych) polegają na oddawaniu, przyjmowaniu lub uwspólnianiu elektronów przez atomy reagujących z sobą pierwiastków Reguła oktetu: w procesie tworzenia wiązań chemicznych atom oddaje, pobiera lub uwspólnia taką liczbę elektronów, aby w zewnętrznej powłoce uzyskać 8 elektronów walencyjnych (wyjątek - wodór dąży do 2 elektronów) (Teoria Lewisa i Kossela - gdy pierwiastki łączą się w związki chemiczne, ich atomy dążą do uzyskania konfiguracji walencyjnej najbliższego w układzie okresowym helowca) Reguła dubletu: liczba wiązań kowalencyjnych, które może utworzyć atom jest równa liczbie niesparowanych elektronów walencyjnych (wiązanie powstaje wtedy, gdy dwa elektrony pochodzące od dwóch różnych atomów utworzą dublet czyli parę o przeciwnie skierowanych spinach) |
Elektroujemność jest to zdolność atomów do wiązania własnych i obcych elektronów Pierwiastki, których atomy słabo wiążą elektrony walencyjne i w reakcjach chemicznych łatwo je oddają przekształcając się w jony dodatnie, mają małą elektroujemność (dużą elektrododatność) i charakter metaliczny Pierwiastki, których atomy mocno wiążą własne elektrony walencyjne i w reakcjach chemicznych wykazują tendencję do przyłączania obcych elektronów tworząc jony ujemne, mają dużą elektroujemność i charakter niemetaliczny Skala elektroujemności Linusa Paulinga - elektroujemności Paulinga są liczbami zawartymi w przedziale od 0,7 (cez, Cs) do 4,0 (fluor, F) WIĄZANIA CHEMICZNE Tworzenie wiązań chemicznych jest skutkiem dążenia układów do minimalizacji energii. Podstawowe rodzaje wiązań chemicznych: jonowe; kowalencyjne (atomowe, homeopolarne); kowalencyjne polarne (spolaryzowane); metaliczne; koordynacyjne; wodorowe WIĄZANIA JONOWE Powstają między atomami pierwiastków skrajnie różniących się elektroujemnością. Polega ono na przejściu jednego lub kilku elektronów walencyjnych z atomu pierwiastka elektrododatniego do atomów pierwiastka elektroujemnego. W praktyce przyjmuje się, że wiązanie ma charakter jonowy, gdy różnica elektroujemności atomów w skali Paulinga wynosi nie mniej niż 1,7. Do związków jonowych należą: halogenki oraz tlenki litowców i berylowców (bez berylu), sole, wodorotlenki i tlenki metali. Właściwości związków jonowych: w związkach o wiązaniach jonowych siły między atomami danej cząsteczki i atomami cząsteczek sąsiednich są znaczne (są to siły elektrostatyczne) i dlatego w zwykłych warunkach związki te są krystalicznymi ciałami stałymi, twardymi, o względnie wysokich temperaturach topnienia i wrzenia;
|
w zdecydowanej większości związki jonowe dobrze rozpuszczają się w rozpuszczalnikach polarnych (np. w wodzie); stałe związki jonowe nie przewodzą prądu elektrycznego, w stanie ciekłym (stopione lub w roztworach wodnych) przewodzą prąd, gdyż jony uwolnione z sieci krystalicznej uzyskują zdolność poruszania się; reakcje z udziałem związków jonowych przebiegają z bardzo dużą szybkością. WIĄZANIA KOWALENCYJNE (NIESPOLARYZOWANE) Powstają między atomami o takich samych elektroujemnościach. Powstanie wiązania kowalencyjnego (atomowego, homeopolarnego) polega na utworzeniu wspólnej pary elektronów (wiązania pojedynczego), ewentualnie dwóch lub trzech par elektronów (wiązania podwójnego lub potrójnego) przez dwa atomy, z których każdy dostarcza do wspólnego wiązania taką samą liczbę niesparowanych elektronów. Wiązania kowalencyjne występują w cząsteczkach pierwiastków niemetalicznych, np. H2, F2, Cl2, Br2, I2, O2, S8, N2, P4 oraz w diamencie i związkach organicznych. Specyfika: Siły van der Waalsa (siły międzycząsteczkowe) - siły działające między cząsteczkami lub atomami o wysyconych wartościowościach, znajdującymi się blisko siebie; siły te są o wiele słabsze niż siły wewnątrzcząsteczkowe, czyli siły wiązań chemicznych; Wiązanie van der Waalsa - wiązanie znacznie słabsze od wiązania chemicznego, spowodowane siłami van der Waalsa, występuje m.in. między atomami gazów szlachetnych i między cząsteczkami w kryształach molekularnych (miedzy cząsteczkami, w których występują wiązania koordynacyjne). W związkach o wiązaniach jonowych sieć krystaliczną tworzyły poszczególne atomy, a w związkach o wiązaniach kowalencyjnych siły międzycząsteczkowe są dużo słabsze i sieć krystaliczną tworzą cząsteczki.
|
Właściwości substancji o wiązaniach kowalencyjnych: związki o wiązaniach kowalencyjnych w stanie stałym tworzą sieć krystaliczną zbudowaną z oddzielnych cząsteczek; między cząsteczkami występują słabe oddziaływania - siły van der Waalsa; z wymienionych wyżej powodów związki z wiązaniami kowalencyjnymi mają niską temperaturę topnienia i wrzenia; rozpuszczają się w rozpuszczalnikach niepolarnych lub słabo polarnych (np. w heksanie, benzenie, etanolu, acetonie, octanie etylu); istnieje niewielka grupa substancji (np. diament, krzem, german, węglik krzemu SiC, krzemionka SiO2), w których nie występują oddzielne cząsteczki, gdyż wiązania kowalencyjne rozciągają się na całą sieć; substancje te są twarde, mają bardzo wysoką temperaturę topnienia i wrzenia, nie rozpuszczają się w typowych rozpuszczalnikach; skroplone związki i ich rozwory nie przewodzą prądu elektrycznego, ponieważ nie ulegają dysocjacji elektrolitycznej (dysocjacja elektrolityczna - rozpad cząsteczek na mniejsze pod wpływem rozpuszczalnika) WIĄZANIA KOWALENCYJNE POLARNE (SPOLARYZOWANE) Wiązania spolaryzowane są pośrednimi między jonowymi a kowalencyjnymi. Powstają, gdy łączą się atomy pierwiastków różniących się elektroujemnością, ale nie tak bardzo, aby utworzyć wiązanie jonowe. Cechą charakterystyczną wiązania jest przesunięcie pary elektronowej wiążącej atomy w kierunku pierwiastka bardziej elektroujemnego (np. w HCl para elektronowa jest silniej przyciągana przez atom chloru niż przez atom wodoru). Przesunięcie ładunku elektrycznego zaznacza się za pomocą strzałki, np. H Cl W cząsteczkach tych można wyróżnić biegun elektryczny dodatni i ujemny (są to cząsteczki dipolowe, czyli dwubiegunowe). Miarą przesunięcia ładunku jest moment dipolowy μ: μ = e l
gdzie: e - bezwzględna wartość ładunku elektrycznego zawartego w jednym z biegunów, l - odległość biegunów
|
Jednostka momentu dipolowego: Cm (kulombometr) [dawna jednostka debaj (D); 1D = 3,33·10-30 Cm] Przykładowe wartości momentu dipolowego: HF - 6,33·10-30Cm; HCl - 3,43·10-30Cm; HI - 1,27·10-30Cm Właściwości związków o wiązaniach spolaryzowanych zależą od ilościowego udziału wiązania jonowego w danym wiązaniu WIĄZANIA METALICZNE Powstanie wiązań metalicznych polega na przekształceniu atomów jednego lub kilku metali w zbiór kationów i swobodnie poruszających się między nimi elektronów. Wiązania te istnieją tylko w stanie stałym lub ciekłym. W stanie stałym węzły sieci krystalicznej metalu lub stopu są obsadzone przez kationy, mogące wykonywać tylko ruchy oscylacyjne wokół węzłów, a zdelokalizowane elektrony (gaz elektronowy, chmura elektronowa, morze elektronowe) poruszają się swobodnie w obrębie całego kryształu. Właściwości metali i ich stopów: Metale i ich stopy (jeżeli są oczyszczone i wypolerowane) mają charakterystyczny połysk metaliczny. Skutkiem oscylacji rdzeni atomowych, tworzących węzły sieci krystalicznej, jest dobre przewodnictwo cieplne (duża wartość przewodności cieplnej) metali. Skutkiem swobodnego ruchu elektronów jest dobre przewodnictwo elektryczne (mała rezystancja) metali. Ponieważ ze wzrostem temperatury wzrasta amplituda drgań kationów tworzących sieć krystaliczną, ze wzrostem temperatury rośnie także rezystancja metali (ze wzrostem temperatury elektronom trudniej jest „przedzierać” się między węzłami sieci). Specyficzną właściwością metali jest termo- i fotoemisja. Zjawisko polega na wybijaniu z sieci krystalicznej elektronów przez energię dostarczoną z zewnątrz w postaci ciepła lub światła.
|
WIĄZANIA KOORDYNACYJNE (DONOROWO - AKCEPTOROWE, SEMIPOLARNE) Polegają na utworzeniu wiązania z pary elektronów dostarczonej przez jeden atom (donor, dawcę). Drugi atom (akceptor, biorca) uzupełnia własną powłokę walencyjną elektronami donora. Warunkiem utworzenia wiązania jest zderzenie drobiny dysponującej wolną parą elektronów walencyjnych (nie zaangażowanej w innych wiązaniach), z drobiną dysponującą luką elektronową w powłoce walencyjnej. Cechą specyficzną wiązania jest to, że po jego powstaniu wszystkie elektrony walencyjne akceptora (własne i donora) stają się równocenne. WIĄZANIA WODOROWE (MOSTEK WODOROWY) Wiązanie wodorowe jest słabym wiązaniem miedzy atomem wodoru, związanym chemicznie z atomem silnie elektroujemnym a atomem o dużej elektroujemności, dysponującym wolną parą elektronów (np. atomem azotu, tlenu, chloru, fluoru). Atom wodoru (ściślej - proton) może być związany równocześnie z dwoma atomami, jeśli maja one małe wymiary i dużą elektroujemność. Substancje, w których występują wiązania wodorowe, wykazują anomalnie wysokie temperatury topnienia i wrzenie oraz duże ciepło parowania. Dzięki wiązaniu wodorowemu mogą powstawać np. dimery wody (H2O)2. ZWIĄZKI KOMPLEKSOWE Niektóre związki chemiczne zdolne do samodzielnego istnienia mogą reagować z sobą. Produktem takich reakcji są nowe związki o całkowicie odmiennych właściwościach. Tworzące się w ten sposób połączenia nazywane są związkami kompleksowymi (koordynacyjnymi, zespolonymi)
W związkach kompleksowych wyróżnia się atom (jon) centralny, którym jest zwykle metal - tzw. centrum koordynacji. Centrum koordynacji jest otoczone zespołami cząsteczek - ligandami. Ligandami są cząsteczki lub jony zawierające wolne pary elektronów (np. NH3, H2O, Związki kompleksowe mogą być kationami, anionami lub być elektrycznie obojętne (w zależności od ładunku centrum i ligandów). np. Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 Fe(CN)2 + 4KCN = K4[Fe(CN)6]
|
STRUKTURA CIAŁ STAŁYCH Cechą charakterystyczną ciał stałych jest przestrzenne uporządkowanie elementów strukturalnych (cechy tej nie posiadają ciecze i gazy). Jeżeli uporządkowanie ma charakter regularny, to substancję zaliczamy do ciał krystalicznych; jeżeli uporządkowanie jest nieregularne, to substancję zaliczamy do ciał bezpostaciowych (amorficznych). Ciała krystaliczne - w stanie stałym mają uporządkowaną, prawidłową budowę wewnętrzną. W zależności od warunków krystalizacji mogą być monokryształami lub ciałami polikrystalicznymi. Monokryształy - pojedynczy kryształ bardzo zbliżony do kryształu doskonałego, nie zawierający zrostów, pęknięć i wrostów. Ciała polikrystaliczne - ciała składające się z licznych, drobnych kryształów (najczęściej wielkości mikroskopowej); większość spotykanych w przyrodzie i otrzymywanych sztucznie ciał stałych jest ciałami polikrystalicznymi. Właściwości ciał krystalicznych i bezpostaciowych: ciała krystaliczne topią się w określonej temperaturze, charakterystycznej dla danej substancji (np. woda w 0oC); ciała bezpostaciowe przechodzą ze stanu stałego do stanu ciekłego stopniowo miękną, przechodzą przez stan plastyczny (np. szkło); ciała krystaliczne są anizotropowe (pewne właściwości fizyczne zależą od kierunku) - anizotropowa może być wytrzymałość mechaniczna, współczynnik załamania światła, współczynnik sprężystości postaciowej, współczynnik rozszerzalności liniowej, przewodność cieplna i elektryczna, stała dielektryczna; ciała bezpostaciowe są izotropowe - wymienione właściwości mają identyczne we wszystkich kierunkach; cechą specyficzną kryształów jest symetria; wyróżnia się płaszczyzny symetrii, osie symetrii i środki symetrii. Krystalografia geometryczna - zajmuje się kształtem kryształów Krystalografia strukturalna - zajmuje się sposobem uporządkowania cząstek w przestrzeni Krystalochemia - zajmuje się zależnością między składem chemicznym kryształów a ich strukturą wewnętrzną
|
REAKCJE CHEMICZNE KLASYFIKACJA REAKCJI CHEMII NIEORGANICZNEJ 1. Reakcja syntezy - polega tworzeniu nowej substancji z dwóch lub więcej substancji
A + B
gdzie: A i B - substraty; C - produkt
np. N2 + 3H2
CaO + CO2 2. Reakcja analizy (rozkładu) - polega na rozkładzie substancji złożonej na dwie lub więcej substancje proste
AB
gdzie: AB - substrat; A i B - produkty
np. CaCO3
NaCl 3. Reakcja wymiany - polega na przekształceniu dwóch lub więcej substancji w nowe o innym ugrupowaniu atomów lub jonów 3a. Reakcja wymiany pojedynczej (prostej)
A A + BC
np. Sn + 2HCl
|
3b. Reakcja wymiany podwójnej
AB + CD
np. BaCl2 + H2SO4
Wszystkie wymienione typy reakcji mogą przebiegać: ze zmianą stopnia utlenienia reagentów - są to tzw. reakcje utlenienia i redukcji (reakcje redoks)
np. 2 bez zmiany stopnia utlenienia reagentów
np. CaO + CO2 KINETYKA I STATYKA REAKCJI CHEMICZNYCH Kinetyka chemiczna - dział chemii fizycznej zajmujący się badaniem szybkości reakcji chemicznych i wpływu na nie różnych czynników (np. stężenia reagentów, temperatury katalizatorów) oraz wyjaśnieniem ich mechanizmów, czyli sposobów przemiany substratów w produkty reakcji Statyka chemiczna - dział chemii fizycznej zajmujący się badaniem właściwości układów, w których zakończył się przebieg reakcji chemicznej i został osiągnięty stan równowagi chemicznej SZYBKOŚĆ REAKCJI CHEMICZNEJ Szybkością reakcji chemicznej nazywany jest ubytek liczby moli substratów lub przyrost liczby moli produktów w jednostce czasu w jednostce objętości układu reakcyjnego
v =
|
Dla reakcji chemicznej przebiegającej wg równania
nA + mB szybkość reakcji chemicznej można zapisać także
v = k
gdzie: k - stała szybkości reakcji chemicznej; cA i [A] oraz cB i [B] - stężenia molowe substratu A i B; n, m - współczynniki stechiometryczne Szybkość reakcji chemicznej zależy od częstości tzw. zderzeń efektywnych, które mogą nastąpić wtedy, gdy cząstki chemiczne mają odpowiednio dużą energię, tzw. energię aktywacji. Na szybkość reakcji chemicznej wpływa: Stężenie - ze wzrostem stężenia substratów rośnie całkowita liczba zderzeń, a w tym także zderzeń efektywnych (wzrost stężenia powoduje wzrost szybkość reakcji) 2. Temperatura - ze wzrostem temperatury rośnie średnia energia kinetyczna cząsteczek i liczba zderzeń efektywnych (wzrost temperatury powoduje wzrost szybkości reakcji chemicznej) Reguła van't Hoffa - Zwiększenie temperatury układu reakcyjnego o 10K powoduje zwykle 2÷3 krotny wzrost szybkości reakcji 3. Obecność katalizatora. Katalizator jest to substancja, która wpływa na zmianę szybkości reakcji chemicznej, pozostając po reakcji w niezmienionej postaci. Katalizator, który zwiększa szybkość reakcji nazywa się katalizatorem dodatnim (lub katalizatorem), a katalizator zmniejszający szybkość reakcji - katalizatorem ujemnym (lub inhibitorem) Autokataliza - kataliza, w której katalizatorem dla danej reakcji jest jeden z substratów lub produktów reakcji Katalizator biochemiczny (biokatalizator) - związek chemiczny występujący w małych ilościach w organizmach żywych, katalizujący reakcje chemiczne (enzymy, hormony i witaminy) PRAWO DZIAŁANIA MAS (Guldberg, Waage - 1867 r.)
|
Reakcje chemiczne są procesami odwracalnymi. Często reakcje prowadzi się w warunkach powodujących praktyczną ich nieodwracalność (np. usuwając produkty ze środowiska reakcji). Rozpatrzmy reakcję
A + B o szybkości v1 = k1 [A] [B] (2) W momencie powstania pierwszych cząsteczek C i D zaczyna przebiegać reakcja przeciwna
C + D o szybkości v2 = k2 [C] [D] (4) Po pewnym czasie ustala się stan równowagi dynamicznej i szybkości obydwu reakcji zrównują się
A + B Wtedy też v1 = v2 czyli k1 [A] [B] = k2 [C] [D] (6) a stąd
gdzie K - stała równowagi reakcji chemicznej. Zależność (7) nazywa się „prawem działania mas” lub „prawem równowagi chemicznej” - w stanie równowagi stosunek iloczynu stężeń produktów do iloczynu stężeń substratów jest wielkością stałą, charakterystyczną dla danej reakcji w danej temperaturze
|
Dla reakcji
aA + bB + stała równowagi ma postać
REGUŁA PRZEKORY (REGUŁA LE CHATELIERA, 1887 r.) Każdy układ w stanie równowagi, poddany działaniu zewnętrznemu naruszającemu ten stan równowagi ulega takim zmianom, które zmniejszają to działanie. Podstawowe działania zewnętrzne: Stężenie reagentów dodatek substratu lub usunięcie produktu powoduje przesunięcie równowagi w prawo (w kierunku wzrostu stężenia produktów) dodatek produktu lub usunięcie substratu powoduje przesunięcie równowagi w lewo (w kierunku wzrostu stężenia substratów) Zmiany stężenia nie powodują zmiany stałej równowagi
Ciśnienie (odpowiednik stężenia dla reakcji przebiegających w stanie gazowym) wzrost ciśnienia przesuwa równowagę w prawo, gdy objętość substratów jest większa od objętości produktów wzrost ciśnienia przesuwa równowagę w lewo, gdy objętość substratów jest mniejsza od objętości produktów ciśnienie nie wpływa na równowagę procesu, gdy objętość substratów jest równa objętości produktów Zmiany ciśnienia nie powodują zmiany stałej równowagi
Temperatura a) podwyższenie temperatury układu, w którym przebiega reakcja endotermiczna, powoduje przesunięcie równowagi w prawo b) podwyższenie temperatury układu, w którym przebiega reakcja egzotermiczna, powoduje przesunięcie równowagi w lewo
|
Katalizator Nie wpływa na równowagę i stałą równowagi; wpływa na czas osiągnięcia równowagi DYSOCJACJA ELEKTROLITYCZNA (JONOWA) Dysocjacja elektrolityczna - rozpad cząsteczek na jony jako wynik oddziaływania między substancją rozpuszczoną a rozpuszczalnikiem Elektrolity substancje, które po rozpuszczeniu w wodzie lub innym rozpuszczalniku polarnym rozpadają się na jony (Arrhenius, 1887). Elektrolitami są związki o wiązaniach jonowych i kowalencyjnych spolaryzowanych (kwasy, wodorotlenki. sole, i wodorki kwasowe) Nieelektrolitami są prawie wszystkie związki organiczne (wyjątek kwasy karboksylowe)
Stała dysocjacji. Dla elektrolitu typu AB, dysocjującego na jeden kation A+ i jeden anion
AB stała (równowagi reakcji) dysocjacji ma postać
gdzie: [A+], [ Stała równowagi nie zależy od stężenia roztworu, zależy od temperatury (p. stała równowagi reakcji chemicznej) W przypadku substancji dysocjujących wielostopniowo (np. kwasu fosforowego), kolejnym stopniom dysocjacji odpowiadają różne stałe dysocjacji (kolejne stopnie dysocjacji mają coraz to mniejsze stałe) |
Stopień dysocjacji (służy do określania mocy elektrolitu). Jest to stosunek liczby cząsteczek zdysocjowanych Nz (stężenia cząsteczek zdysocjowanych Cz) do liczby cząsteczek wprowadzonych do roztworu Nw (całkowitego stężenia elektrolitu Cw)
= Stopień dysocjacji zależy od: rodzaju elektrolitu i rozpuszczalnika; stężenia roztworu (wzrasta w miarę rozcieńczania roztworu); temperatury (zwykle rośnie ze wzrostem temperatury); obecności innych substancji w roztworze Moc elektrolitów określa się za pomocą stałej dysocjacji lub stopnia dysocjacji (α > 0,3 - elektrolit mocny; 0,05<α<0,3 - elektrolit średniej mocy; α<0,05 - elektrolit słaby) Prawo rozcieńczeń Ostwalda (1888 r.) (zależność między stopniem i stałą dysocjacji)
Rozpatrzmy słaby elektrolit AB dysocjujący na jony A+ i
Cz = αCw = [A+] = a stężenie cząsteczek niezdysocjowanych jest równe Cw - Cz = Cw - αCw = Cw(1 - α) Stała dysocjacji wynosi wtedy
|
Dla niezbyt rozcieńczonych słabych elektrolitów (przyjmuje się, że gdy α<0,05) 1 - α ≈ 1 a stąd
REAKCJE JONOWE Reakcje jonowe - reakcje przebiegające w roztworach wodnych między jonami, jonami i atomami lub jonami i cząsteczkami 1. STRĄCANIE OSADÓW TRUDNO ROZPUSZCZALNYCH - najprostszy typ reakcji jonowych, np.
BaCl2 + Na2SO4
Ba2+ + 2
Ba2+ + S
2) AgNO3 + HCl
Ag+ + N
Ag+ + C Iloczyn rozpuszczalności Kso (służy do określania rozpuszczalności soli trudno rozpuszczalnych) - iloczyn stężeń molowych jonów soli trudno rozpuszczalnej w roztworze nasyconym tej soli np. dla CaCO3 Kso = 4,8•10-9 Fe2S3 Kso = 10-88 BaSO4 Kso = 1,1•10-10
|
Reakcje zobojętniania (reakcja między kwasem i zasadą),
np. HCl + NaOH
H+ + C
H+ + O Reakcje kwasów z metalami
np. Mg + 2HCl
Mg + 2H+ + C
Mg + 2H+ HYDROLIZA SOLI Hydroliza - rozkład substancji chemicznych organicznych i nieorganicznych pod wpływem wody, przy czym produkty rozkładu składają się z elementów budowy substancji ulegającej hydrolizie i wody Hydroliza zasadowa (produkt hydrolizy ma odczyn zasadowy) Sole słabych kwasów i mocnych zasad w wodzie ulegają całkowitej dysocjacji
np. CH3COONa
CH3CO + Na+
|
Jony octanowe reagują z jonami H+, które (mimo, że w niewielkich ilościach) występują w wodzie
H2O H+
+ O
Powstaje w ten sposób słabo zdysocjowany kwas octowy CH3COOH i równowaga reakcji przesuwa się w prawo (w kierunku wzrostu ilości produktów hydrolizy).
Z istniejących w roztworze jonów Na+ i O Sumaryczny zapis omawianej reakcji:
CH3CO a po wykreśleniu powtarzającego się jonu Na+
CH3CO produkt hydrolizy ma odczyn zasadowy - hydroliza zasadowa
. Hydroliza kwasowa Sole mocnych kwasów i słabych zasad w wodzie ulegają całkowitej dysocjacji
np. NH4Cl
N
+ C
Jony amonowe reagują z jonami O
H2O
O
|
Powstaje w ten sposób słabo zdysocjowany zasada amonowa NH4OH i równowaga reakcji przesuwa się w prawo (w kierunku wzrostu ilości produktów hydrolizy).
Z istniejących w roztworze jonów H+ i Sumaryczny zapis omawianej reakcji:
N
a po wykreśleniu powtarzającego się jonu C
N produkt hydrolizy ma odczyn kwaśny - hydroliza kwasowa
3. Hydroliza soli słabych kwasów i słabych zasad Sole słabych kwasów i słabych zasad ulegają hydrolizie z utworzeniem słabego kwasu i słabej zasady
np. CH3COONH4
CH3COONH4 + H2O Odczyn produktu reakcji hydrolizy (roztworu) zależy od mocy powstających elektrolitów (kwasu i zasady); jeżeli kwas jest mocniejszy - to produkt ma odczyn kwaśny, jeżeli zasada jest mocniejsza, to produkt ma odczyn zasadowy 4. Sole mocnych kwasów i mocnych zasad nie ulegają reakcji hydrolizy pH ROZTWORÓW (Sörensen,1909 r.) Woda (choć w niewielkim stopniu) dysocjuje na jony. Stała dysocjacji wody w 20oC wynosi
|
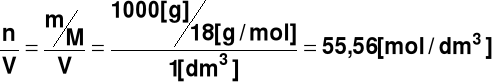
Stężenie w [mol/dm3] czystej wody wynosi
[H2O] = a stąd
Kw = [H+][O
Iloczyn [H+][O pH roztworu (wykładnik jonów wodorowych) - ujemny logarytm dziesiętny ze stężenia jonów wodorowych pH = - lg[H+] pOH roztworu - ujemny logarytm dziesiętny ze stężenia jonów wodorotlenowych
pOH = - lg[O Dla wody
[H+][O
[H+] = [O Dla wody i roztworów wodnych zawsze
lg{[H+][O pH + pOH = 14
Roztwory kwaśne: pH < 7 Roztwory obojętne: pH = 7 Roztwory zasadowe: pH > 7
|
WSKAŹNIKI (INDYKATORY) Do przybliżonego określania odczynu roztworów (pH) stosuje się tzw. wskaźniki (indykator) pH. Są to zwykle słabe kwasy lub zasady organiczne mające inną barwę w postaci zdysocjowanej i niezdysocjowanej. Wskaźniki dodaje się bezpośrednio do roztworu badanego lub w postaci naniesionej na bibułę (w postaci tzw. papierków wskaźnikowych) Tab. Wybrane wskaźniki Wskaźnik pH barwa
oranż metylowy lakmus fenoloftaleina 4 6,8 9
czerwona
czerwona
bezbarwna
BUFORY (ROZTWÓR BUFOROWY, BUFOR pH) Są to roztwory słabych kwasów lub zasad i soli tych kwasów lub zasad. Stężenie jonów wodorowych (pH) tych roztworów prawie nie ulega zmianom podczas rozcieńczania i podczas dodawania ograniczonych ilości kwasów lub zasad. np. bufor octanowy: CH3COOH - słaby kwas CH3COONa - sól tego kwasu bufor amonowy: NH4OH - słaba zasada NH4Cl - sól tej zasady Pojemność buforowa - liczba moli mocnego kwasu lub zasady powodująca zmianę pH roztworu buforowego o jednostkę KWASY - ZASADY Definicja Arrheniusa Kwas - substancja, która dysponuje wodorem odszczepialnym w postaci jonów wodorowych H+
Zasada - substancja, która dysponuje grupą wodorotlenową, odszczepialną w postaci jonów O Definicja Brönsteda i Lowry'ego (1923) Kwas - substancja, która może oddawać proton innej substancji (bez względu na to czy substancja - „kwas” istnieje jako cząsteczka obojętna, czy jako jon)
|
Zasada - substancja, która może przyłączać proton (bez względu na to czy substancja - „zasada” istnieje jako cząsteczka obojętna, czy jako jon) np. kwasy cząsteczkowe: HCl, CH3COOH, H2O
kwasy kationowe: N
kwasy anionowe: HS zasady cząsteczkowe: NH3, H2O
zasady anionowe: H2P Tab. Przykład kwasów i zasad (wg Brönsteda i Lowry'ego) Kwas 1 Zasada 1
Kwas 2 Zasada 2
HCl + H2O = H3O+
+ C
H2P + H2O = H3O+
+ H2P
H2O + H2O = H3O+
+ O
H2O + NH3 =
N
+ O
|
Widać, że rozpuszczalnik (np. woda) odgrywa rolę kwasu wobec zasady i zasady wobec kwasu REAKCJE UTLENIANIA - REDUKCJI (REDOKS) Reakcja utleniania - redukcji - reakcja chemiczna polegająca na przemieszczaniu się elektronów między substancjami reagującymi, czyli na zmianie stopnia utlenienia substancji utlenianej oraz redukowanej Utlenianie - proces prowadzący do podwyższenia stopnia utlenienia Redukcja - proces prowadzący do obniżenia stopnia utlenienia Reduktory - substancje podwyższające swój stopień utlenienia (redukujące inne substancje, utleniające się) Utleniacze - substancje obniżające swój stopień utlenienia (utleniające inne substancje, redukujące się) Wszystkie reakcje można dzielić na: reakcje, które nie są procesami utleniania i redukcji; reakcje utleniania -redukcji (reakcje redoks) Reakcje chemiczną zalicza się do procesów redoks, jeżeli przemianie substratów w produkty towarzyszy zmiana stopnia utlenienia pierwiastków;
np. [stopień utlenienia przed reakcja (0) jest niższy od stopnia utlenienia cynku po reakcji (+2); stopień utlenienia wodoru przed reakcją (+1) jest wyższy od stopnia utlenienia wodoru po reakcji (0)]; WYSTĘPOWANIE SUBSTANCJI NIEORGANICZNYCH W PRZYRODZIE Zawartość podstawowych pierwiastków w warstwie zewnętrznej Ziemi (o grubości 15 km): tlen 49,5%; krzem 25,7%; glin 7,5%; żelazo 4,7% wapń 3,4%; sód 3,4% potas 2,4%; magnez 1,9%; inne 2,3%
|
Wodór: ślady wodoru tylko w górnych warstwach atmosfery; główna ilość, to woda i związki organiczne (węgiel kamienny i brunatny, ropa naftowa, drewno, tkanki roślinne i zwierzęce) Helowce: występują tylko w stanie wolnym (w niewielkich ilościach w atmosferze ziemskiej) Fluorowce: żaden fluorowiec nie występuje w stanie wolnym; najważniejsze spotykane w przyrodzie związki fluorowców, to: CaF2 (fluoryt), Na3AlF6 - heksafluorek glinu i trisodu (kriolit), NaCl - chlorek sodu (sól kuchenna), KCl - chlorek potasu (sylwin); Tlenowce: Tlen w stanie wolnym występuje w powietrzu jako O2, w stanie związanym w większości minerałów (w SiO2, CaCO3, azotanach, siarczanach, itd.), w związkach organicznych; Siarka w stanie wolnym znajduje się w postaci płytkich złóż (Polska, Meksyk, ..), w postaci minerałów zawierających siarkę: PbS (galena), FeS (piryt), ZnS (blenda cynkowa), HgS (cynober), CuFeS2 (chalkopiryt); Pozostałe tlenowce: w stanie wolnym lub w postaci selenków i tellurków; promieniotwórczy polon w blendzie uranowej (M. Skłodowska - Curie); Azotowce: Azot wolny stanowi ok. 79% atmosfery; w minerałach: NaNO3 (saletra chilijska), KNO3 (saletra indyjska), Ca(NO3)2; w związkach organicznych (w białkach i w aminokwasach); Fosfor nie występuje w stanie wolnym; występuje głównie w fosforytach - głównie w postaci Ca(PO4)2; Arsen, antymon, bizmut występują w małych ilościach w stanie wolnym i w postaci tlenków i siarczków; Węglowce: Węgiel występuje w postaci złóż: antracyt (do 95% C); węgiel kamienny (do 90% C), węgiel brunatny (do 70% C); i torf (do 65% C). Węgiel występuje we wszystkich związkach organicznych i wielu minerałach nieorganicznych (CaCO3 - wapń);
|
Krzem nie występuje w stanie wolnym; w związkach w krzemionce SiO2 i w glinokrzemianach; German występuje w małych ilościach tylko w związkach; Cyna występuje tylko w związkach - główny minerał SnO2 (kasteryt); Ołów w niewielkich ilościach występuje w postaci pierwiastka; głównie w postaci PbS (galena = galenit); Borowce: Bor jest mało rozpowszechniony, nie występuje w stanie wolnym, głównie w postaci boranów Na2B4O7•10H2O (boraks); Glin występuje tylko w związkach: korund, kaolin, boksyt (Al2O3 o różnym stopniu uwodnienia) oraz glinokrzemiany: ortoklaz - K2O•Al2O3•6SiO2 czyli KAlSi3O8 (glinokrzemian potasu), albit - Na2O•Al2O3•6SiO2 czyli NaAlSi3O8 (glinokrzemian sodu); anortyt - CaO•Al2O3•2SiO2 czyli CaAl2Si2O8 (glinokrzemian wapnia); glinokrzemiany są podstawowym składnikiem skał (granitów, bazaltów, porfinów); Pozostałe borowce (gal, ind tal) występują w minimalnych ilościach tylko w związkach; Litowce i berylowce: ze względu na dużą aktywność chemiczną nie występują w stanie wolnym. Sód występuje w postaci soli kuchennej NaCl, saletry chilijskiej, potas - w postaci sylwinu i saletry indyjskiej; Pozostałe litowce występują w znikomych ilościach; Beryl mało rozpowszechniony w przyrodzie: minerał „beryl” Be3Al2Si6O18 (odmiana krystalograficzna - szmaragd); Magnez - magnezyt MgCO3, dolomit MgCO3•CaCO3; Wapń - występuje w wielu minerałach:CaCO3 (wapień, marmur, kreda), CaSO4 (anhydryt), CaSO4•2H2) (gips), MgCO3•CaCO3 (dolomit), CaF2 (fluoryt; Stront - stroncjanit SrCO3 i celestyn SrSO3; Bar - witeryt BaCO3 i baryt BaSO4; Rad towarzyszy złożom uranu (M. Skłodowska - Curie); Metale (pierwiastki) przejściowe: spośród 59 pierwiastków przejściowych 46 występuje w przyrodzie, a 13 otrzymano w sposób sztuczny (transuranowce, technet i promet). Znaczenie praktyczne znalazły tylko: żelazo, chrom, mangan, miedź, srebro i cynk. Metale te występują w postaci minerałów: magnetyt Fe3O4, hematyt Fe2O3, limonit Fe2O3•nH2O, syderyt FeCO3, brausztyn MnO2 itd.
|
|
|
|
Wyszukiwarka