Nazwisko i imię: Ogrodowczyk Justyna
Nr albumu: 116277
Wydział: Biotechnologii i Nauk o Żywności
Kierunek: Biotechnologia
Nr grupy dziekańskiej: 2
Ćwiczenie 11
Temat: Wyznaczanie ciepła rozpuszczania tiosiarczanu sodowego.
Data oddania:
Wstęp teoretyczny.
Zgodnie z pierwszą zasadą termodynamiki zmianę energii wewnętrznej układu można osiągnąć na sposób ciepła i na sposób pracy, albo na każdy z tych sposobów z osobna. Matematyczny zapis tego faktu jest następujący:
![]()
ΔU - zmiana energii wewnętrznej układu; Q - energia wymieniona przez układ z otoczeniem na sposób ciepła; W - energia wymieniona na sposób pracy.
Ciepłem spalania nazywamy ciepło reakcji całkowitego spalenia jednostki masy związku chemicznego w tlenie.
Entalpia jest wielkością termodynamiczną równą sumie energii wewnętrznej układu oraz iloczynu jego objętości i ciśnienia:
![]()
Zgodnie z prawem Hessa efekt cieplny reakcji chemicznych zależy jedynie od stanu początkowego i końcowego, a nie zależy od drogi, na jakiej była ona prowadzona, pod warunkiem, że wszystkie jej etapy są izochoryczne względnie izobaryczne i nie towarzyszy im inna praca niż praca objętościowa w przemianie izobarycznej. Również zmiana entalpii zależy od początkowego i końcowego stanu układu (zatem entalpia podobnie jak energia wewnętrzna jest funkcją stanu).
Każdej reakcji chemicznej towarzyszy jakiś efekt cieplny - ilość ciepła uwolniona lub zużyta w czasie tego procesu przy założeniu, że temperatura produktów reakcji jest taka sama jak i jej substratów. Pomiaru tych efektów dokonuje się w kalorymetrach różnego typu. Są to urządzenia zawierające płaszcz izolacyjny, naczynie kalorymetryczne (tu znajduje się obiekt stanowiący źródło ciepła), mieszadło dokładny czujnik temperatury oraz inne elementy związane ze specyfiką procesu, którego efekt cieplny ma być mierzony. Kalorymetry można podzielić na dwie zasadnicze grupy:
- izotermiczne - mierzy się w nich ilość ciepła, którą należy odprowadzić lub doprowadzić do kalorymetru, aby zachować jego temperaturę na stałym poziomie;
- nieizotermiczne (należą tu kalorymetry zwykłe, adiabatyczne) - mierzy się w nich zmiany temperatury kalorymetru związane z przebiegiem badanego procesu i wymianą ciepła z otoczeniem.
Pomiary ciepła spalania wykonywane są w bombach kalorymetrycznych umieszczonych w kalorymetrze. Substancję przeznaczoną do spalania umieszcza się w bombie, zapala i pozostawia do całkowitego spalenia. Pojemność cieplną oblicza się ze wzoru:
![]()
K - pojemność cieplna bomby;
m - masa substancji spalonej;
c - gramowe ciepło spalania;
(Δt + ∑υ) - wyznaczony graficznie przyrost temperatury i poprawka na promieniowanie.
Wyniki pomiarów.
Pomiary dla Na2S2O3
- okres początkowy pomiaru
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
R [kΩ] |
18,61 |
18,62 |
18,63 |
18,64 |
18,65 |
18,66 |
18,68 |
18,70 |
18,71 |
- okres główny pomiaru
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
R [kΩ] |
18,89 |
18,97 |
19,01 |
19,04 |
19,08 |
19,11 |
19,12 |
19,14 |
19,15 |
19,15 |
19,16 |
19,17 |
19,18 |
19,20 |
|
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
R [kΩ] |
19,20 |
19,21 |
19,22 |
19,23 |
19,24 |
19,25 |
- |
- |
- |
- |
- |
- |
- |
- |
Pomiary dla H2SO4
- okres początkowy pomiaru
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
R [kΩ] |
23,57 |
23,58 |
23,58 |
23,59 |
23,59 |
23,59 |
23,60 |
23,61 |
23,61 |
23,62 |
- okres główny pomiaru
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
R [kΩ] |
21,92 |
21,92 |
21,94 |
21,95 |
21,95 |
21,96 |
21,97 |
21,97 |
21,98 |
21,99 |
22,00 |
22,01 |
22,01 |
22,02 |
|
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
R [kΩ] |
22,03 |
22,04 |
22,04 |
22,05 |
22,06 |
22,07 |
22,07 |
- |
- |
- |
- |
- |
- |
- |
Na2S2O3
Obliczenia.
H2SO4
Kolor sondy - czarny B = 3835 deg; R25 = 14,05 kΩ
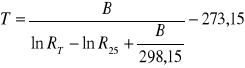
Lp. |
T |
Lp. |
T |
1 |
13,47 |
17 |
14,985 |
2 |
13,46 |
18 |
14,985 |
3 |
13,46 |
19 |
14,976 |
4 |
13,45 |
20 |
14,966 |
5 |
13,45 |
21 |
14,956 |
6 |
13,45 |
22 |
14,95 |
7 |
13,44 |
23 |
14,95 |
8 |
13,435 |
24 |
14,936 |
9 |
13,435 |
25 |
14,93 |
10 |
13,43 |
26 |
14,92 |
11 |
15,03 |
27 |
14,92 |
12 |
15,03 |
28 |
14,91 |
13 |
15,02 |
29 |
14,90 |
14 |
15,01 |
30 |
14,89 |
15 |
15,01 |
31 |
14,89 |
16 |
14,995 |
|
|
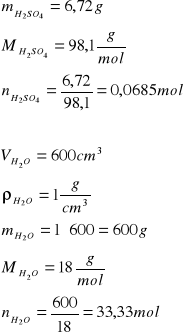

Na2S2O3
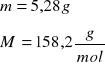
Lp. |
T |
Lp. |
T |
1 |
18,62 |
16 |
18,025 |
2 |
18,61 |
17 |
18,00 |
3 |
18,60 |
18 |
17,99 |
4 |
18,59 |
19 |
17,99 |
5 |
18,58 |
20 |
17,98 |
6 |
18,56 |
21 |
17,97 |
7 |
18,54 |
22 |
17,96 |
8 |
18,52 |
23 |
17,93 |
9 |
18,505 |
24 |
17,93 |
10 |
18,29 |
25 |
17,92 |
11 |
18,20 |
26 |
17,91 |
12 |
18,15 |
27 |
17,90 |
13 |
18,12 |
28 |
17,89 |
14 |
18,07 |
29 |
17,875 |
15 |
18,04 |
|
|
z wykresu :
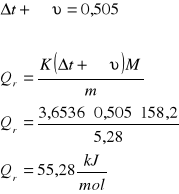
Wnioski.
Celem ćwiczenia było wyznaczenie ciepła rozpuszczania tiosiarczanu sodowego. Na podstawie obliczeń wynika, że ciepło to wynosi 55,28 kJ/mol. Wartość tablicowa wynosi natomiast 47,423 kJ/mol.
Błąd bezwzględny wynosi:
![]()
,
natomiast błąd względny:
![]()
Nie jest to zatem znaczny błąd. Może on wynikać z pewnych niedokładności podczas wykonywania ćwiczenia. Jedną z jego przyczyn może być niedokładne wymieszanie się płynu w naczyniu Dewara. Poza tym mogło dojść do błędnego odczytu ze wskaźnika sondy termistorowej, ponieważ opór zmieniał się w czasie. Także niedokładne zważenie badanych próbek oraz zapoczątkowanie reakcji poprzez stłuczenie ampułki w niewłaściwym momencie miały wpływ na wielkość powstałego błędu
Wyniki pomiarów.
masa pastylki wzorcowej m = ………..g
Lp. |
T |
Lp. |
T |
1 |
|
18 |
|
2 |
|
19 |
|
3 |
|
20 |
|
4 |
|
21 |
|
5 |
|
22 |
|
6 |
|
23 |
|
7 |
|
24 |
|
8 |
|
25 |
|
9 |
|
26 |
|
10 |
|
27 |
|
11 |
|
28 |
|
12 |
|
29 |
|
13 |
|
30 |
|
14 |
|
31 |
|
15 |
|
32 |
|
16 |
|
33 |
|
17 |
|
34 |
|
Masa pastylki badanej m = ……………g
Lp. |
T |
Lp. |
T |
1 |
|
18 |
|
2 |
|
19 |
|
3 |
|
20 |
|
4 |
|
21 |
|
5 |
|
22 |
|
6 |
|
23 |
|
7 |
|
24 |
|
8 |
|
25 |
|
9 |
|
26 |
|
10 |
|
27 |
|
11 |
|
28 |
|
12 |
|
29 |
|
13 |
|
30 |
|
14 |
|
31 |
|
15 |
|
32 |
|
16 |
|
33 |
|
17 |
|
34 |
|
Wyszukiwarka