Rok akademicki: 2003/2004 |
Chemia Fizyczna |
Data wykonania ćwiczenia: 28.11.2003 |
Kierunek studiów: Metalurgia |
CZĄSTKOWE WIELKOŚCI MOLOWE |
Numer ćwiczenia: 3 |
Numer grupy: IV |
Pastucha Krzysztof Papierz Grzegorz
|
Ocena:
|
Numer zespołu: XI |
|
|
1. Cel ćwiczenia.
Celem ćwiczenia jest zapoznanie się z podstawowymi pojęciami termodynamiki roztworów oraz pomiar objętości molowej roztworu dwuskładnikowego w funkcji stężenia i graficzne wyznaczenie cząstkowych objętości molowych dla dwu typów roztworów: roztworu soli w cieczy i roztworu dwu cieczy.
2. Przebieg ćwiczenia.
Przygotować dwa typy roztworów: NaCl i alkoholu etylowego. Dla każdego typu przygotować co najmniej po cztery roztwory; dla C2H5OH obejmujące cały zakres stężeń, dla NaCl aż do ok. 10%.
Przygotowanie roztworów soli:
Przygotować po ok. 50 cm3 roztworów o stężeniach ok. 1%, 2%, 4%, 10% wagowych soli. Małą suchą zlewkę zważyć na wadze technicznej, potem na analitycznej z dokładnością do ok. 0,0001g. Zlewkę umieścić z powrotem na wadze technicznej i nasypać ok.0,5 g soli. Zważyć na wadze analitycznej. Następnie wlać w przybliżeniu 50 cm3 wody destylowanej odmierzonej menzurką. Całość zważyć na wadze analitycznej. Podpisać roztwory i odstawić w bezpieczne miejsce. Powtórzyć czynności odważając do następnych zlewek kolejno po ok. 1 g, 2 g i 5 g soli. Po skończeniu ważenia wszystkich roztworów wymieszać każdy z nich bagietką szklaną. Dołączyć do kompletu zlewkę z wodą destylowaną.
Przygotowanie roztworów alkoholu:
Przygotować po ok. 20 cm3 roztworów o stężeniach ok. 25%, 50%, 75%, 90% objętościowych alkoholu. Do suchych kolbek z korkiem odmierzyć pipetką wielomiarową następujące ilości alkoholu i wody destylowanej: 5cm3 alkoholu - 15cm3 wody destylowanej; 10cm3 - 10cm3, 15cm3 - 5cm3, 18cm3 - 2cm3. Objętości wody i alkoholu mogą się nieco różnić od proponowanych, ale muszą być odmierzone z dokładnością do 0,1cm3. Przed odmierzaniem pipetka musi być przepłukana daną cieczą. Odmierzyć należy najpierw jedną ciecz do wszystkich kolbek, potem drugą ciecz. Kolbki zatkać korkiem i podpisać. Wstrząsnąć w celu wymieszania. Dołączyć kolbkę z niewielką ilością alkoholu. Całość odstawić w bezpieczne miejsce.
Zmierzyć gęstości roztworów w następującej kolejności:
- woda destylowana,
- roztwory soli od największego stężenia do najmniejszego,
- roztwory alkoholu od najmniejszego stężenia do największego,
- czysty C2H5OH.
3. Opracowanie wyników.
Ważenie próbek dla NaCl.
L.p. |
Masa zlewki [g] |
Masa zlewki + sól [g] |
Masa zlewki + sól + woda [g] |
1 |
58,0233 |
58,5314 |
108,6482 |
2 |
82,0670 |
83,0934 |
133,0492 |
3 |
54,6740 |
56,6380 |
106,9623 |
4 |
53,8273 |
58,8764 |
108,4766 |
Badanie gęstości NaCl
Rodzaj Roztworu |
Gęstość roztworu [g/cm3] |
||
|
Pomiar 1 |
Pomiar 2 |
Pomiar 3 |
H2O |
0,99741 |
0,99723 |
0,99733 |
NaCl - 1% |
1,00425 |
1,00411 |
1,00404 |
NaCl - 2% |
1,01291 |
1,01249 |
1,01258 |
NaCl - 4% |
1,02485 |
1,02483 |
1,02446 |
NaCl - 10% |
1,06248 |
1,06351 |
1,06411 |
Badanie gęstości alkoholu
Rodzaj Roztworu |
Gęstość roztworu [g/cm3] |
||
|
Pomiar 1 |
Pomiar 2 |
Pomiar 3 |
C2H5OH - 25% |
0,96776 |
0,96919 |
0,96832 |
C2H5OH - 50% |
0,93386 |
0,93215 |
0,93207 |
C2H5OH - 75% |
0,88273 |
0,88045 |
0,88012 |
C2H5OH - 98% |
0,84661 |
0,84184 |
0,84104 |
C2H5OH - 100% |
0,81816 |
0,81539 |
0,81419 |
Temperatura: 20,38 [ºC]
1. Liczymy masę soli. mzlew+sól - mzlew = msól
mS1 = 58,5314 - 58,0233 = 0,5081g
mS2 = 1,0264g
mS3 = 1,9640g
mS4 = 5,0491g
2. Liczymy masę wody. mzlew+roz - mzlew+sól = mwody
mW1 = 108,6482 - 58,5314 = 50,1168 g
mW2 = 49,9558 g
mW3 = 50,3243 g
mW4 = 49,6002 g
3. Liczymy ilość moli NaCl (MNaCl = 58,5 g/mol) ![]()
1. nNaCl1 = ![]()
= 0,0087
nNaCl2 = 0,0176
nNaCl3 = 0,0336
nNaCl4 = 0,0864
4. Liczymy ilość moli H2O (MH2O = 18 g/mol)
nW1 =
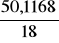
= 2,7843nW2 = 2,7753
nW3 = 2,7958
nW4 = 2,7556
5. Liczymy procent wagowy NaCl 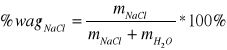
%wagNaCl1 =
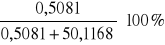
= 1,0036 %%wagNaCl2 = 2,0132 %
%wagNaCl3 = 3,7564 %
%wagNaCl4 = 9,2391 %
6. Liczymy ułamek molowy NaCl 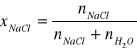
xNaCl1 =
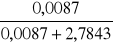
= 0,0031xNaCl2 = 0,0063
xNaCl3 = 0,0119
xNaCl4 = 0,0304
7. Zmierzone gęstości roztworów soli wynoszą:
dwody = 0,9973 g/cm3
dS1 = 1,0041 g/cm3
dS2 = 1,0126 g/cm3
dS3 = 1,0247 g/cm3
dS4 = 1,0634 g/cm3
8. Liczymy masy roztworów soli. mrozt= mzlew+rozt - mzlew
mrozt1 = 108,6483 - 58,0233 = 50,6230 g
mrozt2 = 50,9822 g
mrozt3 = 52,2883 g
mrozt4 = 54,6493 g
9. Obliczamy objętości roztworów soli. ![]()
Vrozt1 =
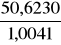
= 50,4163 cm3Vrozt2 = 50,3448 cm3
Vrozt3 = 51,0279 cm3
Vrozt4 = 51,3911 cm3
10. Liczymy objętości molowe roztworów soli. 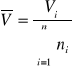
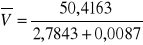
= 18,050918,0260
18,0349
18,0827
11. Zmierzone gęstości roztworów alkoholu wynoszą:
drozt1 = 0,9684 g/cm3
drozt2 = 0,9327 g/cm3
drozt3 = 0,8811 g/cm3
drozt4 = 0,8429 g/cm3
dalk = 0,8159 g/cm3
12. Liczymy masy roztworów alkoholu. mrozt = malk + mwody, gdzie m = d*V
mrozt1 = 0,8159*5 + 0,9973*15 = 19,0390 g
mrozt2 = 0,8159*10 + 0,9973*10 = 18,1321 g
mrozt3 = 0,8159*15 + 0,9973*5 = 17,2250 g
mrozt4 = 0,8159*18 + 0,9973*2 = 16,6808 g
malk = 0,8159*20 = 16,3180 g
13. Liczymy stężenie procentowe roztworów alkoholu. 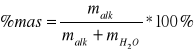
%mas rozt1 =
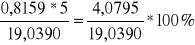
= 21,4271 %%mas rozt2 = 44,9981 %
%mas rozt3 = 71,0510 %
%mas rozt4 = 88,0427 %
%mas alk = 100 %
14. Liczymy ilość moli alkoholu w roztworach alkoholu. (MC2H5OH = 46 g/mol) ![]()
nrozt1 =
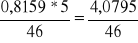
= 0,0885 molnrozt2 = 0,1771 mol
nrozt3 = 0,2657 mol
nrozt4 = 0,3189 mol
nalk = 0,3542 mol
15. Liczymy ilość moli wody w roztworach alkoholu. (MH2O = 18 g/mol) ![]()
nrozt1 =
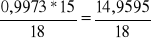
= 0,8304 molnrozt2 = 0,5536 mol
nrozt3 = 0,2770 mol
nrozt4 = 0,1107 mol
nalk = 0 mol
16. Liczymy ułamki molowe roztworów alkoholu.
xrozt1 =
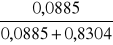
= 0,0963xrozt2 = 0,2425
xrozt3 = 0,4896
xrozt4 = 0,7423
xalk = 1
17. Liczymy objętości roztworów alkoholu.
Vrozt1 =
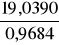
= 19,6599 cm3Vrozt2 = 19,4406 cm3
Vrozt3 = 19,5528 cm3
Vrozt4 = 19,7889 cm3
Valk = 22,4512 cm3
18. Liczymy objętości molowe roztworów alkoholu.
Vnrozt1 =
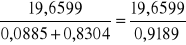
= 21,3741 cm3/molVnrozt2 = 26,5763 cm3/mol
Vnrozt3 = 36,0022 cm3/mol
Vnrozt4 = 46,0100 cm3/mol
Vnalk = 63,2963 cm3/mol
Rodzaj |
Cp % / %wag |
Masa |
Gęstość |
Ułamek |
Objętość molowa |
C2H5OH |
100,0000 |
16,3182 |
0,8159 |
1,0000 |
63,2963 |
C2H5OH 98% |
88,0427 |
16,6810 |
0,8429 |
0,7423 |
46,0100 |
C2H5OH 75% |
71,0510 |
17,2250 |
0,8811 |
0,4896 |
36,0022 |
C2H5OH 50% |
44,9981 |
18,1321 |
0,9327 |
0,2425 |
26,5763 |
C2H5OH 25% |
21,4271 |
19,0390 |
0,9684 |
0,0963 |
21,3741 |
NaCl 1% |
1,0036 |
50,1168 |
1,0041 |
0,0031 |
18,0509 |
NaCl 2% |
2,0132 |
49,9558 |
1,0127 |
0,0063 |
18,0260 |
NaCl 4% |
3,7564 |
50,3234 |
1,0247 |
0,0119 |
18,1633 |
NaCl 10% |
9,2391 |
49,6002 |
1,0634 |
0,0304 |
18,0827 |
Wnioski:
Po przeprowadzeniu ćwiczenia i wykonaniu obliczeń stwierdzamy, że mierzone i wyliczone objętości nie są zgodne, jest to wpływ cząstkowych wielkości molowych składników roztworu.
Z wykresu roztworu alkoholu zauważamy, że objętość molowa rośnie wraz ze wzrostem ułamka molowego składnika roztworu. Natomiast przy roztworach soli objętość ta zmienia się parabolicznie.
6
Wyszukiwarka