Zespół 4 Grupa 34 |
Sprawozdanie 6 |
Data: 30.11.2000 |
ALEKSANDROWICZ ZOSIA DYDUŁA ŁUKASZ KRĘCIGŁOWA BEATA
|
Równowagi w roztworach buforowych |
|
Wstęp teoretyczny.
Roztworami buforowymi nazywa się roztwory słabego kwasu i jego soli z mocną zasadą oraz słabej zasady i jego soli z mocnym kwasem, wykazujące stałe stężenie jonów wodorowych, które praktycznie nie ulega zmianie podczas rozcieńczania lub po dodaniu niewielkich ilości mocnych kwasów lub zasad (mniejszych od ilości stechiometrycznych w stosunku do składników buforu). Roztworami mogą być również roztwory soli kwasów wieloprotonowych (K2HPO4, Na2HPO4). Według teorii protonowej, roztwory buforowe są to układy zawierające sprzężoną parę kwas - zasada, których stężenie analityczne są wystarczająco duże i mogą być zmieniane niezależnie od siebie.
Roztwory buforowe zachowują podczas rozcieńczania stałe pH, ponieważ zależy ono od stosunku stężeń składników roztworu buforowego, a nie od ich względnych stężeń.
Roztwory buforowe wykazują działanie obustronne, tj. zabezpieczają przed zmianą pH zarówno na skutek dodania mocnych kwasów, jak i zasad. Podczas dodawania mocnego kwasu lub mocnej zasady pH roztworu buforowego powstaje słaby kwas lub słaba zasada. Jeżeli np. do buforu octanowego dodać kwasu solnego, to jony octanowe wiążą jony wodorowe na słabo zdysocjowany kwas octowy:
CH3COO- + HCl ⇒CH3COOH + Cl-
Podczas dodawania wodorotleneku sodu reaguje kwas octowy i powstaje słaba zasada (jony octanowe):
CH3COOH + NaOH ⇒ CH3COO- + H2O + Na+
POJEMNOŚĆ BUFOROWA - zdolność przeciwstawiania się wpływom zmieniającym pH.
Przyjmijmy, że zmiana stężenia mocnej zasady w roztworze dcz powoduje zmianę pH o wartość dpH. Wyrażenie, które określa związek między ilością wprowadzonej zasady i zmianą pH nazywa się pojemnością buforową roztworu
![]()
Zgodnie z podaną definicją β jest zawsze dodatnia, gdyż, jeśli dcz > 0, to do dpH>0 (ze wzrostem stężenia zasady pH wzrasta). Jeżeli do roztworu wprowadzi się kwas, to stężenie zasady zmaleje, a więc dcz<0, pH również zmaleje, więc dpH<0 i β>0.
Pojemność buforową wyrażało się dotąd w gramorównoważnikach na litr. Roztwór ma pojemność buforową równą 1, jeżeli po dodaniu 1l roztworu gramorównoważnika zasady lub kwasu zmieni pH o 1.
Cel ćwiczenia.
Badanie pH roztworów buforowych oraz ich pojemności buforowej.
Wyniki pomiarów.
Sporządzono 10 roztworów buforowych przez zmieszanie w różnych stosunkach objętościowych 0,2 m CH3COOH i CH3COONa
W tabeli zestawiono wyniki pomiarów pH r-r buforowych .
Lp |
CH3COOH : CH3COONa |
pH (zmierzone) |
1 |
18,50 : 1,50 |
3,34 |
2 |
18,05 : 1,95 |
3,46 |
3 |
17,60 : 2,40 |
3,56 |
4 |
17,00 : 3,00 |
3,67 |
5 |
16,40 : 3,60 |
3,76 |
6 |
15,55 : 4,45 |
3,87 |
7 |
14,70 : 5,30 |
3,96 |
8 |
13,65 : 6,35 |
4,07 |
9 |
12,60 : 7,40 |
4,17 |
10 |
10,20 : 9,80 |
4,37 |
Do trzech wybranych próbek dodajemy 0,2 ml 0,1 m HCL i mierzymy pH , pomiar wykonujemy ponownie po dodaniu do próbek 0,2 ml 1m HCL.
Numer buforu |
pH buforu |
pH ( Po dodaniu 0,2 ml 0,1m HCL ) |
pH ( Po dodaniu 0,2 ml 1m HCL ) |
1 |
3,34 |
3,18 |
2,69 |
5 |
3,76 |
3,64 |
3,28 |
9 |
4,17 |
4,09 |
3,92 |
Mierzymy pH wody destylowanej.
Do dwóch próbek z wodą destylowaną dodajemy kolejno 0,2 ml 0,1m HCL,
oraz 0,2 ml 0,1m HCL
pH wody dest. |
pH ( Po dodaniu 0,2ml 0,1m HCL ) |
pH ( Po dodaniu 0,2ml 1m HCL ) |
5,14 |
2,82 |
1,87 |
Wyznaczenie stałej dysocjacji K kwasu CH3COOH
Dla roztworów buforowych na podstawie wykresu pH = f (lgx),
x = CS/Ckw = Vkw/VS
gdzie
CS,VS - stężenie, objętość CH3COONa
Ckw,Vkw - stężenie,objętość CH3COOH
Lp |
pH |
logx |
1 |
3,34 |
-1,0911 |
2 |
3,46 |
-0,9664 |
3 |
3,56 |
-0,8653 |
4 |
3,67 |
-0,7533 |
5 |
3,76 |
-0,6585 |
6 |
3,87 |
-0,5434 |
7 |
3,96 |
-0,4430 |
8 |
4,07 |
-0,3324 |
9 |
4,17 |
-0,2311 |
10 |
4,37 |
-0,0174 |
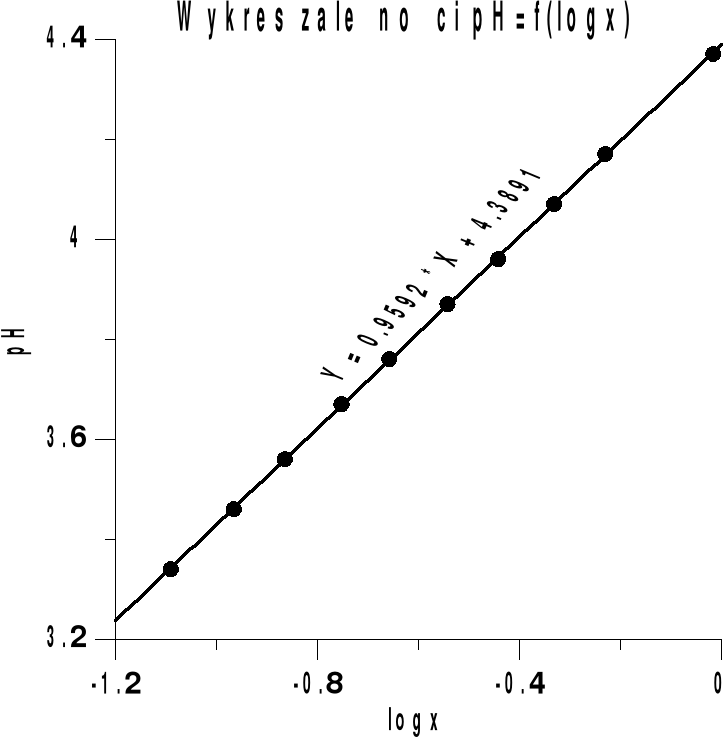
Wartość odciętej dla lgx = 0 daje wartość stałej K = 10 -4,3891
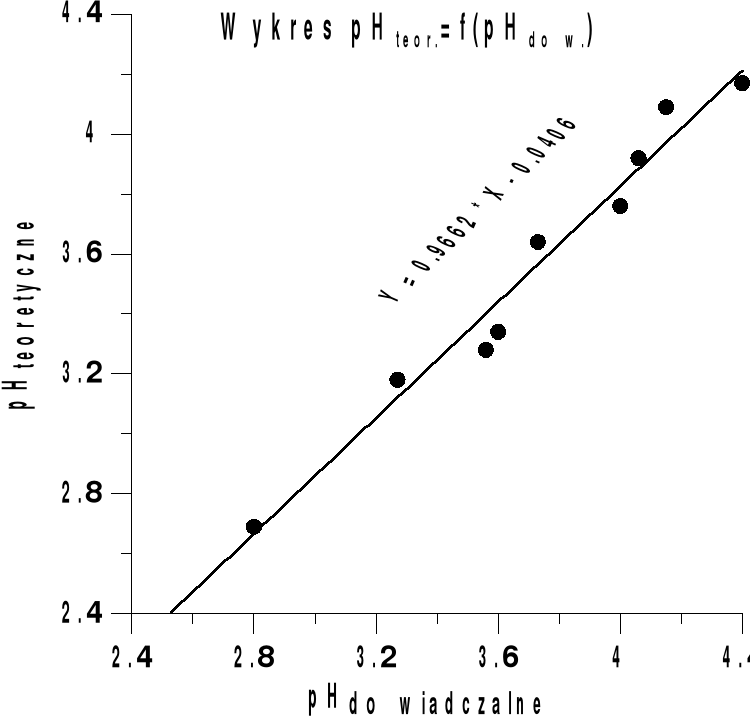
Obliczenie teoretycznego pH i ΔpHteor roztworów buforowych po dodaniu HCl
![]()
![]()
|
pH |
ΔpH |
||
|
wartość teoretyczna |
wartość zmierzona |
wartość teoretyczna |
wartość zmierzona |
roztwór 1 |
||||
Bez HCl |
3.60 |
3,34 |
- |
- |
0.2 cm3 0.1m HCl |
3,27 |
3,18 |
-0,0323 |
0.16 |
0.2 cm3 1m HCl |
2,80 |
2,69 |
-0,4998 |
0.49 |
roztwór 5 |
||||
Bez HCl |
4,00 |
3,76 |
- |
- |
0.2 cm3 0.1m HCl |
3,73 |
3,64 |
-0,0149 |
0.12 |
0.2 cm3 1m HCl |
3,56 |
3,28 |
-0,1670 |
0.36 |
roztwór 9 |
||||
Bez HCl |
4,40 |
4,17 |
- |
- |
0.2 cm3 0.1m HCl |
4,15 |
4,09 |
-0,0093 |
0.08 |
0.2 cm3 1m HCl |
4,06 |
3,92 |
-0,0962 |
0.17 |
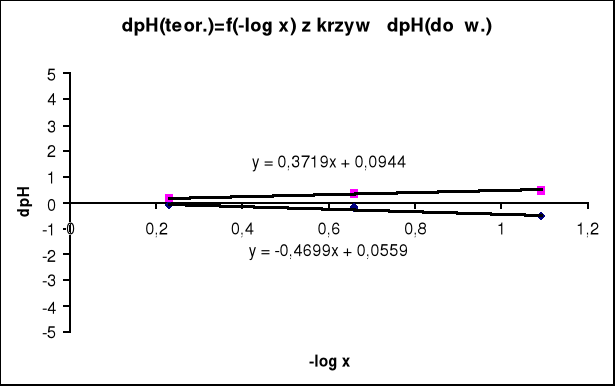
Wykres zależności ΔpH od -lgx.
Obliczenie pojemności buforowej β.
β=ΔCHCl / ΔpH
gdzie : ΔCHCl - stężenie HCl po dodaniu do roztworu buforowego
ΔpH - zmiana pH
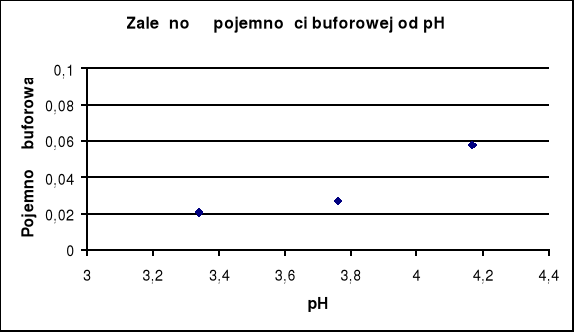
Lp |
pH |
β |
1 |
3,34 |
0,0204 |
5 |
3,76 |
0,0272 |
9 |
4,17 |
0,0576 |
Wykres zależności pojemności buforowej β od pH.
,0Wartości pH dla buforów wzorcowych
Wartości początkowe: pH = 2,00 i pH = 7,00
Wartości końcowe: pH = 2,10 i pH = 7,11
Wnioski.
Pomimo wprowadzenia do roztworów buforowych niewielkiej ilości mocnego kwasu nie nastąpiły wyraźne zmiany wartości pH,co jest własnością charakterystyczną roztworów buforowych.Analizując wykonane pomiary można zauważyć,że wartość pH sporządzonych roztworów buforowych nieznacznie maleje na skutek dodania mocnego kwasu, ale jest stała pomimo rozcieńczania.W przypadku wody destylowanej dodanie mocnego kwasu powoduje wyraźną zmianę pH o kilka jednostek.Czysta woda destylowana (bez dodatku kwasu) ma pH =5, co odbiega od wartości teoretycznej (pH=7).Przypuszczamy,że spowodowane jest to zakwaszeniem w pewnym stopniu wody destylowanej dwutlenkiem węgla zawartym w powietrzu.
Wyszukiwarka