Wykonały: Szczecin 16.01.04 r.
Grażyna Graczyk
Anita Augustyniak
POLITECHNIKA SZCZECIŃSKA
ZAKŁAD CHEMII FIZYCZNEJ
Laboratorium studenckie

Sprawozdanie z wykonania ćwiczenia nr 15:
„Eksces objętości molowej w układzie woda - metanol.”
APARATURA I URZĄDZENIA:
waga analityczna
suszarka
ultratermostat
2 piknometry
2 pipety o poj. 25 ml
ODCZYNNIKI:
roztwory metanol - woda o zawartości metanolu :
0.2, 0.4,0.5 0.6 i 0.8 ułamka molowego
aceton cz. (do przemywania piknometrów)
WSTĘP:
Roztwory rzeczywiste, we wszystkich stanach skupienia, nie spełniają równań słusznych dla układów rzeczywistych. aby tę trudność usunąć, wprowadza się pojęcie aktywności zaproponowane przez Lewisa i Randalla.
Aktywność pewnej substancji, w określonych warunkach, będzie to liczba, która podstawiona do dowolnego równania stanu doskonałego, zamiast wartości liczbowej jakiejś, dającej się zmierzyć własności danej substancji, spełni wraz z pozostałymi parametrami to równanie.
Jedną z najważniejszych funkcji w termodynamice chemicznej jest entalpia swobodna (potencjał termodynamiczny).
Potencjał chemiczny roztworu doskonałego wyraża się wzorem :
μdi = μ0i (T,p) + RTlnxi
gdzie : μdi - potencjał chemiczny składnika i w roztworze doskonałym
μ0i - potencjał standardowy ( potencjał chemiczny czystego składnika i)
xi - ułamek molowy
R - stała gazowa
T - temperatura bezwzględna
Równanie to można przystosować do mieszanin rzeczywistych wprowadzając zamiast xi aktywność składnika - ai, nazywaną aktywnością ułamkową lub aktywnością wyprowadzoną z ułamka molowego.
μi = μ0i (T,p) + Rtlnai
Równanie to definiuje aktywność :
lnai = μi - μ0i (T,p) / RT
Aktywność jest wielkością bezwymiarowa, jest ona funkcją temperatury, ciśnienia i składu roztworu.
Wygodnie jest wprowadzić współczynnik aktywności γ zdefiniowany równaniem :
γi = ai / xi
Związek współczynnika aktywności z potencjałem chemicznym w roztworze rzeczywistym μi i doskonałym μdi jest następujący :
RTlnγi = μi - μid
Funkcje termodynamiczne dla całego roztworu możemy uzyskać z ogólnej zależności :
z = Σ ni Zi
gdzie z - jest jedną z funkcji ekstensywnych
Funkcje mieszania dla roztworu definiujemy ogólnym równaniem :
zm = z - Σ ni Zio T,p = const.
Oprócz termodynamicznych funkcji mieszania opisujących własności roztworów ciekłych, wyróżniamy dużą grupę funkcji termodynamicznych, które nazywamy funkcjami nadmiaru (ekscesu).
Nadmiar danej funkcji z oznaczamy jako zE i określamy następująco :
zE = zm - zm,d
gdzie : zm - termodynamiczna funkcja mieszania danego roztworu
zm,d - funkcja mieszania tego roztworu traktowanego jako roztwór doskonały
Jeżeli roztwór jest doskonały, wtedy :
zE = 0
Jak więc widać, funkcje nadmiaru charakteryzują odchylenia danego roztworu od roztworu doskonałego. Możemy je stosować zarówno do roztworów doskonałych rozcieńczonych jak i do roztworów doskonałych stężonych.
PRZEBIEG POMIARÓW:
Gęstość roztworów wodnych metanolu wyznacza się metodą piknometryczną. Przed przystąpieniem do pomiarów należy piknometry dokładnie wymyć wodą, a następnie acetonem, po czym osuszyć suszarką. Włączyć ultratermostat i ustawić temperaturę 25oC. Przed napełnieniem wodą sprawdzamy wagę piknometru do czwartego miejsca po przecinku. Po dokładnym zważeniu próżnego piknometru należy go napełnić wodą redestylowaną aż po brzegi, potem zamknąć zatyczką. Należy zwrócić uwagę, aby na ściankach piknometru nie pozostały pęcherzyki powietrza. Następnie umieszcza się piknometry w ultratermostacie, w temperaturze 25ºC. Po upływie około 10 min. należy wyjąć oba piknometry, obetrzeć je dokładnie suchą bibułą i sprawdzić, czy ciecz wypełnia całą rurkę kapilarną zatyczki. Podczas osuszania piknometru należy uważać , aby nie zagrzewać go w dłoni !!! Następnie waży się piknometr (m ). Różnica mas piknometru napełnionego wodą i piknometru próżnego określa masę wody zawartej w piknometrze w danej temperaturze (mw -mo ). Skąd na podstawie tabel podających zależność gęstości wody od temperatury znajduje się objętość piknometru.
Ułamek molowy CH3OH w roztworze x2 |
Masa piknometru z roztworem |
|
|
pom. I |
pom. II |
_ |
g |
|
0,0 |
13,5867 |
13,5943 |
0,2 |
13,3261 |
13,3516 |
0,4 |
13,1196 |
13,1324 |
0,5 |
13,0043 |
13,0256 |
0,6 |
12,8962 |
12,9160 |
0,8 |
12,7015 |
12,7123 |
Masa piknometru mo |
8,4803 |
8,4824 |
![]()
gdzie:
mw - masa piknometru z wodą
mo - masa próżnego piknometru
dw - gęstość wody w temperaturze pomiaru
Analogicznie postępuje się przy pomiarze gęstości roztworów woda-metanol, prowadząc równoległe dwa pomiary z tą samą cieczą. Gęstość oblicza się z zależności:
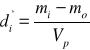
gdzie:
mi- masa piknometru z metanolem lub badanym roztworem
mo- masa piknometru
Vp- obliczona objętość piknometru
di'- obliczona gęstość badanego roztworu w temperaturze pomiaru
Tak wyznaczona gęstość błędem systematycznym wynikającym z nieuwzględnieniu wyporu powietrza. Należy więc ją przeliczyć według wzoru:
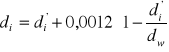
gdzie:
dw- gęstość wody w tej temperaturze
OTRZYMANE WYNIKI:
Wyniki pomiarów zestawione w tabeli:
Ułamek molowy CH3OH w roztworze |
Gęstość roztworu di [g/cm3] pomI pomII |
Gęstość roztworu średnia droz [g/cm3] |
Objętość molowa roztworu V [cm3/mol] |
Objętość molo- wa roztworu dosk. Vd [cm3/mol] |
Eksces objętości molowej VE [cm3/mol] |
|
0,0 |
0,997 |
0,997 |
0,997 |
18,053 |
18,053 |
0,000 |
0,2 |
0,946 |
0,950 |
0,954 |
21,941 |
22,528 |
-0,588 |
0,4 |
0,906 |
0,907 |
0,918 |
26,033 |
27,004 |
-0,970 |
0,5 |
0,883 |
0,886 |
0,889 |
28,252 |
29,241 |
-0,989 |
0,6 |
0,862 |
0,865 |
0,867 |
30,567 |
31,479 |
-0,911 |
0,8 |
0,824 |
0,825 |
0,825 |
35,401 |
35,954 |
-0,553 |
TOK OBLICZEŃ:
Objętości molowe oblicza się z zależności:
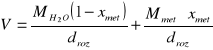
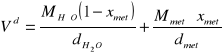
gdzie:
xmet - ułamek molowy metanolu w roztworze
M![]()
, Mmet - ciężar cząsteczkowy wody oraz metanolu
d![]()
, dmet - gęstość wody i metanolu
droz - gęstość roztworu (uśredniona)
M![]()
= 18 g/mol d![]()
= 0,997 g/cm3
Mmet = 32 g/mol dmet = 0,792 g/cm3
Ekscesy objętości molowej dla poszczególnych roztworów oblicza się ze wzoru:
![]()
W oparciu o otrzymane wyniki sporządziliśmy wykres: ![]()
, obrazujący odchylenia od roztworu doskonałego w układzie woda-metanol.
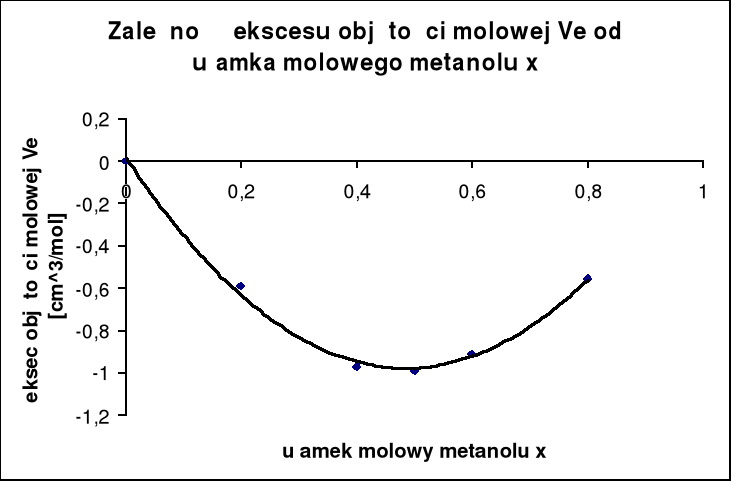
Celem doświadczenia było wyznaczenie ekscesu objętości molowej z pomiarów gęstości roztworów wodnych metanolu. Doświadczenie przeprowadzone było w temperaturze 25 stopni C tj. 328,15 K. Wyniki z pomiarów po uprzednich wyliczeniach wskazują na ujemne odchylenie badanego roztworu od roztworu doskonałego.
Wyniki doświadczenia zestawione zostały w tabeli. Z pomiarów tych wynika, iż wraz ze wzrostem ułamku molowego CH3OH w roztworze gęstość roztworu maleje, natomiast objętość odpowiednio wzrasta. Różnice w wartościach wielkości mierzonych wynikają z niewielkich błędów, którymi obarczone są każde pomiary. Są one spowodowane między innymi niedokładnością metody, przyrządów pomiarowych, niemożliwością zaobserwowania wszystkich zmieniających się w czasie pomiarów warunków.
Reasumując w oparciu o otrzymane dane i wykres ![]()
=f(Xmet) obrazujący odchylenia od roztworu doskonałego w układzie woda-metanol, należy stwierdzić ujemny rodzaj odchylenia od roztworu doskonałego. Objętość mieszania ![]()
< 0, ponieważ cząsteczki w roztworze są upakowane gęściej niż w czystych substancjach. Pomiędzy cząsteczkami występują wiązania wodorowe, powodujące bardziej gęste upakowanie cząsteczek.
Wyszukiwarka