I - faza adaptacyjna (komórki nie dzielą się)
INŻYNIERIA GENETYCZNA L
Przygotowanie komórek kompetentnych XL1-Blue
Komórki kompetentne - komórki zdolne przyjąć obce DNA.Ich przygotowanie - zamrażanie, szok cieplny.
Bufor A - jony Mg
Bufor B - jony Cl
Bufor C - jony Ca, glicerol (20%)
Glicerol zwiększa gęstość, żeby białka bakteryjne i oddziaływania między białkami były bardziej stabilne. Glicerol chroni komórki - zapobiega lizie.
Jony są potrzebne do neutralizacji ładunku błony.
Temperatura - jej obniżanie powoduje, że błona jest bardziej przepuszczalna i sztywna. Podniesienie temperatury powoduje rozciąganie się błony, dzięki czemu może wejść DNA.
Błona komórkowa - fosfolipidy (P - ładunek ujemny)
Transformacja DNA - proces, dzięki któremu DNA jest wprowadzane do bakterii.
OD600 - mówi o rozproszeniu światła. Jest to gęstość optyczna. (komórki kompetentne OD600= 0,4-0,5)
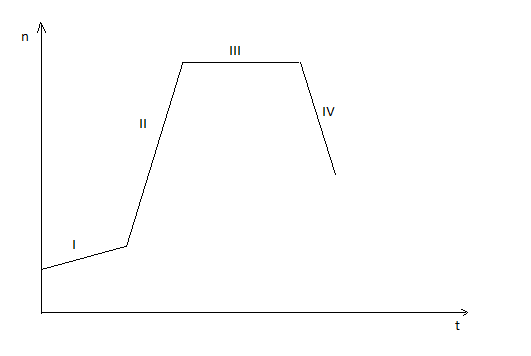
Wykres wzrostu bakterii:

I - faza adaptacyjna (komórki nie dzielą się)
II - faza logarytmiczna (największy wzrost komórek)
III - faza stacjonarna (ilość komórek powstających i umierających jest taka sama)
IV - faza zamierania
X-Gal - pochodna laktozy. Β-galaktozydaza hydrolizuje X-Gal do galaktozy i glukozy.
Galaktoza daje kolor niebieski. Kolonie dobrze stransformowane widać na płytce jako kolonie niebieskie (rozkładają X-Gal)
transpozon - gen ruchomy
transformacja - u organizmów prokariotycznych
transfekcja - u organizmów eukartiotycznych
Metody wszczepiania genów do komórek eukariotycznych:
Elektroporacja - poddawanie komórek działaniu pola elektrycznego, dzięki czemu tworzą się odwracalne pory.
Mikroiniekcja - wszczepianie DNA, bombardowanie błony komórkowej w polu elektrycznym (błona komórkowa jest otoczona złotem lub wolframem).
Liposomy - pęcherzyki lipidowe, które mogą powstawać w fosfolipidów, są to wodne przestrzenie ograniczone dwuwarstwą lipidową, mogą służyć do badania przepuszczalności błon czy do dostarczania komórkom różnych związków chemicznych
Działanie dekstranem i fosforanem wapnia
Transdukcja - wprowadzenie DNA do komórki bakteryjnej za pomocą bakteriofagów
U roślin musimy zrobić protoplastyzację, żeby zniszczyć ścianę komórkową.
Plazmid - kolisty fragment DNA pełniący funkcje chromosomów pomocniczych; służą jako wektory do klonowania DNA w bakteriach.
Komórki bakteryjne zawierają DNA koliste, które łatwiej przenika i łatwiej się łączy. Komórka bakteryjna nie przyjęłaby DNA liniowego.
Enzymy restrykcyjne - białka pochodzące z bakterii, które wykorzystują te enzymy, by bronić się przed obcym DNA. Enzymy restrykcyjne nie tną DNA gospodarza ponieważ jest ono zmetylowane. Restryktazy generują lepkie końce.
BamHI - rozpoznaje sekwencje G▼CCGC, tnie DNA tworząc lepkie końce
EcoRI - tnie DNA tworząc lepkie końce, 5'-G▼AATTC-3', tnie tworząc 3 fragmenty
HindIII - tnie tworząc 2 fragmenty
Metylazy - metylują w rozpoznawanej sekwencji 1 resztę DNA, dzięki czemu DNA bakteryjne nie jest cięte przez enzymy restrykcyjne
METYLACJA
U prokariota
Rodzaj metylacji |
Zasada metylowana |
Rozpoznawane sekwencje |
dam |
A |
GATC |
dcm |
C |
CCAGG / CCTGG |
dam - nie pokrywa miejsca metylacji
dcm - może pokrywać miejsce metylacji
U eukariota
Rodzaj metylacji |
Zasada metylowana |
Rozpoznawane sekwencje |
CpG |
C |
CpG |
Metylacja ta służy do wybierania DNA, które ma być czynne restrykcyjnie.
DNA niezmetylowane - ulega ekspresji
DNA zmetylowane - nieaktywne
Ligaza DNA - łączy końce DNA w regionach dwuniciowych. Enzym ten katalizuje tworzenie się wiązania fosfodiestrowego między grupą 3'-OH jednego końca nici DNA i grupą 5'-fosforanową na końcu drugiej nici. Do przeprowadzanie tej reakcji potrzebne jest źródło energii:
u eukariotów i archeonów - ATP
u bakterii - NAD+
Znaczenie markerów genetycznych:
endA1 - mutacja genu endonukleazy A (endonukleaza A tnie DNA) specyficznej dla DNA, zwiększająca wydajność i jakość izolowanych plazmidów (chodzi o to, żeby nasze plazmidy nie były rozcinane)
lacIq - zdolność do nadprodukcji lac represora hamującego transkrypjcę z promotorów zawierających lac operator (bo nie chcemy, żeby komórka sama transkrybowała laktozę)
recA1 - niezdolność do rekombinacji DNA; zwiększa stabilność niektórych insertów podczas propagacji wektorów (chodzi o to, żeby nasze plazmidy nie były rozcinane)
TcR - obecność genu tet, nadającego oporność na terracyklinę (tertacyklina jest markerem selekcyjnym, nietranformowane komórki nie wyrosną na płytce gdy jest ona obecna w podłożu)
Operon laktozowy:
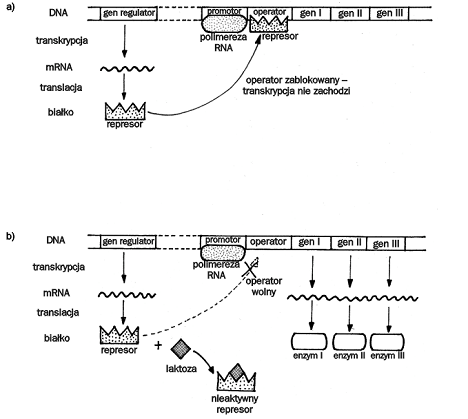
Enzym I - β-galaktozydaza
Enzym II - permeaza
Enzym III - acetylotransferaza
Aktywność enzymów restrykcyjnych zależy od:
czystości DNA - zanieczyszczenia DNA wpływające na aktywność enzymu: białka, fenol, chloroform, etanol, EDTA, SDS, wysokie stężenie soli
temperatura i czas inkubacji
dobór buforu
* Mg2+ - niezbędne do aktywności enzymu
* Tris-HCl - utrzymanie odpowiedniego pH
*Kcl/NaCl - odpowiednia siła jonowa
*BSA - stabilizacja cząsteczek białkowych, zapobieganie adhezji enzymów do probówki
*Triton X-100 - detergent, stabilizacja białek
Aktywność gwiezdna - tzw. „rozluźniona” specyficzność enzymu będąca skutkiem nie optymalnych warunków:
za duże stężenie glicerolu
zbyt wysokie pH
jeden kofaktor (Mn jest zastąpiony innym)
za długa inkubacja
zła temperatura
za duża ilość enzymu lub substratu
zbyt niska siła jonowa
Metody inaktywacji enzymu:
elektroforeza
termicznie - 80°C, 30 minut ← podstawowy sposób
chemicznie (EDTA, fenol, chloroform, EtOH)
Jednostka aktywności - taka ilość enzymu, która trawi całkowicie 1 μg charakterystycznego substratu testowego przez 1h w optymalnych warunkach podanych przez producenta.
Elektroforeza preparatywna - oczyszczenie pożądanego DNA z innych pasm DNA
Po ligacji:
wysiewamy pożądane DNA na bakterie
1) DNA superskręcone → najbardziej niebezpieczne
2) wektor + insert
3) wektor bez insertu → niebezpieczne
4) DNA liniowe
wycinami DNA z żelu
Elektroforeza: DNA
agaroza = galaktoza D + galaktoza L |+| ← |-| (bo DNA ma ładunek|-|)
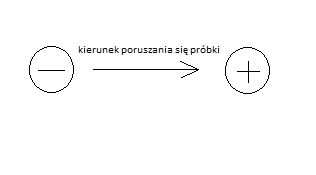
rozdział molekuł w polu elektrycznym następuje na podstawie ich wielkości, kształtu i ładunku. DNA przemieszcza się w polu elektrycznym od ujemnej elektrody katody (-) do dodatniej elektrody anody (+).
Czynniki wpływające na ruchliwość DNA kolistego/liniowego w żelu agarozowym:
długość cząsteczki DNA - im dłuższa tym wolniej migruje V=1/[log(bp)]
konformacja
* koliste superskręcone - najszybciej
*koliste - średnia prędkość
* liniowe - najwolniej
bromek etydyny - wchodzi między pary zasad (interkaluje)
* kolisty ujemnie superskręcony - bromek etydyny dodaje skręty dodatnie
7 (-) superskręconych → 7 (+) superskręconych prędkość nie zmienia się
1 (-) superskręconych → 3 (+) superskręconych prędkość zwiększa się
6 (-) superskręconych → 3 (+) superskręconych prędkość zmniejsza się
* liniowy
bromek etydyny wysłuża i usztywnia DNA, co zmniejsza prędkość
napięcie - im większe tym szybciej migrują, ale spada rozdzielczość
stężenie agarozy - im bardziej stężona tylko wolniej migrują, ale jest lepsza rozdzielczość
bufor (siła jonowa)
ELEKTROFOREZA SDS-PAGE → Elektroforeza w warunkach denaturujących (bo jest SDS)
SDS- Sodium Dodecyl Sulfate
żele:
12%- żel dolny, rozdzielający
4% - żel górny, zagęszczający
MIX = akryloamid + bisakryloamid
Bufory: UPPER
LOWER
|
Górny [ml] |
Dolny [ml] |
MIX |
0,933 |
4,00 |
UPPER |
1,75 |
- |
LOWER |
- |
2,5 |
SDS 10% [μl] |
70 |
100 |
H2O |
4,205 |
3,340 |
Bufor Tris- pH=6,8
SDS- rozfałdowanie białek, nadanie im ładunku ujemnego (-)
β-merkaptoetanol - denaturuje wiązania disiarczkowe (dodaje się go, ponieważ po lizie komórek mogą powstać mostki disiarczkowe, które są niepożądane)
Glicerol - zagęszcza próbkę, stabilizuje białka
Błękit bromofenolowy - wiąże się z białkiem, zabarwia je (żeby było je widać)
Gdy nasze białko jest przed dodaniem SDS częściowo bardzo sfałdowane, denaturyzujemy je w 90°C.
Polimeryzacja żelu poliakrylamidowego
APS - nadsiarczam amonu (NH4)2S2O8, ryboflawina
TEMED - N,N,N',N'-tetrametyloetylenodiamina;
T= ((masa akrylamidu [g] + masa bisakrylamidu [g]) / obj. Całkowita [ml]) * 100%
C= (masa bisakrylamidu / (masa akrylamidu [g] + masa bisakrylamidu [g]) ) * 100%
Układ nieciągły wg Laemlli'ego
Bufor do elektroforezy (przy elektrodach) pH=8,3, zawiera glizynę
Im mniejsza cząsteczka tym szybciej porusza się w żelu.
Skład żelu:
HCl → jony Cl- migrują najszybciej
glicyna - mogruje wolno
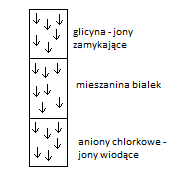
GRADIENT pH → pH rośnie, bo HCl wędruje w dół-glicyna zmienia stopień uprotonowania (glicyna z jonu obojnaczego przechodzi w jon glicynianowy), zaczyna migrować szybciej i „spycha” białka w dół „zbijając” je, żeby tworzyły cienką warstwę.
W żelu rozdzielającym glicyna zagęszcza, wyprzedza białka.
Wybarwianie żelu ( np. barwnikiem Coomassie)
metanol - rozpuszcza barwnik i wytrąca białka
kwas octowy - wiąże się z białkiem i utrwala je w żelu
Kolor białka zależy od jego pI (punktu izoelektrycznego) oraz od modyfikacji chemicznych np. glikozylacji czy fosforylacji.
EcRDBD - wiąze DNA, zawiera palce cynkowe, 8 cystein, brak wiązań disiarczkowych.