Dominika Wiechoczek 30.11.2011 r.
II Chemia biologiczna
4.Wyznaczanie punktu izoelektrycznego.
Obliczam pH roztworów buforowych z wzoru:
Nr roztworu |
Objętość kwasu [ml] |
Objętość soli [ml] |
Objętość całkowita [ml] |
Stężenie kwasu [mol/dm3] |
Stężenie soli [mol/dm3] |
pKa |
pH r-ru |
1 |
30 |
1 |
31 |
0,97 |
0,03 |
4,76 |
3,25 |
2 |
30 |
4 |
34 |
0,88 |
0,12 |
|
3,89 |
3 |
17 |
15 |
32 |
0,53 |
0,47 |
|
4,71 |
4 |
4 |
30 |
34 |
0,12 |
0,88 |
|
5,63 |
5 |
1 |
30 |
31 |
0,03 |
0,97 |
|
6,27 |
Obliczanie lepkości r-rów buforowych.
;
,
,
Nr roztworu |
|
t [s] |
|
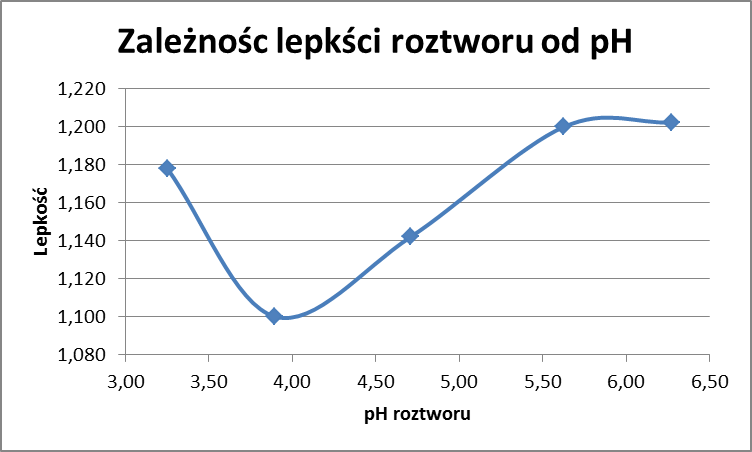
1 |
1,003 |
53,7 |
1,178 |
2 |
1,006 |
50 |
1,100 |
3 |
1,010 |
51,7 |
1,142 |
4 |
1,016 |
54 |
1,200 |
5 |
1,018 |
54 |
1,202 |
3. Omówienie wyników i wnioski.
Wartość punktu izoelektrycznego dla 1% r-ru żelatyny, odczytana z wykresu, wynosi ok 3,9, jest to bowiem wartość pH gdy lepkość roztworu jest najmniejsza. Na wykresie widzimy zależność lepkości od pH roztworu. Wartość pH dla punktu izoelektrycznego różni się od literaturowej (4,8-5,4), a tego przyczyną może być:
-mało dokładny stoper, który pokazywał z dokładnością do 1 sek
-wiskozymetr po pomiarach nie był dokładnie czyszczony, roztwór był tylko wylewany
-mój refleks
-niedokładność przy sporządzaniu roztworów buforowych, przec co pH mogło być inne niż obliczone
Wyszukiwarka