Jeżeli w kalorymetrze zachodzi jednocześnie kilka procesów o różnych efektach to oznaczona wielkość jest ich sumą:
Q = q1 + q2 + q3 + …itd.
W celu wykonania ćwiczenia posłuży nam kalorymetr diatermiczny. Jest on używany do oznaczania ciepła reakcji chemicznych w fazie ciekłej. Osłonę zewnętrzną kalorymetru stanowi naczynie Dewara (termos), które ma na celu zmniejszyć wymianę ciepła między kalorymetrem a otoczeniem.
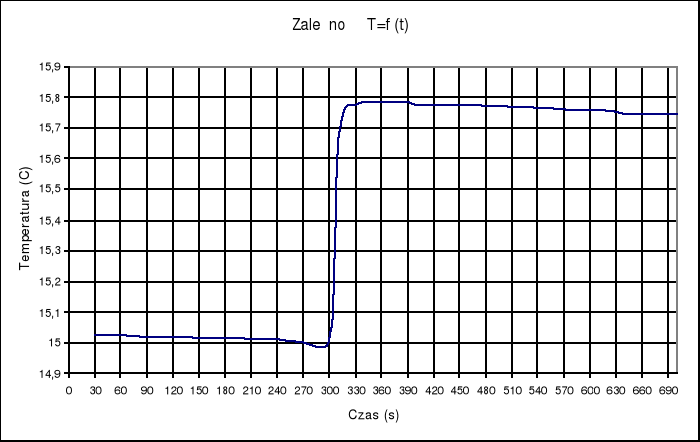
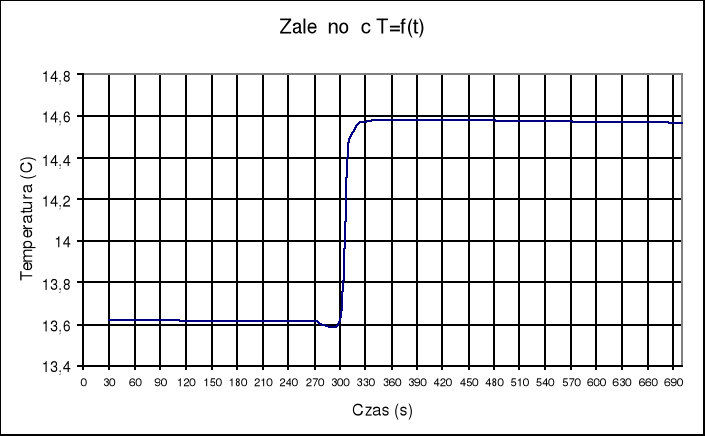
Sposób wykonania doświadczenia: W naczyniu Dewara umieszczam odmierzoną ilość wody (600 ml). W uchwycie umieszczamy szklaną ampułkę Nr 1 ze znaną ilością kwasu siarkowego( 5,89 g). Przykręcamy mieszadełko, które spowoduje, że temperatura cieczy wszędzie będzie taka sama. Umieszczamy sondę pomiarową w przeznaczonym na nią miejscu. Po zmontowaniu całego urządzenia wykonujemy 10 pomiarów co 30 sekund. Następnie tłuczemy ampułkę tak, aby kwas siarkowy zmieszał się z wodą. Kolejne 10 pomiarów odczytujemy co 10 sekund, a następne 10 co 30 sekund. Zmiany rezystancji termistora zapisuje w tabeli. W drugiej części ćwiczenia przygotowuję ampułkę szklaną z odważonym Na2S2O3 (3,08 g) i topię ją w naczyniu z gotującą wodą. Następnie delikatnie schładzam pod zimną wodą. Tak przygotowaną ampułkę z przechłodzonym tiosiarczanem umieszczam w układzie kalorymetrycznym. Do naczynia Dewara wlewam znaną ilość wody (600ml). Odczytuje wskazania termistora co 30 sekund. Wrzucam do ampułki mały kryształek tiosiarczanu, aby zapoczątkować proces krzepnięcia. Odczytuje rezystancję co 10 sekund, a następnie co 30 sekund. Zmiany rezystancji zapisuje w tabeli
Część I
Oznaczanie pojemności cieplnej układu:
DANE:
Waga ampułki Nr 1 pustej - 17,11 g
Waga ampułki Nr 1 z reagentem - 23,00 g
Masa - H2SO4 23,00 - 17,11 =5,89 g
Sonda pomarańczowo - niebieska -B=3814 [deg]
R25 = 14,24 [kΩ]
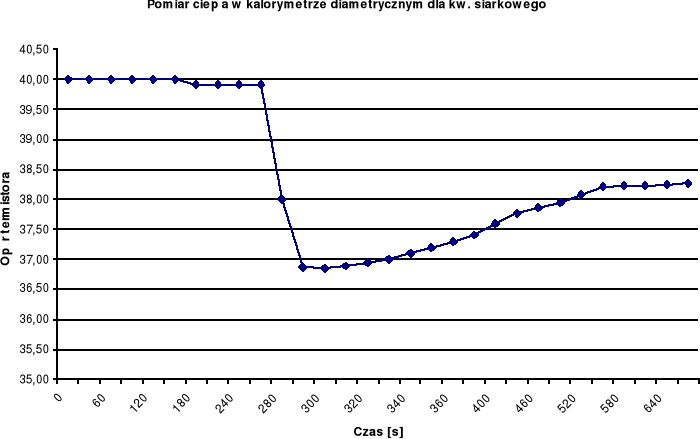
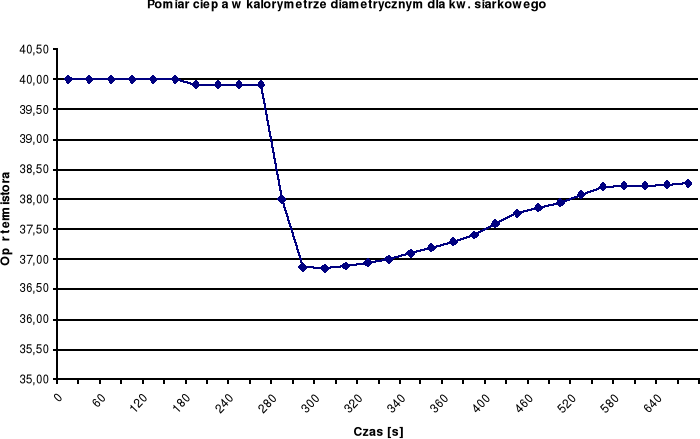
Tabela rezystancji termistora RT dla ampułki Nr1 oraz obliczonej temperatury środowiska.
Okres początkowy (co 30 sek) |
Okres główny (co 10 sek) |
Okres końcowy (co 30 sek) |
||||
Lp |
[kΩ] |
°C |
[kΩ] |
°C |
[kΩ] |
°C |
1 |
40,00 |
2,80 |
38,00 |
3,82 |
37,60 |
4,04 |
2 |
40,00 |
2,80 |
36,87 |
4,43 |
37,77 |
3,95 |
3 |
40,00 |
2,80 |
36,86 |
4,44 |
37,87 |
3,89 |
4 |
40,00 |
2,80 |
36,89 |
4,42 |
37,95 |
3,85 |
5 |
40,00 |
2,80 |
36,95 |
4,39 |
38,07 |
3,79 |
6 |
40,00 |
2,80 |
37,01 |
4,36 |
38,21 |
3,71 |
7 |
39,90 |
2,85 |
37,10 |
4,31 |
38,22 |
3,71 |
8 |
39,90 |
2,85 |
37,20 |
4,25 |
38,23 |
3,70 |
9 |
39,90 |
2,85 |
37,29 |
4,20 |
38,25 |
3,69 |
10 |
39,90 |
2,85 |
37,40 |
4,14 |
38,26 |
3,69 |
Wykorzystując podane wartości stałych B i R25 dla używanej sondy temperaturę środowiska obliczałam wg wzoru - T= B/(ln RT - ln R25 +B/ 298,15)-273,15
Przykładowo:
T=3814 / ( ln 40 - ln 14,29 +3814 / 298,15 )-273,15 = 2,80
Na podstawie zanotowanych wskazań rezystancji termistora RT wykonuję wykres w układzie osi RT = f(czas)
Obliczam ilość moli wody:
1000 ml --- 55,5 mola wody
600 ml --- x
x = 33,3 mola wody
Obliczam liczbę moli kwasu siarkowego
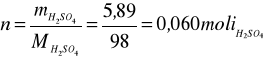
Na 1 mol kwasu siarkowego przypada 555 moli wody. Znając molowe ciepła rozpuszczania kwasu w zależności od rozcieńczenia można określić ciepło jakie powstało w reakcji:
Qrozp.≈ 76,80 ![]()
Wartość (Δt + ∑v) można wyznaczyć graficznie, ale tą sumę można wyliczyć z zależności:
(Δt + ∑v)= TII - TI
gdzie: TI - końcowa temperatura okresu początkowego
TII - początkowa temperatura okresu końcowego
(Δt + ∑v)= TII - TI = 4,04 - 2,85 = 1,19K
Obliczam stałą pojemność cieplną kalorymetru ze wzoru:
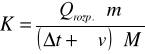
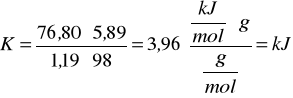
Część II
Pomiar ciepła krzepnięcia pięciowodnego tiosiarczanu:
DANE:
Masa Na2S2O3 * 5H2O =3,08 g
Tabela rezystancji termistora dla ampułki ze stopionym tiosiarczanem
Okres początkowy (co 30 sek) |
Okres główny (co 10 sek) |
Okres końcowy (co 30 sek) |
||||
Lp |
[kΩ] |
°C |
[kΩ] |
°C |
[kΩ] |
°C |
1 |
44,6 |
0,64 |
44,2 |
0,82 |
43,9 |
0,95 |
2 |
44,6 |
0,64 |
44,1 |
0,86 |
43,8 |
1,00 |
3 |
44,6 |
0,64 |
44,1 |
0,86 |
43,8 |
1,00 |
4 |
44,6 |
0,64 |
44 |
0,91 |
43,8 |
1,00 |
5 |
44,6 |
0,64 |
44 |
0,91 |
43,7 |
1,04 |
6 |
44,5 |
0,68 |
44 |
0,91 |
43,7 |
1,04 |
7 |
44,5 |
0,68 |
43,9 |
0,95 |
43,7 |
1,04 |
8 |
44,5 |
0,68 |
43,9 |
0,95 |
43,7 |
1,04 |
9 |
44,5 |
0,68 |
43,9 |
0,95 |
43,7 |
1,04 |
10 |
44,4 |
0,73 |
43,9 |
0,95 |
43,7 |
1,04 |
Wyznaczam ilość ciepła mierzonego w procesie krzepnięcia:
![]()
(Δt + ∑v)= 0,4K
Qmierz=3,96 *0,4 =1,58 kJ
Obliczam liczbę moli tiosiarczanu:
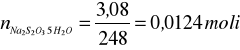
Molowe ciepło procesu:
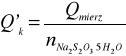
=127,42![]()
Obliczam molowe ciepło krzepnięcia zgodnie z równaniem Kirhoffa:
Wnioski
Proces zobojętniania mocnej zasady za pomocą mocnego kwasu jest w istocie relacją pomiędzy jonami H+ a OH- z utworzeniem słabo zdysocjowanej cząsteczki wody:
H+ + OH- → H2O
Efekt cieplny tej reakcji wynosi około 13,7 kcal (57359). Wielkość ta praktycznie jest niezależna od rodzaju mocnej zasady i mocnego kwasu.
W ćwiczeniu został użyty słaby kwas, który w stanie równowagi pozostaje mieszaniną kwasu, jonów wodorowych oraz sprzężonej z tym kwasem zasady:
H2SO4 → 2H+ +SO42-
Jeżeli w procesie zobojętniania zostanie użyta słaba zasada lub słaby kwas, to obserwowany efekt cieplny różni się znacznie od powyższej wartości, jaka jest podana dla mocnego kwasu i mocnej zasady. Wynika to stąd, że podczas zobojętniania słabego kwasu musi towarzyszyć proces dysocjacji tego kwasu.
Ampułka z kwasem w roztworze wodorotlenku sodu:
Wyszukiwarka