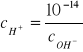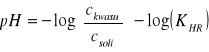Janowski Konrad
Wydział Metali Nieżelaznych Kraków, 2002.11.07
Inżynieria Materiałowa
Rok: II. Grupa: 3
Sprawozdanie
Ćwiczenie 14:Indykatory.Roztwory buforowe. Kalorymetryczne oznaczenie pH.
1.Wprowadzenie
a)
Iloczyn jonowy wody; pH
W temperaturze pokojowej iloczyn jonowy wody wynosi:
![]()
Stężenia są wyrażone w gramojonach na litr roztworu. Równanie spełniają zarówno kwaśne, jak i alkaliczne rozcieńczone roztwory wodne.
Stężenia jonów wodorowych w roztworach wodnych są często o szereg rzędów wielkości mniejsze od 1. Wiążą się z tym niedogodności zapisu i możliwości pomyłek. Dla uproszczenia zapisu Sörrensen zaproponował, aby stężenie jonów wodorowych wyrażać przez jego ujemny logarytm tzw. pH:
![]()
Podobnie zamiast stężenia jonów hydroksylowych ![]()
, stałych dysocjacji elektrolitów K, iloczynu jonowego wody ![]()
i iloczynu rozpuszczalności I, podaje się często wartości ich ujemnych logarytmów: pOH, pK, ![]()
, pI.
b)
Indykatory
Indykatory to substancje, których barwa lub jej odcień zależy od pH środowiska. Własność tę można w większości wypadków wyjaśnić przyjmując, że są to słabe kwasy, które w stanie nie zdysocjowanym posiadają inną barwę niż ich aniony. W roztworach ulegają one dysocjacji
![]()
Jak wynika z powyższego równania, dysocjacja - a więc i pośrednio zabarwienie indykatora wprowadzonego do roztworu kwasu, zasady lub soli - jest zależna od stężenia jonów wodorowych w tym roztworze. Umożliwia to wyznaczenie stężenia jonów wodorowych, a także pH, metodą kolorymetryczną. Każdy indykator posiada swój charakterystyczny zakres pH, w którym następuje zmiana barwy, od odpowiadającej praktycznie zupełnej dysocjacji do praktycznie całkowitej asocjacji indykatora. W tabeli poniżej zestawionych jest kilka ważniejszych indykatorów wraz z podaniem zakresu pH, w którym zmieniają barwę.
Nazwa indykatora |
Barwa indykatora w roztworze |
|||
|
w pH |
|
w pH |
|
Tropeolina OO |
Czerwona |
1.4 |
żółta |
2.6 |
Czerwień Kongo |
Niebieska |
3.0 |
czerwona |
5.2 |
Metyloranż |
Czerwona |
3.1 |
żółta |
4.4 |
Zieleń bromokrezolowa |
Żółta |
3.8 |
niebieska |
5.4 |
Purpura bromokrezolowa |
Żółta |
5.2 |
fioletowa |
6.8 |
Błękit bromokrezolowy |
Żółta |
6.0 |
niebieska |
7.6 |
Czerwień fenolowa |
Żółta |
6.8 |
czerwona |
8.4 |
Fenoloftaleina |
bezbarwna |
8.3 |
czerwona |
10.0 |
Tymoloftaleina |
bezbarwna |
9.2 |
niebieska |
10.5 |
c)
Roztwory buforowe
Biorąc pod uwagę dowolny słaby kwas jodnozasadowy (np. octowy), o wzorze HR. W roztworze wodnym kwas ulega dysocjacji elektrolitycznej według równania:
![]()
Stosując do tej reakcji prawo działania mas otrzymuje się:
![]()
Stała ![]()
w równaniu nosi nazwę stałej dysocjacji kwasu. Kwas HR, jako słaby, jest zdysocjowany w niewielkim stopniu, natomiast jego sole z silnymi zasadami (np. Na, K) ulegają bardzo daleko posuniętej dysocjacji. Więc jeżeli do roztworu tego kwasu wprowadzi się jeszcze pewną ilość jego soli z mocną zasadą, to wprowadzając duży nadmiar jonów ![]()
dysocjacja kwasu cofnie się jeszcze bardziej. Wówczas stężenie kwasu nie zdysocjowanego jest praktycznie równe całkowitemu (analitycznemu) stężeniu kwasu ![]()
![]()
Ponieważ sól, , jest praktycznie całkowicie zdysocjowana, , stężenie jonów ![]()
równa się stężeniu soli:
![]()
Równanie 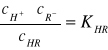
można napisać: ![]()
Stąd:
![]()
oraz ![]()
Z równania (wyżej przyjmując założenia upraszczające) wynika, że jeżeli znana jest stała dysocjacji jakiegoś słabego kwasu, to można obliczyć pH roztworu tego kwasu i jego soli z silną zasadą (konieczna jest również znajomość analitycznych stężeń soli i kwasu).
Wartość pH takich roztworów nie zależy od stężeń soli i kwasu, lecz od ich stosunku, czyli pH nie zmieni się praktycznie w czasie rozcieńczania. Takie roztwory to roztwory buforowe. Posiadają one również tę właściwość, że po dodaniu niewielkiej ilości silnego kwasu lub zasady pH ulegają jedynie nieznacznym zmianom oraz że zmiana temperatury wpływa nieznacznie na pH takich roztworów. Równanie opisuje prawidłowo zależności występujące w układach buforowych jedynie w tych zakresach stosunków stężeń, w których są spełnione założenia upraszczające. Obok kwaśnych buforów istnieją bufory zasadowe, których składnikami są: słaba zasada BOH oraz sól tej zasady z mocnym kwasem.
pH tych roztworów określa równanie:
![]()
2.Cel ćwiczenia
1.Kolorymetryczne określenie pH otrzymanych do zbadania roztworów z dokładnością do +-0,2 jednostki.
2.Sprawdzenie stosowalności wzorów:
![]()
![]()
dla różnych buforów w podanym zakresie stężeń.
3.Obliczenie zmian pH podczas dodawania ługu sodowego do roztworów kwasów solnego i octowego o tym samym stężeniu początkowym.
3.Metoda pomiaru
1.Celem uzyskania danych potrzebnych do wyliczenia szukanych wielkości należy wykonać pomiar stężenia jonów wodorowych .Pomiar ten będzie wykonany w ćwiczeniu metodą kolorymetryczną przy użyciu skali buforowej
4.Opracowanie wyników
Próbka 1: roztwór badany
Próbka 2: woda wodociągowa
Próbka 3: woda destylowana
Nr próbki roztworu |
Indykator |
Zabarwienie indykatora w badanym roztworze |
Wniosek co do pH |
|
1 , 2 i 3 |
Tropeolina OO |
jasne żółte |
|
|
|
Metyloranż |
żółte kanarkowe |
|
|
|
Zieleń bromokrezolowa |
blado niebieskie |
|
|
|
Purpura bromokrezolowa |
jasno fioletowe |
|
|
|
Błękit bromotymolowy |
jasna zieleń |
6.0-7.6 |
|
|
Czerwień fenolowa |
czerwona |
|
|
|
Fenoloftaleina |
bezbarwne |
|
|
|
Tymoloftaleina |
Bezbarwne |
|
|
|
6.0 |
|||
Przebadano zachowywanie się indykatorów w roztworach 1n HCl oraz 0,1n NaOH w celu potwierdzenia danych zawartych w tabeli zamieszczonej we wstępie.
Po dodaniu kolejnych indykatorów do badanej próbki z roztworem zadanym, stwierdzono ze jego pH mieści się w przedziale pH Błękitu bromotymolowego które wynosi od 6.0 do 7.6. Znając już przybliżoną wartość pH należy sporządzić odpowiednią skalę buforową za pomocą której określimy dokładniej wartość pH. W naszym przypadku jest to bufor fosforanowy którego to zadajemy indykatorem-błękit bromotymolowy i porównujemy rezultaty z naszymi trzema próbkami.
Wartość dokładna szukanego pH roztworu zadanego wynosi 7.4. Natomiast wody wodociągowej 7.2 a wody destylowanej 6.2.
|
1 |
2 |
3 |
4 |
5 |
|||||
|
c1 Kwas winowy c2 Winian jednosodowy |
C1 Kwas mlekowy c2 Mleczan sodu |
c1 Kwas octowy c2 Octan sodu |
c1 Fosforan sodu I rzędowy c2 Fosforan sodu II rzędowy |
c1 Chlorek amonu c2 Amoniak |
|||||
|
|
pH |
|
pH |
|
pH |
|
pH |
|
pH |
|
6*10-5 |
4.2 |
1*10-5 |
5.0 |
1.2*10-6 |
5.9 |
1*10-8 |
8.0 |
2*10-11 |
10.7 |
|
2.5*10-4 |
3.6 |
3.7*10-5 |
4.4 |
5*10-6 |
5.3 |
5*10-8 |
7.3 |
8*10-11 |
10.1 |
|
1*10-3 |
3.0 |
1.5*10-4 |
3.8 |
2*10-5 |
4.7 |
2*10-7 |
6.7 |
3.2*10-10 |
9.5 |
|
4*10-3 |
2.4 |
6*10-4 |
3.2 |
7.4*10-5 |
4.1 |
8*10-7 |
6.1 |
1.3*10-9 |
8.9 |
|
2.4*10-2 |
1.7 |
2.4*10-3 |
2.6 |
3.2*10-4 |
3.5 |
3*10-6 |
5.5 |
5*10-9 |
8.3 |
W celu sprawdzenia stosowalności przybliżonych wzorów:
![]()
![]()
wykreślono charakterystyki 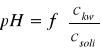
, których liniowość ma świadczyć o ich poprawności.
Wykreślone charakterystyki zgodnie z oczekiwaniami mają przebieg liniowy, zatem możliwym jest wyznaczenie stałej dysocjacji. Z ogólnego równania prostej y=ax+b wnioskujemy, iż współczynnik b odpowiada stosownej wartości we wzorach.
Wartości stałych dysocjacji składników buforów obliczono z odpowiednich wzorów, dostrzegając analogię pomiędzy tymiż wzorami, a ogólną postacią równania prostej.
![]()
![]()
![]()
,
stąd skoro 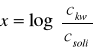
![]()
- dla buforów kwaśnych
![]()
- dla buforów zasadowych
![]()
1 |
2 |
3 |
4 |
5 |
Kkwasu winowego |
Kkwasu mlekowego |
Kkwasu octowego |
Kfosforanu sodu |
Kchlorku amonu |
1,047*10-3 |
1,58*10-4 |
2,0*10-5 |
1,91*10-7 |
7,41*10-5 |
5.Zmiany pH podczas miareczkowania:
a:)100 ml 0,1 n HCl miareczkowanego 0,1 n NaOH (wykres)
Błąd! Nieprawidłowe łącze. Ilość g jonów H+ w roztworze:
Gdy VNaOH<100 [ml]:
0,1n HCl - 1000 [ml] x - 100 - VNaOH [ml] Gdy VNaOH=100 [ml] wtedy ta objętość ługu zobojętni 100ml HCl, zatem pH=7, a ilość jonów H+=0,0000001.
Gdy VNaOH>100[ml]:
Liczymy ilość jonów OH- z poniższej proporcji:
0,1n NaOH - 1000 [ml] x - VNaOH - 100 [ml]
Stężenie jonów wodorowych:
gj - V CH+ - 1000 [ml]
gdzie: gj - ilość jonów H+ w roztworze (lub OH-); V - objętość roztworu; CH+ - stężenie jonów wodorowych. Jeżeli zamiast ilości g jonów H+ wstawiamy ilość jonów OH- w wyniku otrzymujemy stężenie jonów OH-, zatem stężenie jonów H+ jest równe Obliczanie pH:
b)100 ml 0,1 n CH3COOH miareczkowanego 0,1 n NaOH
Błąd! Nieprawidłowe łącze. Obliczanie gramorównoważnika kwasu zgodnie z proporcjami A.
0,1n CH3COOH - 1000 [ml] gr (kwasu) - 100 - VNaOH [ml]
Obliczanie gramorównoważnika soli:
0,1n NaOH - 1000 [ml] gr (soli) - VNaOH [ml] Obliczanie stężenia kwasu:
gr (kwasu) - objętość roztworu ckwasu - 1000 [ml]
Obliczanie stężenia soli:
gr (soli) - objętość roztworu csoli - 1000 [ml]
Obliczanie pH:
|
6.Wnioski
W ćwiczeniu tym wykonywaliśmy kolorymetryczne określenie pH otrzymanych roztworów (woda destylowana oraz woda wodociągowa) z dokładnością do ![]()
jednostki. W tym celu najpierw należało wyznaczyć przybliżoną wartość pH tych roztworów. I tak odpowiednio dla wody destylowanej pH mieściło się w zakresie 4.4 - 5.2, a dla wody wodociągowej 6.4 - 7.6 Wyznaczyliśmy wartość pH wody destylowanej - pH = 5.2, natomiast wody wodociągowej 7.2 jedynie dalszą metodą kolorymetryczną tworząc wyszczególnione bufory z przedziału wyszczególnionego .Posługując się danymi doświadczalnymi(tab.14.2) oraz wykresami zależności: pH=f ( log CKw / Csól) i pH = f ( log Czas/Csól)
sprawdziliśmy stosowalność wzorów
![]()
![]()
i stwierdziliśmy ich zadawalającą zgodność z danymi tzn. LINIOWOŚĆ.
Na tej podstawie wyznaczyliśmy stałe dysocjacji kwasów i zasad składników buforów.
Orientując się w zmianie pH miareczkowaliśmy 100 ml 0,1 n HCl i 100 ml CH3COOH 0,1n roztworem NaOH
celem odnalezienia indykatora którego używa się przy analitycznym oznaczaniu stężeń kwasu solnego i octowego. tak więc dla CH3COOH indykatorem jest Fenoloftaleina Tymoloftaleina,a dla HCl Metyloranż lub Purpura bromokrezolowa.
Wyszukiwarka