Węglowodory
Węglowodory klasyfikuje się ze względu na formę połączenia się atomów węgla (łańcuch lub pierścień) oraz na rodzaj wiązań występujących w cząsteczce. Na tej podstawie dzieli się je na węglowodory alifatyczne i aromatyczne.
Węglowodory alifatyczne (alkile), zbudowane są z łańcuchów lub pierścieni węglowych. Dzieli się je ze względu na rodzaj występujących w cząsteczce wiązań. Porównując ich aktywność należy zwrócić uwagę na występowanie bardzo trwałych wiązań atomowych między atomami węgla, jak również między atomami węgla i wodoru, które także mieszczą się w kategorii wiązań atomowych (ponieważ różnica elektroujemności tych pierwiastków wynosi 0,4). O aktywności węglowodorów decyduje pojawienie się wiązania wielokrotnego, które stanowi miejsce zachodzenia reakcji chemicznych.
Alkany - węglowodory łańcuchowe lub pierścieniowe, w cząsteczkach których występują wyłącznie wiązania pojedyncze (sigma). Są to węglowodory nasycone (parafiny).
Alkeny - węglowodory łańcuchowe lub pierścieniowe, w cząsteczkach których występują wiązania pojedyncze i jedno podwójne (pi). Są to węglowodory nienasycone (olefiny).
Alkiny - węglowodory łańcuchowe lub pierścieniowe, w cząsteczkach których występują wiązania pojedyncze i wiązanie potrójne (dwa wiązania pi). Są to węglowodory nienasycone (olefiny).
Alkany
Stanowią punkt wyjścia do otrzymywania dalszych typów związków. W przypadku alkanów szereg homologiczny opisuje wzór ogólny CnH2n+2. Różnicę homologiczną stanowi grupa metylenowa (-CH2-).Zapis strukturalny alkanów jest kwestią umowną, ponieważ atomy węgla w połączeniach wykazują hybrydyzację sp3 (każdy atom węgla tworzy cztery wiązania sigma i staje się centrum tetraedru). Cztery pierwsze alkany to gazy (surowce w syntezach chemicznych i paliwa), dalej do piętnastego to ciecze (paliwa) i powyżej to substancje stałe (smary).
Oto nazwy, wzory sumaryczne i strukturalne pierwszych dziesięciu alkanów:
Liczba |
Wzór |
Nazwa |
Wzór strukturalny alkanu |
1 |
CH4 |
metan |
|
2 |
C2H6 |
etan |
|
3 |
C3H8 |
propan |
|
4 |
C4H10 |
butan |
|
5 |
C5H12 |
pentan |
|
6 |
C6H14 |
heksan |
|
7 |
C7H16 |
heptan |
|
8 |
C8H18 |
oktan |
|
9 |
C9H20 |
nonan |
|
10 |
C10H22 |
dekan |
|
n |
CnH2n+2 |
alkan |
Alkany otrzymuje się na skalę przemysłową w wyniku destylacji ropy naftowej. Otrzymuje się wówczas różne frakcje, z których do najważniejszych należy frakcja benzynowa złożona głównie z węglowodorów ciekłych. Aby zwiększyć udział tej frakcji w przetwórstwie ropy stosuje się dwa szczególne procesy: kraking, polegający na rozłamywaniu dłuższych łańcuchów węglowych na ośmioczłonowe (właściwe dla benzyn), oraz reforming, który polega na otrzymywaniu łańcuchów rozgałęzionych. Takie węglowodory posiadają wyższą liczbę oktanową (określającą odporność na niekontrolowany samozapłon paliwa) i tym samym nie wymagają stosowania innych substancji antystukowych, takich jak tetraetyloołów czy benzen.
Otrzymuje się je także poprzez :
uwodornienie węglowodorów nienasyconych : CnH2n + H2→ CnH2n+2
dekarboksylację kwasów karboksylowych: RCOOH→ RH + CO2
syntezę Würtza : 2R-X + 2Na → R-R + 2NaX
Metan :
Otrzymywanie:
w wyniku działania kwasem solnym (lub wodą) na węglik glinu :
Al4C3 + 12HCl → 4AlCl3 + 3CH4 (↑)
rozkład termiczny mieszaniny stałego octanu sodu i wodorotlenku sodu : CH3COONa + NaOH → Na2CO3 + CH4 (↑)
Właściwości fizyczne: gaz bezbarwny, bezwonny, lżejszy od powietrza, nierozpuszczalny w wodzie (metan jest niepolarny), rozpuszcza się w benzenie (benzen to wzorcowy rozpuszczalnik apolarny).
Właściwości chemiczne: mała aktywność chemiczna ze względu na występujące w cząsteczkach alkanów wiązania kowalencyjne typu sigma.
Ulegają reakcji spalania na trzy sposoby :
Spalanie całkowite: CH4 +2O2→ CO2 + 2H2O
Półspalanie: CH4 + 1,5O2→ CO + 2H2O
Spalanie niecałkowite: CH4 + O2→ C + 2H2O
Reagują z fluorowcami ulegając reakcji substytucji (podstawiania). Reakcja zachodzi stopniowo podstawiając każdy z atomów wodoru. Powstają fluorowcopochodne oraz odpowiednie fluorowcowodory:
CH4 + Cl2 → CH3Cl + HCl chlorometan
CH3Cl + Cl2 → CH2Cl2 + HCl dichlorometan
CH2Cl2 + Cl2 → CHCl3 + HCl trichlorometan
CHCl3 + Cl2 → CCl4 + HCl tetrachlorometan
Reakcja substytucji jest typowa dla alkanów!
Fluorowcopochodne są punktem wyjścia do innych ważnych połączeń:
Substytucja fluorowca grupą hydroksylową w środowisku wodnym. Powstaje alkohol : CH3Cl + NaOH → CH3OH + NaCl
Reakcja z zasadą w środowisku alkoholowym- eliminacja fluorowodoru: CH3-CH2Cl + NaOH → CH2=CH2 + NaCl + H2O
Difluorowcopochodne reagując z metalami aktywnymi tworzą alkeny (eliminacja fluorowca) :
CH2Cl-CH2Cl + Zn→ CH2=CH2 + ZnCl2
Synteza Würtza : 2CH3Cl + 2Na→ CH3-CH3 + 2NaCl
Alkilowanie - podstawienie rodnika alkilowego:
CH3-CH2-CHCl-CH3 + CH4 → CH3-CH2-CH(CH3)-CH3 + HCl
Nie dają charakterystycznych reakcji odbarwiania wody bromowej i zakwaszonego roztworu manganianu(VII)potasu.
Nazewnictwo: nazwy alkanów pochodzą od liczebników greckich lub łacińskich określających ilość atomów węgla w cząsteczce, z zastosowaniem, typowej dla alkanów, końcówki -an. Przy tworzeniu nazw systematycznych wg nomenklatury genewskiej należy pamiętać o:
Wybraniu najdłuższego łańcucha węglowego
Atomy węgla numerujemy tak, by podstawniki miały możliwie najniższe lokanty
Podstawniki podajemy w porządku alfabetycznym, jeżeli występuje kilka takich samych podstawników to podaje się lokant każdego z nich, a następnie odpowiednim przedrostkiem potwierdza się ich ilość (di, tri itd.)
Numery lokantów, nazwy kolejnych podstawników rozdziela się myślnikami
Właściwości fizykochemiczne: Izomeria - zjawisko występowania różnych związków chemicznych o identycznym składzie pierwiastkowym.
Węglowodory nasycone ulegają izomerii łańcuchowej lub ewentualnie izomerii optycznej (związanej ze zdolnością do skręcania płaszczyzny światła spolaryzowanego przez substancje nieposiadające żadnego elementu symetrii).
Alkeny
To grupa węglowodorów alifatycznych, w cząsteczkach których występuje wiązanie podwójne. Pojawienie się tego wiązania (a dokładnie pi) oznacza większą aktywność tych węglowodorów. Wzór ogólny szeregu homologicznego alkenów to CnH2n. Pierwszy w szeregu związek musi posiadać dwa atomy węgla, gdyż tylko wówczas może wystąpić wiązanie wielokrotne.
Otrzymywanie alkenów:
Odwodornienie węglowodorów nasyconych w reakcji eliminacji przy użyciu katalizatora (Ni, Pd, Pt) : C3H8 → C3H6 + H2
Odwodornienie alkoholi w obecności Al2O3 :
CH3- CH2-OH → CH2=CH2 + H2O
Eliminacja sąsiednich atomów fluorowca:
CH2Cl-CH2Cl + Zn→ CH2=CH2 + ZnCl2
Eliminacja halogenowodoru w obecności alkoholu:
CH3-CH2Cl + KOH → CH2=CH2 + KCl + H2O
Eten
Otrzymywanie: na skalę laboratoryjną eten otrzymuje się przez odwodornienie etanolu w obecności kaolinu (Al2O3) :
CH3- CH2-OH → CH2=CH2 + H2O
Właściwości fizyczne: gaz bezbarwny, bezwonny, gęstość zbliżona do powietrza, cząsteczka płaska (gdyż wzdłuż podwójnego wiązania węgiel-węgiel nie następuje rotacja) i apolarna (nie rozpuszcza się w wodzie), rozpuszcza się w benzenie, atomy węgla o hybrydyzacji sp2, którą cechuje kształt trygonalny, płaski z kątem między wiązaniami 120˚.
Właściwości chemiczne:
Ulegają reakcji spalania(w zależności od ilości dostarczonego tlenu):
Spalanie całkowite: C2H4 +3O2→ 2CO2 + 2H2O
Spalanie niecałkowite: C2H4 + O2→ 2C + 2H2O
Nie ulegają półspalaniu
Reagują z fluorowcami ulegając reakcji addycji (przyłączenia). Chcąc ustalić miejsce postawienia atomów stosuje się regułę Markownikowa, zgodnie z którą wodór zostaje podstawiony do atomu węgla przy którym jest więcej atomów wodoru: CH3-CH=CH2 + HCl → CH3-CHCl-CH3
Zdolność do odbarwiania wody bromowej :
Zdolność do odbarwienia zakwaszonego roztworu manganianu(VII) potasu:
Reakcja addycji wody w obecności Al2O3
Reakcja addycji wodoru (uwodornienie w obecności katalizatora)
Reakcje polimeryzacji (kosztem pękania wiązań wielokrotnych), to znaczy małe cząsteczki, tzw. monomery, w wyniku pękania wiązań pi stają się dwuwartościowymi rodnikami, które łącząc się ze sobą tworzą duże cząsteczki zwane polimerami.
Ulegają reakcji spalania:
Spalanie całkowite: 2C2H2 +5O2→ 4CO2 + 2H2O
Spalanie niecałkowite: 2C2H2 + O2→ 4C + 2H2O
Nie ulegają półspalaniu
Zdolność do odbarwiania wody bromowej :
Reakcje polimeryzacji jest to zachowanie typowe dla węglowodorów nienasyconych. Szczególnie ważna jest reakcja trymeryzacji (gdyż połączą się trzy mole) acetylenu, która prowadzi do benzenu, głównego przedstawiciela węglowodorów aromatycznych.
Synteza Kuczerowa (Reakcja hydratacji alkinów). Uwodnienie 1- alkinów prowadzi do aldehydów, zaś pozostałych do ketonów.
CH2=CH2 + Cl2 → CH2Cl-CH2Cl
CH2=CH2 + Br2 → CH2Br-CH2Br
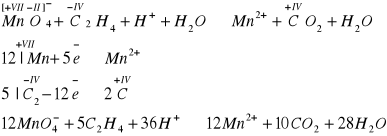
CH2=CH2 + H2O→ CH3- CH2-OH
CH2=CH2 + H2→ CH3- CH3
Etap I - pękanie wiązania pi ![]()
Etap II - tworzenia polimeru n [-CH2-CH2-]![]()
→ [-CH2-CH2-]n
Właściwości fizykochemiczne: układ dwóch atomów węgla o hybrydyzacji sp2 może być powodem wystąpienia tzw. izomerii geometrycznej (cis-trans). Izomery te rozróżnia się na podstawie położenia podstawników. CH3 H CH3 CH3
\ / \ /
C=C trans-but -2-en C = C cis-but-2-en
/ \ / \
H CH3 H H ____________________________________________________________
Alkiny
To węglowodory alifatyczne posiadające w cząsteczce wiązanie potrójne, tak więc wzór ogólny szeregu homologicznego tych węglowodorów ma postać CnH2n-2. każdy z atomów węgla tworzy dwa wiązania sigma, wiec ulega hybrydyzacji sp1. Pierwszy w szeregu etyn (lub etin) znany jest również pod bardzo popularną nazwą zwyczajową acetylen.
Acetylen
Otrzymywanie: reakcja karbidu z wodą : CaC2 +2H2O → Ca(OH)2 + C2H2
Właściwości fizyczne: gaz bezbarwny, bezwonny (otrzymany z karbidu posiada charakterystyczny zapach), nieco lżejszy od powietrza, nie rozpuszcza się w wodzie (apolarny), dwa wiązania pi (bardziej aktywny od alkenów).
Właściwości chemiczne:
B. Reagują z fluorowcami ulegając reakcji addycji (przyłączenia).
C2H2+HCl→ C2H3Cl
CH≡CH + Br2 → CHBr=CHBr
D. Odbarwianie zakwaszonego roztworu manganianu(VII) potasu:
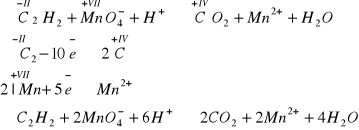
Reakcja uwodnienia acetylenu, powstaje aldehyd octowy
C2H2+H2O ![]()
CH3-CHO
Reakcja uwodornienia but-2-inu powstaje keton (butanon)
CH3-C≡C-CH3 + H2O ![]()
CH3-CH2- C -CH3
||
O
Właściwości fizykochemiczne : alkiny są izomerami cykloalkenów i alkadienów
Wyszukiwarka