PK WIiTCh GR. 34 Zespół nr 1 |
Ćwiczenie: 11 |
Data: 11.01.2001 |
1. Mielnik Michał 2. Mierzwa Rafał 3. Rynduch Zygmunt |
Temat: Wyznaczanie stałej szybkości reakcji zmydlania estru metodą konduktometryczną |
Ocena: |
Wstęp teoretyczny.
Hydroliza estrów jest reakcją katalizowaną kwasami lub zasadami. Reakcja katalizowana kwasami jest odwracalna, w obecności kwasów prowadzi się przecież syntezę estrów z kwasów i alkoholi. Natomiast zasady nie tylko katalizują hydrolizę, ale w ilościach stechiometrycznych są zużywane w reakcji:
CH3COOC2H5 + KOH = CH3COOK + C2H5OH
Podczas reakcji ilość jonów w roztworze jest stała. Jony OH- zastępowane są przez jony octanowe. Te dwa rodzaje jonów różnią się ruchliwością. Jony OH- wykazują bardzo wysoką ruchliwość. Zastąpienie ich jonami octanowymi powoduje znaczne zmniejszenie przewodnictwa elektrycznego roztworu. Stanowi to podstawę metody pomiaru wykorzystywanej w ćwiczeniu.
O przewodnictwie elektrycznym roztworu decyduje obecność jonów. Na początku reakcji w mieszaninie będą tylko jony OH- i K+ w stężeniu równym początkowym stężeniom.
Przewodnictwo właściwe κ będzie równe:
![]()
gdzie:
λ - przewodnictwo graniczne,
C0 - stężenie początkowe.
Zadania do wykonania.
Wyznaczyć stałą C, czyli przewodnictwo właściwe w czasie t = ∞
Sporządzić wykres 1/(B-C) od czasu t, gdzie B - przewodnictwo właściwe w czasie t
Wyznaczyć stałą szybkości reakcji.
Wykonanie ćwiczenia.
W zadanej temperaturze T = 313K za pomocą konduktometru dokonujemy pomiaru przewodnictwa mieszaniny reakcyjnej.
W obliczeniach stosujemy wzór:
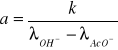
gdzie:
k - stała szybkości reakcji,
a - współczynnik kierunkowy prostej (a = tg α)
α - kąt nachylenia prostej do osi x.
Obliczenia i pomiary.
T = 313 [K]
λOH- - 0,02482 [m2/Ω⋅mol]
λAcO- - 0,0056 [m2/Ω⋅mol]
C0,ZASADY - 0.02 [mol/dm3]
C0,ESTRU - 0.02 [mol/dm3]
W celu wyznaczenia przewodnictwa na końcu reakcji C kreślimy wykres:
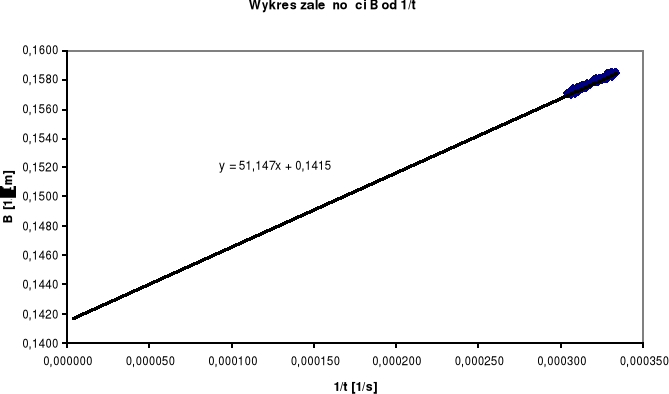
C = 0,1415 ![]()
Wyznaczamy rzędowość reakcji na podstawie wykresów:
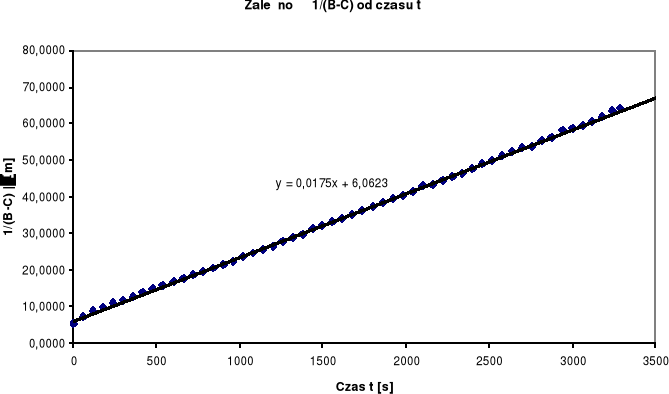
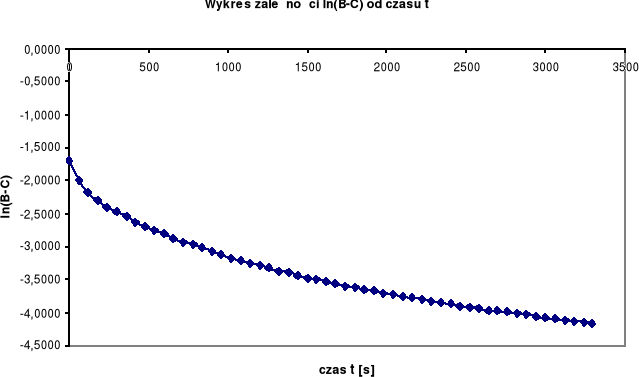
Z powyższych wykresów wynika, że jest to reakcja drugorzędowa. Stała szybkości tej reakcji wyliczamy ze wzorów:
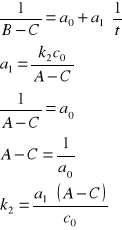
Odczytujemy wartości z równania prostej a0 = 6,0623 a1 = 0,0175. Zatem:
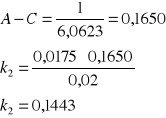
Stała szybkości reakcji wynosi k2 = 0,1443 
Stała szybkości obliczona z wartości przewodnictw granicznych jonów OH- i CH3COO- wynosi:
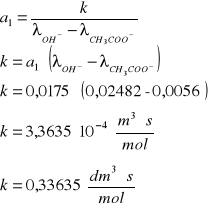
Wnioski.
Z przeprowadzonego pomiaru wynika, że reakcja zmydlania estrów jest reakcją drugorzędową. Świadczy o tym prostoliniowy przebieg zależności 1/(B-C) od t. Obliczone stałe szybkości reakcji k dwoma metodami są tego samego rzędu wielkości, co potwierdza poprawność wykonania doświadczenia.
Wyszukiwarka