Odwracalnością termodynamiczną względem procesu termodynamicznego:
nazywamy taki stan, w którym proces termodynamiczny występujący w układzie jest w równowadze termodynamicznej, jednakże pod wpływem zadziałania elementarnego bodźca termodynamicznego przybiera kierunek przebiegu zawsze zgodny z kierunkiem zadziałania elementarnego bodźca termodynamicznego (zmiana kierunku zadziałania bodźca termodynamicznego powoduje zmianę kierunku przebiegu procesu termodynamicznego).
Pojemnością cieplną lub ciepłem właściwym substancji,
które oznaczamy literą c, nazywamy iloraz elementarnego przyrostu masowej gęstości zasobu ciepła do elementarnego przyrostu temperatury bezwzględnej wywołanej przyrostem tego ciepła.
c=dq/dT dla gazu doskonałego: cϑ=const oraz cp=const
Klasyfikacja transportu energi:
1_poprzez wymianę ciepła,…2_poprzez wymianę pracy,…3_poprzez wymianę masy.
I zasada termodynamiki dla układu otwartego.
Redukuje ona bilans zasobu energii wewnętrznej dla układu otwartego opisany równaniem (5,12,3) do warunków procesu termodynamicznie odwracalnego czyli do procesu termodynamicznego przebiegającego w warunkach równowagi termodynamicznej bez tarcia. Zatem I zas. term. dla układu otwartego opisana jest równaniem
![]()
: Jeśli na układ bilansowania nie działają siły zewnętrzne to otrzymamy:![]()
Praca odwracalnego przebiegu prawo i lewobrzeżnego:
Dla prawo: Lob=Lex-Lk ;Dla lewo: Lobl=Lk-Lex ;Gdzie: Lex - praca ekspansji ; Lk - praca kompresji ;Dla nieodwracalnego: Lobn=(Lex-Lk)-(Lfex+Lfk) Lobln=(Lk-Lex)+(Lfex+Lfk)
Typowy wykres fazowy we współrzędnych (T,p) dla metalu.
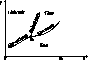
Ttr - temperatura punktu potrojonego
Tk - temperatura punktu krytycznego
Równanien Clausiusa- Clapeyrona
![]()
Funkcja rozkładu widmowego objętościowej gęstości zasobu promieniowania elektromagnetycznego.
7+ w polu długości fal.
klasycznie
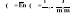
Praca internijna.
Jest to część pracy wykonanej wewnątrz układu ograniczonego osłoną poprowadzoną wzdłuż ścian wewnętrznych maszyny, która jest przekazywana na zewnątrz układu.
Li=Lin+Lf ;Lin - praca indykatorowa=wykresowej ;Lf - praca tarcia wewnątrz maszyny
Wyrażenie określające ciśnienie gazu działającego na powierzchnię padania.
Ciśnienie parcjalne na powierzchni AB pi=Fi/AB ;Przyrost ciśnienia cząstek poruszających się z prędkością Vi w kierunku powierzchni padania pod kątem θ: dpi=2mVi2cos2θdn lub dpi=nimVi2cos2sinθdθ p=1/3mnV2
![]()
Opisz zjawisko emisji wymuszonej.
Zjawisko emisji wymuszonej polega na jednoczesnym spadku wszystkich atomów znajdujących się na wyższym poziomie energetycznym na niższy poziom energetyczny. Towarzyszy temu duża ilość fotonów emitowanych o energii określonej zależnością: hv=2Ei tworząc spójne promieniowanie monochromatyczne o dużych gęstościach zasobu strumienia emisji energii.
Średnia kwadratu prędkość cząsteczki.
Średnia kwadratów prędkości cząsteczek w gazie doskonałym może być określona z definicji w skali temperatury T, tak aby:
![]()
Stąd średnia kwadratu prędkości cząsteczek określona jest zależnością:
![]()
Średnia prędkość cząsteczek definiowana jest zależnością:
![]()
II zasada termodynamiki dla przemian odwracalnych.
W układzie nieadiabatycznym w procesie odwracalnym iloczyn temperatury bezwzglednej T i elementarnego przyrostu zasobu entropii dS równy jest elementarnemu przyrostowi zasobu ciepła δQ wymienionego między układem a otoczeniem. Tds=δQ W przemianach rzeczywistych nieodwracalnych przemianie termodynamicznej może towarzyszyć rozpraszanie energii w procesie tarcia które jest równoważne kreacji zasobu ciepła Qf.
dS=(dQ+dQf)/T
Zdefiniuj pojęcie entropii
S=klnρ Entropia jest równa iloczynowi stałej Boltzmana i logarytmu gęstości prawdopodobieństwa wystąpienia stanu układu.
Ze statystycznego punktu widzenia największemu stopniu nie uporządkowania układu przyporządkowane jest największe prawdopodobieństwo wystąpienia tego stanu. Inne parametry stanu: temp, ciśnienie.
Entropia izolowanego układu osiąga wartość max dla wartości zmiennej losowej X równej x odpowiadającej stanowi równowagi układu.
Entropia układu złożonego z „n” słabo odziaływujących na siebie podukładów równa jest sumie entropii tych podukładów.
S=S1+S2+...+Sn
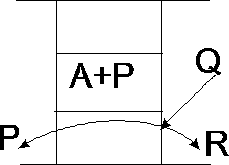
Podział zasobu energii promieniowania.
Oznaczając zasób energii absorbowanej A, pochłoniętej P, zaś reflektowanej R, można zapisać bilans energii promieniowania padającego na ciało:
A+P+R=Q a=A/Q - zdolność absorbcyjna ;p=P/Q - zdolność przepuszczania ;r=R/Q - zdolność refleksyjna
![]()
W przemianie izotermicznej masowa
gęstość zasobu ciepła, praca bezwzględna i praca techniczna są sobie równe: ΔqT=Δl=Δlt=RTln(ϑ/ϑ1)=RTln(p1/p) wartość masowych gęstości zasobu ciepła wymienionego w przemianie izotermicznej
dqT=Tdr=pdV=-V2dp
Wyrażenie na masową gęstość zasobu entropii dla gazu doskonałego.
W funkcji temp i masowej gęstości zasobu objętości:
s=cϑlnT+Rlnϑ+k
W funkcji temp i ciśnienia:
s=cplnT-Rlnp+k'
k'=k+RlnR
Zjawisko Joule'a i Gay-Lucassa
opisuje dławienie adiabatyczno-izoenergetyczne gazu doskonałego. Podczas dławienia gazu następuje produkcja entropii jako że jest to proces nie odwracalny i w stanie wyrównania ciśnień entropia układu osiąga maksimum.
dS=δqf/T=pdϑ/T; Dla gazu doskonałego energia kinetyczna przemieszczenia substancjalnego cząsteczek po wyhamowaniu ich prędkości substancjalnej do zera równoważna energii cieplnej, równa jest co do wartości pracy bezwzględnej δqf=pdϑ
![]()
Punkt krytyczny K:
Odpowiada stanowi krytycznemu, w którym objętościowe gęstości zasobu masy dwóch faz są jednakowe a przy zmianie stanu skupienia nie pojawia się powierzchnia podziału faz.
Współczynnik eustynucji:
αλ-współ. absorbcji objęt.
βλ-współ. rozproszenia objęto.
![]()
![]()
![]()
![]()
![]()
![]()
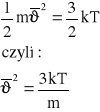
![]()
![]()
![]()
Wyszukiwarka