Rebus z chemii dla I roku GiG
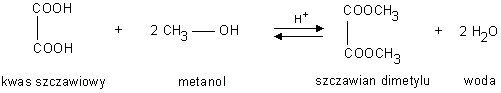
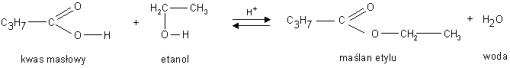
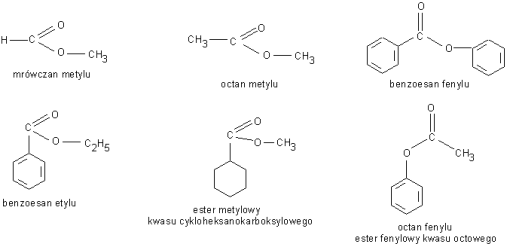
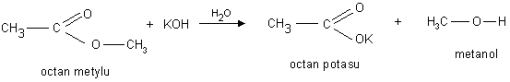
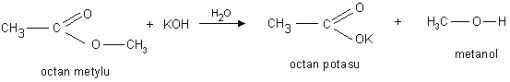
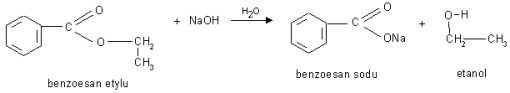
Napisać reakcję otrzymywania estrów mrówczanu metylu, mrówczanuetylu, octanu etylu, benzoesanu fenylu, octan metylu, szczawian dimetylu (kwas szczawiowy (COOH)2 ), szczawian dietylu (kwas szczawiowy (COOH)2 ), maślan metylu (kwas masłowy C3H7COOH), maślan etylu (kwas masłowy C3H7COOH),
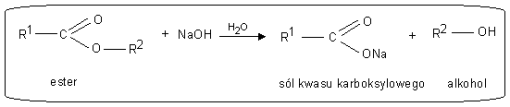
Reakcja estryfikacji jest przykładem reakcji kondensacji procesu..... w którym z dwóch cząsteczek reagentów organizacja powstaje cząsteczka produktu złożona z fragmentów cząsteczek obu reagentów oraz cząsteczka prostego produktu ubocznego, najczęściej wody.
Reakcje charakterystyczne: dla estrów
a). Reakcja kwasowej hydrolizy estrów - reakcja odwrotna do reakcji estryfikacji
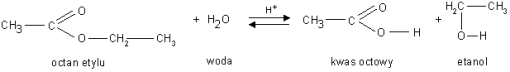
b). Reakcja hydrolizy zasadowej pod wpływem jonów OH- - reakcja zmydlania
Co to są barwniki i czym się charakteryzują
Co to są aminokwasy i czym się charakteryzują
Co to są białka - podać reakcje charakterystyczne dla białek
Co to są cukry proste a co to są wielocukry
Na czym polega proces polimeryzacji napisać przykładowe reakcje polimeryzacji i polikondensacji
Polimeryzacja addycyjna polega na ..pękaniu wiązań podwójnych, utworzeniu nienasyconych monomerów, nie powstaja produkty uboczne. nA → (-A-)n
Warunkiem niezbędnym do prowadzenia polimeryzacji addycyjnej jest .etap inicjowania - aktywacji, wzrostu łańcucha, zakończenia wzrostu łańcucha..
Polikondensacja to polimeryzacja kondensacyjna, polimery powstają w wyniku reakcji miedzy grupami funkcyjnymi monomerów jednakowych lub różnych..
Reakcje kwasów dikarboksylowych z glikolami to przykład jakiej reakcji?
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Au, Cd, Zn
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Ni, Al, Zn
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Fe, Mg, Zn
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Pt, Pb, Ti
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Fe, Be, Zn
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Fe, Mn, Zn
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Fe, Al, Zn
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Fe, Sn, Cu
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Mn, Pb, Zn
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Ag, Al, Co
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Fe, Co, Zn
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Cr, Al, Pb
Jakie zajdą reakcje jeżeli do roztworów CuSO4, HgCl2, Fe2(SO4)3 wrzucono po kawałku Mo, Al, V
•SZEREG NAPIECIOWY METALI
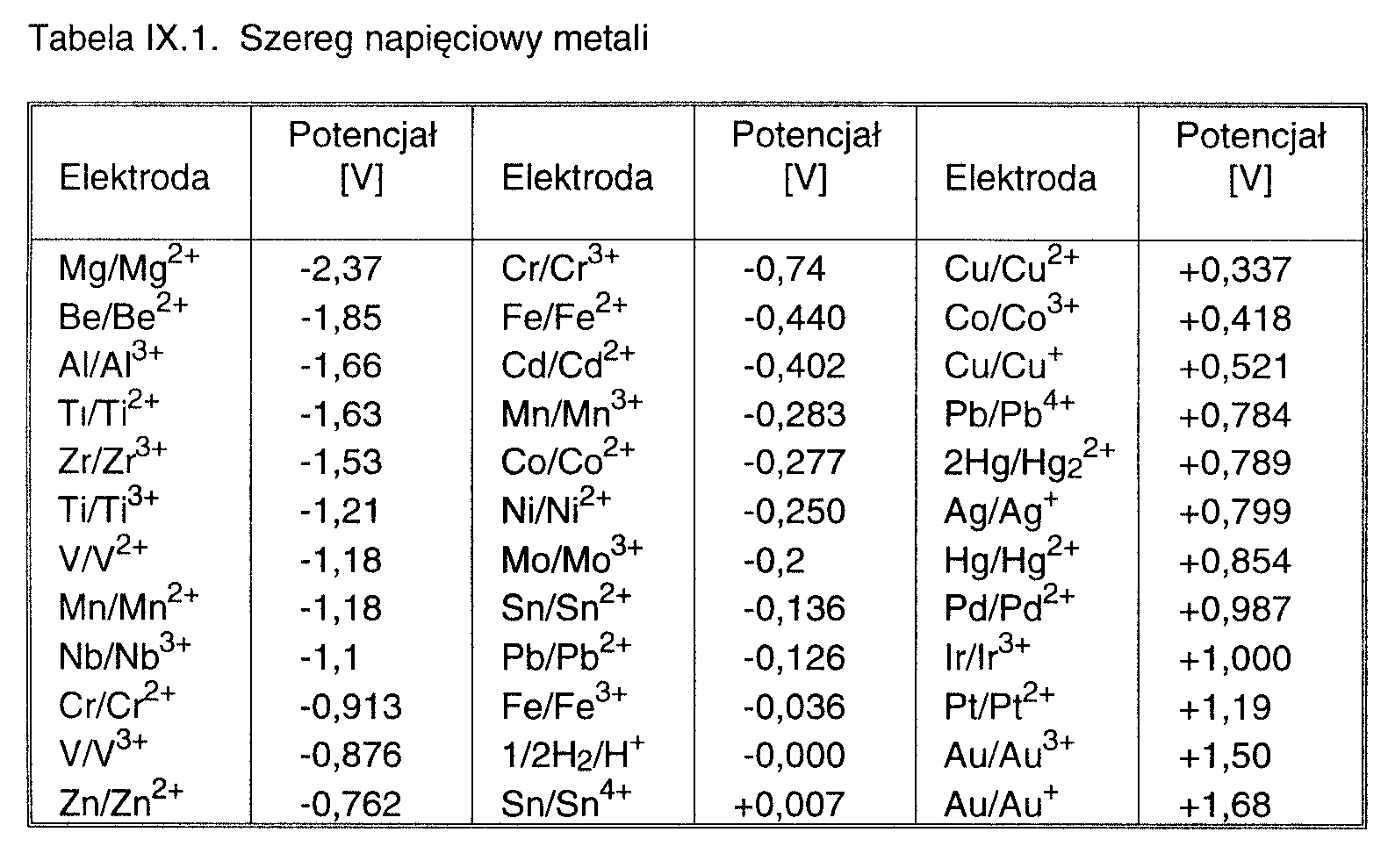
Metale zostały uszeregowane według rosnących wartości potencjału normalnego.
•Potencjał normalny metalu jest to potencjał równowagowy, jaki wykazuje metal zanurzony w roztworze jonów własnych, gdy aktywność tych jonów wynosi 1 i mierzony jest względem normalnej elektrody wodorowej.
•Szereg napięciowy metali informuje o wielu ważnych własnościach chemicznych metali.
•Metale o niskim (ujemnym) potencjale normalnym są aktywne chemicznie, chętnie się pozbywają elektronów przechodząc w postać jonów. Łatwo się utleniają a trudno redukują.
Metale o dodatnich potencjałach normalnych są bierne chemicznie, tym bardziej im wyższy (bardziej dodatni) jest ten potencjał. Trudno jest je otrzymać w formie jonowej, łatwo się redukują (przyjmują elektrony), a trudno jest je utlenić.
•Metale zostały uszeregowane według rosnących wartości potencjału normalnego.
•Potencjał normalny metalu jest to potencjał równowagowy, jaki wykazuje metal zanurzony w roztworze jonów własnych, gdy aktywność tych jonów wynosi 1 i mierzony jest względem normalnej elektrody wodorowej.
•Szereg napięciowy metali informuje o wielu ważnych własnościach chemicznych metali.
•Metal o niższym potencjale normalnym wypiera z roztworu pierwiastki o wyższym potencjale. Metale o bardziej ujemnych potencjałach mają zdolności redukujące względem innych metali mniej aktywnych:
Zn0 + Cu+2 = Zn+2 + Cu0
Ag0 + Au+ = Ag+ + Au0
Metale aktywne (o ujemnym potencjale normalnym) roztwarzając się w kwasach wypierają z nich wodór
Zn0 + HCl = ZnCl2 + H20
Metale o dodatnim potencjale normalnym roztwarzają się tylko w kwasach utleniających (stęż. kwas siarkowy, azotowy), nie wypierając przy tym wodoru z tych kwasów.
3Cu + 8HNO3 = 3 Cu(NO3)2 + 2 NO + 4H2O
Nie zachodzi reakcja Cu + HCl = CuCl2 + H2
Jeśli praca lub ciepło są dostarczane do ciała (układu ciał), to są one liczone ze znakiem .
Funkcje stanu:
Wzajemne związki pomiędzy funkcjami termodynamicznymi są następujące:
Podstawowe definicje w termodynamice
Ciepło przemian chemicznych
Energia wewnętrzna układu U jest:
Pierwsza zasada termodynamiki wyraża się następującym wzorem:
Wymień znane układy termodynamiczne:
Proces - w znaczeniu termodynamicznym polega na ......
Droga procesu - określona jest .......
Ilość ciepła wydzielonego lub pochłoniętego przez układ reagujący zależy jedynie
Zgodnie z prawem Hessa standardowa entalpia reakcji chemicznych równa jest
ciepło przemian chemicznych
Ciepło właściwe Cw
Ciepłem molowym Cp Cv -
Ciepło spalania
Jak stwierdzono doświadczalnie Cp * Cv
Szybkość reakcji jest proporcjonalna do
Wykładniki potęgowe, oznaczone symbolami n i m noszą nazwę
Wzajemne związki pomiędzy funkcjami termodynamicznymi są następujące:
Ilość ciepła wydzielonego lub pochłoniętego przez układ reagujący zależy jedynie
Cząsteczkowość reakcji jest to .
Cząsteczkowość zależy
Katalizatory i reakcje katalityczne
Proces samorzutny nazywany:
Procesy niesamorzutne: to proces .....
Pierwsza zasada termodynamiki wyraża się następującym wzorem:
Proces nieodwracalny jest to proces .....
Wartości efektów cieplnych podawane są ze znakiem (-) i ze znakiem (+)
Ile energii wydzieli się na sposób ciepła podczas syntezy z pierwiastków 40 g CH4wiedząc, że entalpia tworzenia gazowego metanu wynosi -76kJ/mol odpowiedź = wydzieli się 190kJ energii
Oblicz ile energii na sposób ciepła wydzieli się podczas spalania 13g cynku zgodnie z reakcją: Zn(s) + 1/2O2(g) = ZnO(s) Δ H0 ZnO(s) = -485 kJ/mol odpowiedź = wydzieli się 57kJ energii
Obliczyć efekt cieplny reakcji redukcji 3 kg Fe2O3 tlenkiem węgla CO, zgodnie z reakcją
Fe2O3(s) + CO(g) = Fe(s) + CO2(g) którą trzeba najpierw uzgodnić Δ H0 Fe2O3 = -821 kJ/mol,
H0 CO(g) = -110kJ/mol, Δ H0 CO2(g) = -393kJ/mol odpowiedź =-525 kJ
Obliczyć efekt cieplny rozkładu 2kg CaCO3 znając Δ H0 CaCO3 =-1206kJ/mol,
Δ H0 CaO = -635kJ/mol, Δ H0 CO2 =-393kJ/mol odpowiedź = +3560kJ
Jaki będzie efekt cieplny przy spalaniu 100kg węgla Δ H0 CO2(s) =-393kJ/mol
odpowiedź =-3270MJ
Znając entalpię tworzenia Fe2O3(s) oraz entalpię reakcji:
4FeO(s) + O2(g) = 2 Fe2O3(s) Δ H0reakcji = -584kJ obliczyć standardową entalpią tworzenia FeO(s)
odpowiedź = -264kJ/mol
Jaki będzie efekt cieplny spalania 1 dm3 CO w warunkach normalnych jeżeli produktem będzie CO2 Δ H0 (CO2)g = - 393kJ/mol odpowiedź = 17,5 kJ
Podczas spalania 1.2 g siartki S w tlenie powstało 11.1 kJ ciepła. Obliczyć standardową entalpię tworzenia SO2. odpowiedź = -296kJ/mol
Obliczyć efekt cieplny spalania 200g siarki zgodnie z równaniem
S(s) + N2O (g) = SO2(g) + N2(g) , które to równanie trzeba uzgodnić
Δ H0 N2O (g) = +81kJ/mol
Δ H0 SO2 = -293kJ/mol odpowiedź =-2862,5Kj
15. Podczas spalania 1.5 g siartki S w tlenie powstało 13.8 kJ ciepła. Obliczyć standardową entalpię tworzenia SO2. odpowiedź = -296kJ/mol
16. Jaki będzie efekt cieplny spalania 1 dm3 wodoru w warunkach normalnych jeżeli produktem będzie para wodna Δ H0 (H2O)g = -241 kJ/mol odpowiedź-10,8kJ
Podczas spalania 1.6 g siarki S w tlenie powstało 14.8 kJ ciepła. Obliczyć standardową entalpię tworzenia SO2. odpowiedź = -296kJ/mol
3
Wyszukiwarka