ĆWICZENIE 2
IMMOBILIZOWANE BIOKATALIZATORY
Data wykonania ćwiczenia: 16/03/2010
WSTĘP TEORETYCZNY
Biokatalizatorami nazywamy enzymy, kompleksy enzymów, organelle komórkowe i całe komórki bądź ich różne kombinacje. Źródłem pozyskiwania biokatalizatorów są drobnoustroje, rośliny i organizmy zwierzęce. Natomiast immobilizowane biokatalizatory są to biokatalizatory posiadające formę zapewniającą ich wielokrotne stosowanie.
Immobilizacją, czyli inaczej unieruchomieniem (łac. immobilis - nieruchomy), można określić zespół metod, które ograniczają całkowicie lub częściowo swobodę poruszania się określonych atomów, cząsteczek, substancji lub materiału biologicznego na podłożu stałym czy też wewnątrz specyficznych struktur. W przemyśle spożywczym oprócz unieruchamiania substancji zapachowych coraz powszechniej wykorzystuje się (w procesach technologicznych i analityce) immobilizowane enzymy, komórki drobnoustrojów czy też organelli komórkowych.
Unieruchamianie drobnoustrojów może być naturalne lub celowo zaplanowane. Wśród metod unieruchamiania wyróżnia się wiązanie na powierzchni nośnika i wewnątrz matrycy lub bez użycia nośnika oraz blokowanie komórek między półprzepuszczalnymi membranami.
Istnieją duże możliwości przemysłowego wykorzystania immobilizowanych drobnoustrojów i biokatalizatorów, szczególnie do różnych biosyntez i biotransformacji w procesach ciągłych i półciągłych.
Niektóre mikroorganizmy mają zdolność do samoagregacji (flokulacji naturalnej) i wzrostu w postaci kuleczek, kłaczków lub biofilmu. Takie cechy drobnoustrojów są głównie uwarunkowane genetycznie, mogą być także wywoływane za pomocą odpowiednich oddziaływań chemicznych i fizycznych. Naturalną skłonność mikroorganizmów do opadania i przylegania - nawet do bardzo gładkich powierzchni - można wykorzystać nie tylko w procesach technologicznych, ale również do innych celów, np. zabezpieczania narzędzi chirurgicznych lub innych środowisk przed skażeniem drobnoustrojami chorobotwórczymi.
Literatura:
A. Chmiel, Biotechnologia. Podstawy mikrobiologiczne i biochemiczne, Wydawnictwo Naukowe PWN, Warszawa 1998
Instrukcja do ćwiczeń laboratoryjnych, Biotechnologia II, Immobilizowane biokatalizatory, PŁ
Internet:
CELE ĆWICZENIA
Poznanie metody immobilizacji drobnoustrojów w alginianie wapnia.
Sprawdzenie stabilności matrycy alginianowej w różnych środowiskach.
Określenie efektywności działania immobilizowanej beta-fruktofuranozydazy (w żelu alkohol poliwinylowy (PVA)-alginian) w reakcji hydrolizy sacharozy.
WYKONANIE ĆWICZENIA
1) Immobilizacja drobnoustrojów metodą pułapkowania w alginianie wapnia.
10 ml zawiesiny zawierającej komórki drożdży piekarskich przeniesiono do zlewki zawierającej taką samą ilość 3% roztworu alginianu wapnia. Po starannym wymieszaniu, unikając spienienia, wkroplono ten roztwór strzykawką, zaopatrzoną w cienką igłę, do zlewki zawierającej zimny 1% roztwór CaCl2, mieszając delikatnie podczas całego procesu wkraplania. Następnie pozostawiono w ten sposób utworzone „kulki” w środowisku zimnego chlorku wapnia na 30 min. Po tym czasie przepłukano je wodą destylowaną o temperaturze pokojowej i umieszczono po 6 kulek w czterech różnych środowiskach na 20 minut często i energicznie mieszając. Po tym czasie oceniono wygląd roztworów i po wyjęciu z nich kulek poddano je testowi na wytrzymałość.
Wyniki obserwacji makroskopowych przedstawiono w tabeli 1.
Tabela 1.
ŚRODOWISKO |
OBSERWACJE MAKROSKOPOWE |
Cytrynian sodu |
Opalizacja roztworu |
Fosforan potasu |
Lekka opalizacja roztworu; wytrącenie osadu |
EDTA |
Brak zmian |
Sól fizjologiczna |
Brak zmian |
Uzasadnienia obserwowanych zmian makroskopowych roztworów i zmian mechanicznej wytrzymałości kuleczek dla poszczególnych środowisk:
Cytrynian sodu
Opalizujące zmętnienie to komórki drożdży, które immobilizowaliśmy. Kwasy organiczne (np. kwas mlekowy, cytrynianowy) powodują rozpuszczanie alginianu wapnia.
Fosforan potasu
Kulki rozpuściły się, pojawiło się opalizujące zmętnienie pochodzące od powstałego gruboziarnistego osadu, czyli trudno rozpuszczalnego fosforanu wapnia.
EDTA
Nie zaobserwowano zmian makroskopowych. Po wykonaniu testu na wytrzymałość kulki są miękkie, ponieważ EDTA chce utworzyć kompleks z jonami II-wartościowymi (w naszym przypadku są to jony wapnia).
Sól fizjologiczna
Ponieważ w czasie trwania eksperymentu nie zaszły żadne zmiany to możemy podejrzewać, iż jest to potencjalnie dobre środowisko do przechowywania enzymu immobilizowanego na alginianie wapnia. Jest to spowodowane tym, iż w środowisku występują jony wapnia utrudniające rozpuszczanie się matrycy.
2) Zastosowanie immobilizowanej β-fruktofuranozydazy do hydrolizy sacharozy.
Do 10 ml substratu, którym był 3% roztwór sacharozy dodano 8 kuleczek (preparat numer 2.) immobilizowanej w żelu PVA-alginian β-fruktofuranozydazy. Całość umieszczono w szczelnie zamkniętej buteleczce o pojemności ok.100 ml i poddano inkubacji w temperaturze 40oC w czasie 30 minut w termostatowanej wytrząsarce. Następnie zlano znad kuleczek część cieczy (ok. 2 ml), która posłużyła nam do oznaczenia stężenia cukrów redukujących w hydrolizatach skrobiowych. Stosowaną metodą była metoda Samogoy-Nelsona:
Po uprzednim 5-krotnym rozcieńczeniu próbki, pobrano 1 ml do probówki i dodano 1 ml odczynnika miedziowego, równolegle wykonano próbę odczynnikową zawierającą 1 ml wody zamiast próbki. Następnie wstawiono te dwie probówki na dokładnie 10 minut do wrzącej łaźni wodnej. Następnie wyjęto je, schłodzono i dodano do każdej po 1 ml roztworu Nelsona. Po wymieszaniu i odgazowaniu (ok. 10 min.) zmierzono absorbancję wobec próby odczynnikowej przy długości fali 520 nm.
Wyniki pomiarów przedstawiono w tabeli 2.
Tabela 2.
Numer preparatu |
Masa kuleczek [mg] |
R |
V3%sacharozy |
ΔE520 |
śr. E520 |
Preparat 1. (51µg inwertazy/1g żelu) |
73 |
5 |
10 |
0,246 |
0,308 |
|
|
|
10 |
0,269 |
|
|
|
|
10 |
0,415 |
|
|
|
|
10 |
0,301 |
|
Preparat 2. (40µg inwertazy/1g żelu) |
160 |
5 |
10 |
0,310 |
0,310 |
|
|
|
10 |
0,221 |
|
|
|
|
10 |
0,399 |
|
Próba materiałowa |
1 |
10 |
0,321 |
0,269 |
|
|
|
10 |
0,217 |
|
|
Stężenie cukrów redukujących:
![]()
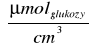
Gdzie:
Stała K=0,5 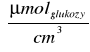
C - stężenie cukrów redukujących 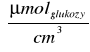
K - współczynnik obliczeniowy wyznaczony z krzywej wzorcowej 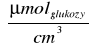
ΔE520- absorbancja mierzona przy długości fali 520 nm.
R - rozcieńczenie próby
Przykład obliczeń (dla preparatu 2.):
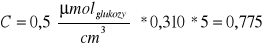
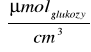
Obliczenie aktywności preparatu na 1g immobilizowanego biokatalizatora ze wzoru:
![]()
![]()
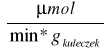
Gdzie:
ΔC - róznica stężeń cukrów redukujących w próbie właściwej i w próbie materiałowej 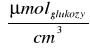
y - masa kuleczek [g]
V - objętość próby [ml]
t - czas reakcji [min]
Przykładowe obliczenia (dla preparatu 2.):
Stężenie cukrów redukujących w próbie materiałowej:
CMateriałowa = 0,5 *0,269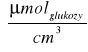
*1 = 0,135 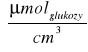
Stąd:
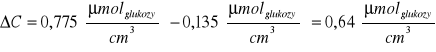
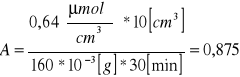
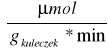
Obliczenie aktywności preparatów na 1g białka zawartego w immobilizowanym preparacie inwertazy:
Dla preparatu 1.: Cinwertazy w 1g żelu-51 µg
Dla preparatu 2.: Cinwertazy w 1g żelu-40 µg
Stosowane na zajęciach immobilizowane preparaty zawierają inwertazę drożdżową
(β-fruktofuranozydazę). Zawiera ona w 1g handlowego preparatu rozpuszczalnej inwertazy 0,264g białka.
Przykład obliczenia (dla preparatu 2.):
0,264białka - 1g inwertazy
X - 40*10-6g
X = 0,264 * 40 * 10-6 = 10,56 x 10-6 gbiałka
Aktywność właściwa preparatów w przeliczeniu na 1g białka:
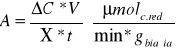
,gdzie: ![]()
Gdzie:
A - aktywność właściwa 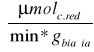
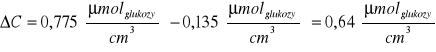
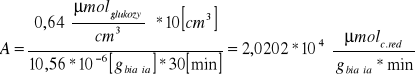
WNIOSKI
Na podstawie wykonanego doświadczenia i obserwacji stwierdziliśmy, iż w różnych środowiskach zmienia się stabilność nośnika alginianowego. W roztworze soli fizjologicznej nie było widać zmian. Natomiast w probówce z roztworem fosforanu zaobserwowano opalizację, co świadczyło o uwolnieniu komórek drożdży. Próba zawierająca roztwór cytrynianu była mętna, a w środowisku EDTA kulki po wyjęciu miały osłabioną strukturę były bardzo miękkie - zaobserwowano związanie jonów wapnia (chelatowanie).
Wynika z tego, iż alginianu wapnia nie można stosować, jako immobilizowany biokatalizator, gdy środowisko zawiera:
- jony fosforanowe,
- związki kompleksujące,
- kwasy organiczne.
Zastosowanie immobilizowanej β-fruktofuranozydazy do hydrolizy sacharozy pozwoliło nam wyliczyć stężenie cukrów redukujących , które dla pomiaru naszej polówki stołu wyniosło 0,5525 [μmolglukozycm-3]. Aktywność immobilizowanego preparatu
β-fruktofuranozydazy w przeliczeniu na 1g immobilizowanego biokatalizatora wynosiła 0,875 [μmol min-1 g1biokatalizatora]. Natomiast w przeliczeniu na 1g białka zawartego w immobilizowanym preparacie inwertazy osiągnęła wartość ![]()
[μmol min-1 g1białka].
Błędy w otrzymanych wynikach mogą wynikać z niedokładności wykonywanych pomiarów.
Wyszukiwarka