Harmonogram ćwiczeń z chemii organicznej dla I roku studiów dziennych i zaocznych, kierunek biologia.
Rok akademicki 2008/2009
|
A |
B |
C |
D |
E |
F |
1 |
wprowadzenie, omówienie zasad BHP |
|||||
2 |
analiza |
analiza |
alkohole i fenole2 |
alkohole i fenole2 |
węglowodory1 |
węglowodory1 |
3 |
węglowodory1 |
węglowodory1 |
analiza |
analiza |
alkohole i fenole2 |
alkohole i fenole2 |
4 |
alkohole i fenole2 |
alkohole i fenole2 |
węglowodory1 |
węglowodory1 |
analiza |
analiza |
5 |
odrabianie zaległości, zdawanie kolokwiów |
|||||
6 |
kwasy karboksylowe4 |
kwasy karboksylowe4 |
aldehydy i ketony3 |
aldehydy i ketony3 |
aminy5 |
aminy2 |
7 |
aminy5 |
aminy5 |
kwasy karboksylowe4 |
kwasy karboksylowe4 |
aldehydy i ketony3 |
aldehydy i ketony3 |
8 |
aldehydy i ketony3 |
aldehydy i ketony3 |
aminy5 |
aminy5 |
kwasy karboksylowe4 |
kwasy karboksylowe4 |
9 |
elementy spektroskopii |
|||||
10 |
odrabianie zaległości, zdawanie kolokwiów |
|||||
Zalecana literatura.
Przemysław Mastalerz - „Chemia organiczna”.
John McMurry - „Chemia organiczna”.
1. Analiza jakościowa związków organicznych.
Wykrywanie węgla i wodoru.
„Szczyptę” związku organicznego prażyć w suchej probówce z taką samą objętością CuO.
C + H + CuO CO2 + H2O
Gazowe produkty reakcji wprowadzić do probówki z wodą wapienną.
Wytrącanie białego osadu węglanu wapnia świadczy o obecności węgla w badanej próbce.
Ca(OH)2 + CO2 CaCO3 + H2O
Osiadanie kropelek wody na chłodnych częściach ścianek probówki świadczy o obecności wodoru w badanej próbce.
Wykrywanie azotu.
Metoda Willa i Varrentrappa.
Metodą tą można wykrywać azot związany w grupie aminowej -NH2 lub iminowej =NH.
W suchej probówce ogrzewamy taką samą objętość badanej próbki i wapna sodowanego. Gdy z probówki zaczną się ulatniać pary to do jej wylotu zbliżamy zwilżony wodą destylowaną uniwersalny papierek wskaźnikowy. Zmiana zabarwienia papierka i charakterystyczny zapach świadczą o wydzielaniu się amoniaku.
CO(NH2)2 + 2NaOH Na2CO3 + 2NH3
Metoda Lassaigne'a.
Jest to metoda ogólna, która pozwala na wykrycie azotu niezależnie od sposobu jego związania.
W suchej probówce prażymy kawałek sodu metalicznego wielkości połowy ziarnka grochu oraz „szczyptę” badanego związku organicznego.
C + N + Na NaCN
Po rozżarzeniu probówki do czerwoności wkładamy ją do małej zlewki zawierającej 10 cm3 wody destylowanej. Podczas wykonywania tej czynności należy używać okularów ochronnych. Po pęknięciu probówki i wyługowaniu jej zawartości wodą otrzymany roztwór przesączamy do małej zlewki. Przesącz zawierający cyjanek sodu traktujemy roztworem siarczanu(VI) żelaza(II).
2NaCN + FeSO4 Fe(CN)2 + Na2SO4
Fe(CN)2 + 4NaCN Na4[Fe(CN)6]
Powstaje cyjanek żelaza(II), który reagując z nadmiarem cyjanku sodu daje heksacyjanożelazian(II) sodu. Otrzymany roztwór zakwaszamy rozcieńczonym kwasem chlorowodorowym, aby usunąć powstający ubocznie wodorotlenek żelaza(II).
FeSO4 + 2NaOH Fe(OH)2 + Na2SO4
Fe(OH)2 + 2HCl FeCl2 + 2H2O
Na koniec roztwór traktujemy kilkoma kroplami roztworu chlorku żelaza(III).
3Na4[Fe(CN)6] + 4FeCl3 Fe4[Fe(CN)6]3 + 12NaCl
Jeżeli badana próbka zawierała azot to pojawia się wówczas ciemnoniebieskie zabarwienie lub nawet osad pochodzący od heksacjanożelazianu(II) żelaza(III), zwanego błękitem pruskim.
Wykrywanie siarki.
W suchej probówce prażymy kawałek sodu metalicznego wielkości połowy ziarnka grochu oraz „szczyptę” badanego związku organicznego.
S + 2Na Na2S
Po rozżarzeniu probówki do czerwoności wkładamy ją do małej zlewki zawierającej 10 cm3 wody destylowanej. Podczas wykonywania tej czynności należy używać okularów ochronnych. Po pęknięciu probówki i wyługowaniu jej zawartości wodą otrzymany roztwór przesączamy do małej zlewki. Przesącz zawierający siarczek sodu dzielimy na trzy części o jednakowej objętości.
Do pierwszej części dodajemy roztwór kwasu chlorowodorowego i badamy zapach wydzielającego się gazu. Intensywny zapach siarkowodoru świadczy o obecności siarki w badanej próbce.
Na2S + 2HCl 2NaCl + H2S
Do drugiej części dodajemy roztwór azotanu(V) ołowiu. Otrzymanie czarnego osadu świadczy o obecności siarki w badanej próbce.
Na2S + Pb(NO3)2 PbS + 2NaNO3
Do trzeciej części przesączu dodajemy kilka kropli pentacyjanonitrozylożelazianu(III) sodu (nitroprusydku sodu). Obecność intensywnego fioletowego zabarwienia świadczy o występowaniu siarki w badanej próbce.
Na2S + Na2Fe(CN)5NO Na4Fe(CN)5NOS
Wykrywanie fosforu.
„Szczyptę” związku organicznego starannie mieszamy z czterokrotnie większą objętością mieszaniny utleniającej, składającej się z azotanu(V) potasu i węglanu sodu zmieszanych w stosunku molowym 2:3. Ogrzewanie prowadzimy do momentu całkowitego zbielenia zawartości probówki. Rozgrzaną probówkę wkładamy do zlewki zawierającej ok. 10 cm3 wody destylowanej. Roztwór przesączamy a przesącz dzielimy na dwie części.
4P + 5O2 P4O10
Do pierwszej części dodajemy roztwór amoniaku a następnie roztwór chlorku magnezu. Powstanie białego osadu świadczy o obecności fosforu w badanym związku.
Na2HPO4 + MgCl2 + NH3 NH4MgPO4 + 2NaCl
Drugą część przesączu przenosimy do małej zleweczki i zadajemy go stężonym kwasem azotowym. Ostrożnie podczas zakwaszania zawartość zlewki się pieni. Następnie dodajemy roztwór molibdenianu(VI) amonu i ogrzewamy do temperatury 50°C. Powstanie żółtego osadu fosforanu(V) molibdeno-amonowego świadczy o obecności fosforu w badanej próbce.
Na3PO4 + 12 (NH4)2MoO4 + 24HNO3 (NH4)3PO4 · 12MoO4+ 21NH4NO3 + 3NaNO3 + 12H2O
Wykrywanie chloru, bromu i jodu.
Małą! próbkę substancji organicznej prażymy z tlenkiem wapnia.
F2, Cl2, Br2, I2 + CaO CaF2, CaCl2, CaBr2, CaI2.
Rozgrzaną probówkę wkładamy do zlewki zawierającej ok. 10 cm3 wody destylowanej. Roztwór przesączamy a przesącz zakwaszamy rozcieńczonym kwasem azotowym(V). Odczyn roztworu kontrolujemy uniwersalnym papierkiem wskaźnikowym. Do zakwaszonego przesączu dodajemy roztwór azotanu(V) srebra. Jeżeli wytrąci się biały osad dobrze roztwarzalny w wodzie amoniakalnej to świadczy to o obecności chloru w badanej próbce.
CaCl2 + 2AgNO3 2AgCl + Ca(NO3)2
Powstanie żółto - białego osadu umiarkowanie roztwarzalnego w wodzie amoniakalnej świadczy o obecności bromu w badanej próbce.
CaBr2 + 2AgNO3 2AgBr + Ca(NO3)2
Wytrącenie żółtawego osadu nieroztwarzalnego w wodzie amoniakalnej świadczy o obecności jodu w badanej próbce.
CaI2 + 2AgNO3 2AgI + Ca(NO3)2
2. Badanie właściwości węglowodorów.
Rozróżnianie węglowodorów. Węglowodory nasycone, nienasycone i aromatyczne.
Zakres materiału teoretycznego.
Wyjaśnienie budowy węglowodorów nasyconych, nienasyconych i aromatycznych w oparciu o odpowiedni typ hybrydyzacji. Izomeria konstytucyjna, geometryczna oraz izomeria położenia wiązania wielokrotnego. Reakcje substytucji i addycji. Reakcje spalania węglowodorów.
Rozróżnianie węglowodorów przez działanie bromem.
Heksan, 1-okten, benzen, 2% roztwór bromu w tetrachlorku węgla (sprawdzić również wodę bromową), probówki z dopasowanymi korkami gumowymi, wiórki glinu lub żelaza, uniwersalny papierek wskaźnikowy.
W trzech kolejnych probówkach umieścić po jednym cm3 heksanu, 1-oktenu i benzenu. Do każdej z probówek dodać kilka kropli roztworu bromu w tetrachlorku węgla. Probówki zatkać korkami i wstrząsać intensywnie przez kilka minut. W probówce zawierającej 1-okten odbarwienie roztworu bromu następuje natychmiast. Pozostałe dwie probówki odkorkować i ogrzać w zlewce z gorącą. W tych warunkach roztwór bromu odbarwia się w probówce zawierającej heksan. Ponadto wydziela się bromowodór, którego obecność możemy stwierdzić przy pomocy uniwersalnego papierka wskaźnikowego zwilżonego wodą.
Do ostatniej probówki, zawierającej benzen z roztworem bromu dodajemy kilka wiórków żelaza (w ostateczności glinu) i ogrzewamy ją dalej w zlewce z gorącą wodą. Po długim czasie następuje odbarwienie roztworu bromu z równoczesnym wydzieleniem bromowodoru.
Równanie reakcji: ..........................................................................................
Rozróżnianie węglowodorów działaniem manganianu(VII) potasu.
Heksan, 1-okten, toluen, 0.5% roztwór manganianu(VII) potasu, 50% roztwór kwasu siarkowego(VI), probówki.
1 cm3 badanego węglowodoru zadajemy 1 cm3 5% roztworu kwasu siarkowego(VI) i 2 kroplami 0.5% roztworu manganianu potasu(VII). Zawartość probówki wytrząsamy. Węglowodory nienasycone powodują szybkie odbarwienie roztworu i powstanie brunatnego osadu tlenku manganu(IV). Węglowodory aromatyczne reagują powoli i dopiero po ogrzaniu. Natomiast węglowodory nasycone reagują bardzo powoli albo wcale.
Stałe pochodne węglowodorów aromatycznych.
Pikryniany.
Etylobenzen lub ksylen, nasycony roztwór kwasu pikrynowego w tetrachlorku węgla lub eterze.
Rozpuścić ok. 0.5 cm3 badanego węglowodoru aromatycznego w tetrachlorku węgla i dodać 3 cm3 nasyconego roztworu kwasu pikrynowego w tetrachlorku węgla lub w eterze. Roztwór ogrzewać na łaźni wodnej przez kilkanaście minut. Ochłodzić i poczekać na wytrącenie osadu pikrynianu.
Reakcja z chlorkiem glinu.
Naftalen, 1-naftol, 2-naftol, toluen, chloroform, bezwodny chlorek glinu.
Rozpuścić ok. 0.1g badanego związku w suchym chloroformie. Wstrząsnąć zawartość probówki tak aby uległy zwilżeniu ścianki. Do otrzymanego roztworu dodać ok. 0.5g bezwodnego chlorku glinu wsypując go w taki sposób aby część proszku zatrzymała się na ściankach probówki. Obserwować zabarwienie chlorku glinu na ściankach probówki i w roztworze.
Spalanie węglowodorów nasyconych i wykrywanie produktów reakcji.
Spalanie węglowodorów oraz badanie produktów spalania.
Woda wapienna, benzyna, nafta, olej napędowy, toluen, parowniczki porcelanowe, siatka ceramiczna, długie łuczywka, zlewki 250 cm3.
Do małej parowniczki porcelanowej wlać kolejno 1 cm3 benzyny, po jej spaleniu 1 cm3 nafty potem 1 cm3 oleju napędowego a na końcu 1 cm3 toluenu. Spróbować zapalić badane substancje przy pomocy długiego łuczywka. Obserwować barwę płomienia i ilość powstającej sadzy.
Zwilżyć ścianki zlewki wodą wapienną i nałapać do niej gazowych produktów reakcji spalania. Zaobserwować zmętnienie wody wapiennej.
Równanie reakcji: ..........................................................................................
Chlorowcopochodne węglowodorów.
Reakcja z azotanem(V) srebra.
1-chlorobutan, 2-chlorobutan, 2-chloro-2-metylopropan, nasycony alkoholowy roztwór azotanu(V) srebra.
Nalać do probówki ok. 2 cm3 alkoholowego roztworu azotanu(V) srebra i dodać do niego 0.5 cm3 badanej chlorowcopochodnej. Powstanie osadu na zimno świadczy o obecności III rz. chlorowcopochodnej. II i I rz. chlorowcopochodne dają osady po kiluminutowym ogrzewaniu roztworu do wrzenia.
Na zimno reakcję dają halogenki allilowe, bromki i jodki alkilowe i cykloalkilowe, III rz. chlorki alkilowe oraz chlorowcopochodne arylowe zawierające grupy nitrowe w pozycjach orto i para.
Halogenki winylowe, arylowe oraz chloroform, bromoform i jodoform reakcji tej nie dają.
Równanie reakcji: ..........................................................................................
3. Badanie Właściwości alkoholi i fenoli.
Zakres materiału teoretycznego.
Metody otrzymywania alkoholi, nomenklatura, reaktywność chemiczna. Rzędowość alkoholi. Estry kwasów karboksylowych i kwasów nieorganicznych. Reakcje odwracalne, stan równowagi dynamicznej, prawo działania mas, reguła przekory. Kataliza homogeniczna.
Wykrywanie grupy hydroksylowej w alkoholach i fenolach.
Reakcja alkoholi z sodem metalicznym.
Sód metaliczny, 1-butanol lub 1-pentanol.
Do 1 cm3 badanej substancji dodać cienkie skrawki sodu metalicznego. Zbadać palność wydzielającego się gazu.
Alkohole o krótszych łańcuchach niż 3 atomy węgla jest trudno otrzymać w stanie bezwodnym, alkohole o łańcuchach dłuższych niż 8 atomów węgla są zbyt mało reaktywne.
Równanie reakcji: ..........................................................................................
Reakcja fenolu z sodem metalicznym.
Fenol, sód metaliczny, sucha probówka, uniwersalny papierek wskaźnikowy.
W suchej probówce umieszczamy ok. 0.5 g badanej substancji. Zawartość probówki ogrzewamy łagodnie przez chwilę i sprawdzamy palność wydzielającego się gazu. Do pozostałości w probówce dodajemy ok. 2 cm3 wody destylowanej i sprawdzamy odczyn powstającego roztworu.
Równanie reakcji: ..........................................................................................
Reakcja z chlorkiem benzoilu.
Chlorek benzoilu, 20% roztwór wodorotlenku sodu, 1-pentanol, 1-butanol, kolbka stożkowa 50 cm3 z korkiem szlifowanym, cylinderek miarowy 5 cm3, uniwersalny papierek wskaźnikowy.
Do kolbki wlać 1,5 cm3 badanej cieczy, 3 cm3 wody, 0,5 cm3 chlorku benzoilu. Zawartość kolbki wytrząsać przez kilka minut. Następnie dodać porcjami 3 cm3 20% roztworu wodorotlenku sodu, silnie wytrząsając po dodaniu każdej porcji. Wytrząsać jeszcze kilka minut a następnie sprawdzić odczyn roztworu, powinien być alkaliczny. Pozostawić kolbkę na chwilę w spokoju i poczekać na rozwarstwienie się substancji. Powinien powstać olej lub osad o charakterystycznym zapachu.
Równanie reakcji: ..........................................................................................
Rozpoznawanie rzędowości alkoholi.
Metodą Lucasa.
Metoda ta nadaje się do alkoholi zawierających mniej niż 6 atomów węgla w cząsteczce. Podstawą wykonania oznaczenia jest czas po jakim z alkoholi powstają chlorki alkilowe. Alkohole III rz. reagują bardzo szybko. Zmętnienie powstaje natychmiast a druga warstwa powstaje już po kilkudziesięciu sekundach. Alkohole II rz. dają zmętnienie po ok. 5 minutach a druga warstwa powstaje po ok. 10 minutach. Alkohole I rz. z odczynnikiem Lucasa nie reagują wogóle.
Odczynnik Lucasa (136 g bezwodnego ZnCl2 rozpuścić w 105 g stężonego roztworu kwasu chlorowodorowego z jednoczesnym chłodzeniem), 1-butanol, 2-butanol,
2-metylo-2-propanol.
Do ok. 0,5 cm3 badanej substancji dodać 5 cm3 odczynnika Lucasa. Probówkę zakorkować wytrząsać ją przez chwilę a następnie pozostawić w spokoju. Zanotować czas po jakim następuje rozwarstwienie cieczy.
Równanie reakcji: ..........................................................................................
Metoda Bordwella i Wellmana.
Odczynnik Bordwella i Wellmana (1g CrO3 rozpuścić w 1 cm3 stężonego kwasu siarkowego(VI) i 3 cm3 wody), aceton cz.d.a., 1-butanol, 2-butanol, 2-metylo-2-propanol.
Rozpuścić 10 kropli badanego alkoholu w 1 cm3 acetonu i dodać 1 kroplę odczynnika Bordwella i Wellmana. Mieszaninę wytrząsać przez 10 sekund a następnie zaobserwować zmianę barwy. Alkohole I i II rz. dają zabarwienie błękitnozielone natomiast alkohole III rz. nie powodują zmiany zabarwienia roztworu.
Reakcja z kwasem chromowym.
Alkohole III rz. tworzą z kwasem chromowym estry mające zabarwienie od żółtego do wiśniowoczerwonego.
2-metylo-2-propanol, stały tlenek chromu(VI), tetrachlorek węgla. 0.5 cm3 badanego alkoholu rozpuścić w 2 cm3 tetrachlorku węgla i dodać 0.5 g stałego CrO3. Wystąpienie wiśniowego lub ciemnoczerwonego zabarwienia świadczy o obecności alkoholu III rz.
Próba jodoformowa.
Reakcja ta jest charakterystyczna dla etanolu oraz alkoholi drugorzędowych zawierających grupę hydroksylową przy drugim atomie węgla. Dają ją również metyloketony.
Etanol, 5% roztwór wodorotlenku sodu, roztwór jodu w jodku potasu (20 g KI i 10 g I2 rozpuścić w 100 cm3 wody).
Ok. 0.5 cm3 badanego alkoholu rozpuścić w 2 cm3 wody. Dodać 2 cm3 5% roztworu wodorotlenku sodu i powoli kroplami dodawać roztwór jodu aż do uzyskania lekko brunatnego zabarwienia. Probówkę ogrzać w zlewce z gorącą wodą. Po ochłodzeniu powinien powstać żółty osad jodoformu.
R-CHOH-CH3 + 4I2 + 6NaOH CHI3 + RCOONa + 5NaI + 5H2O
Badanie glicerolu.
Reakcja glicerolu i glikolu z sodem metalicznym.
Glicerol, sód metaliczny, probówka, pęseta, skalpel albo scyzoryk.
Do probówki nalewmy ok. 1 cm3 glicerolu i wrzucamy do niej kawałeczek świeżo ukrojonego sodu metalicznego wielkości połowy ziarnka grochu. Badamy palność ulatniającego się gazu.
Równanie reakcji: ..........................................................................................
Reakcja glicerolu z wodorotlenkiem miedzi(II).
Glicerol, 5% roztwór siarczanu(VI) miedzi(II), 5% roztwór wodorotlenku sodu.
Do probówki nalewamy ok. 1 cm3 5% roztworu siarczanu(VI) miedzi(II) i dodajemy do niego powoli 5% roztwór wodorotlenku sodu, aż do całkowitego wytrącenia Cu(OH)2. Do otrzymanego osadu wodorotlenku miedzi(II) dodajemy 1 cm3 glicerolu i zawartość probówki intensywnie wytrząsamy. Obserwujemy barwę otrzymanego roztworu.
Równanie reakcji: ..........................................................................................
Odwadnianie glicerolu.
Glicerol , wodorosiarczan(VI) potasu (jeżeli nie ma KHSO4 to 50% roztwór kwasu siarkowego(VI) )
Do suchej probówki nalewamy ok. 1 cm3 glicerolu i dodajemy ok. 1g stałego wodorosiarczanu(VI) potasu. Zawartość probówki ogrzewamy delikatnie w płomieniu palnika i sprawdzamy zapach powstającego produktu.
Równanie reakcji: ..........................................................................................
Identyfikacja fenoli.
Fenole reagują z 5% roztworem wodorotlenku sodu a na ogół nie reagują z 5% roztworem wodorowęglanu sodu. Z NaHCO3 reaguje między innymi tribromofenol, kwas pikrynowy oraz 2,4-dinitrofenol.
Reakcja z FeCl3.
Krezol, 1-naftol lub 2-naftol, 2% roztwór chlorku żelaza(III).
Kilka kryształków badanej substancji rozpuścić w 2 cm3 wody destylowanej. Do otrzymanego roztworu dodać kilka kropli 2% roztworu FeCl3. Obserwować zmiany zabarwienia w momencie dodawania odczynnika.
6C6H5OH + Fe + 3Cl- + 6H2O [Fe(OC6H5)6]3- + 6H3O+ + 3Cl-
Reakcja z odczynnikiem Millona.
Fenol, odczynnik Millona, etanol. Kilka kryształków fenolu rozpuścić w 1cm3 etanolu. Do otrzymanego roztworu dodać kilka kropli odczynnika Millona. Jeżeli czerwone zabarwienie nie powstaje od razu to zawartość probówki należy delikatnie ogrzać w płomieniu palnika. Pozytywny wynik reakcji Millona dają również fenole podstawiony w pozycji para.
Stałe pochodne fenoli.
Fenol, woda bromowa.
Kilka kryształków badanego fenolu rozpuścić w 1 cm3 wody destylowanej. Do otrzymanego roztworu dodawać kroplami wodę bromową aż do momentu utrzymywania się jasnożółtej barwy roztworu i wytrącenia białego osadu.
Równanie reakcji: ..........................................................................................
4. Badanie właściwości aldehydów i ketonów.
Zakres materiału teoretycznego.
Budowa grupy karbonylowej. Ogólne metody otrzymywania aldehydów i ketonów. Nomenklatura aldehydów i ketonów. Reakcje addycji prostej i złożonej. Kondensacja aldolowa. Polimeryzacja. Reakcje utleniania i dysproporcjonowania aldehydów oraz ketonów.
Otrzymywanie propanalu przez utlenianie 1-propanolu.
Do probówki nalać ok. 2cm3 1-propanolu i wsypać szczyptę tlenku miedzi(II). Zawartość probówki ogrzać do wrzenia i sprawdzić zapach otrzymanego produktu. Wypróbować też inne alkohole I rzędowe. (etanol, 1-butanol)
Równanie reakcji: ..........................................................................................
Otrzymywanie 2-butanonu przez utlenianie 2-butanolu.
Rozpuścić w 2 cm3 wody szczyptę umowną dichromianu(VI) potasu. Do otrzymanego roztworu dodać 1 cm3 stężonego kwasu siarkowego(VI) i ochłodzić. Do chłodnej mieszaniny chromowej dodać ok. 2 cm3 2-butanolu. Zawartość probówki ogrzać i porównać zapach przed i po reakcji.
Równanie reakcji: ..........................................................................................
Reakcja Tollensa.
5% roztwór azotanu(V) srebra, 10% roztwór wodorotlenku sodu, 5% roztwór amoniaku, etanal (aldehyd octowy)
W dokładnie wyszorowanej probówce umieścić ok. 2 cm3 5% roztworu azotanu(V) srebra. Dodać 1 kroplę 10% roztworu wodorotlenku sodu a następnie dodawać kroplami 5% roztwór amoniaku aż do momentu całkowitego roztworzenia powstającego osadu wodorotlenku srebra (tlenku srebra jak twierdzą inni). Należy unikać nadmiaru amoniaku. Do otrzymanego odczynnika dodajemy ok. 1 cm3 badanego aldehydu (lub jego alkoholowego roztworu). Probówkę wstawiamy do zlewki z ciepłą i obserwujemy powstawanie lustra srebrnego na jej ściankach.
Reakcja z odczynnikiem Tollensa pozwala wykryć grupę aldehydową w aldehydach aromatycznych i alifatycznych, natomiast z odczynnikiem Benedicta lub Fehlinga reagują wyłącznie aldehydy alifatyczne. Kolejne zastosowanie obu odczynników umożliwia rozróżnienie rodzaju aldehydu.
Równanie reakcji: ..........................................................................................
Reakcja Fehlinga.
Fehling I (34.6 g CuSO4 · 5H2O w 500 cm3 + 1 cm3 H2SO4), Fehling II ( 173 g winianu sodowo - potasowego i 70 g NaOH w 500 cm3 wody), etanal (czyli aldehyd octowy).
Do probówki nalewamy po 2 cm3 roztworu Fehlinga I i II, a następnie dodajemy ok. 0.5 cm3 badanego aldehydu. Probówkę wstawiamy do zlewki z gorącą wodą. Wytrącenie ceglastoczerwonego osadu świadczy o obecności grupy aldehydowej.
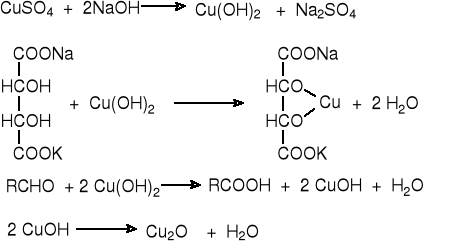
Reakcja z odczynnikiem Nylandera.
Azotan(V) diwodorotlenek bizmutu(III) 20 g, winian sodowo-potasowy 40 g. Oba związki rozpuścić w 100 cm3 8% roztworu wodorotlenku sodu. W razie potrzeby otrzymany roztwór należy przesączyć. Etanal.
1cm3 etanalu rozpuścić w 1 cm3 wody. Do otrzymanego roztworu dodać 1 cm3 roztworu odczynnika Nylandera. Zawartość probówki ogrzać łagodnie do wrzenia. Powstanie czarnego osadu świadczy o obecności aldehydów.
Równanie reakcji: ..........................................................................................
Próba jodoformowa.
Roztwór 20 g jodku potasu i 10 g jodu w 100 cm3 wody, 10% roztwór wodorotlenku sodu, butanon, dioksan.
Kilka kropli badanej substancji rozpuścić w 2 cm3 wody. Jeżeli substancja nie rozpuszcza się w wodzie to należy ją rozpuścić w 5 cm3 dioksanu. Do tak otrzymanego roztworu dodać 1 cm3 roztworu wodorotlenku sodu a następnie kroplami dodawać roztwór jodu w jodku potasu aż do momentu zbrunatnienia roztworu. Jeżeli po kilku minutach nie nastąpi wytrącenie żółtego osadu to zawartość probówki ogrzać do temperatury 60°C i pozostawić do ostygnięcia.
Próba Legala.
Próba ta umożliwia wykrycie metyloketonów.
2-butanon, 3-pentanon, cykloheksanon, 5% roztwór pentacyjanonitrozylożelazianu(III) sodu (nitroprusydku sodowego), etanol, 2M roztwór wodorotlenku sodu, lodowaty kwas octowy.
2-3 krople alkoholowego roztworu badanej substancji zmieszać z 2 kroplami 5% roztworu nitroprusydku sodu i pozostawić na kilka minut. Następnie dodać 1 kroplę 2M roztworu wodorotlenku sodu. W obecności metyloketonów powstaje brunatnoczerwone zabarwienie, które po dodaniu 2 kropli lodowatego kwasu octowego zmienia się na czerwone lub niebieskie.
Stałe pochodne aldehydów i ketonów.
Reakcja z wodorosiarczanem(IV) sodu.
Reakcję tę dają aldehydy i metyloketony. Aldehydy o małych cząsteczkach mogą dawać produkty rozpuszczalne w wodzie.
Wersja „A”.
Aldehyd benzoesowy, nasycony roztwór wodorosiarczanu(IV) sodu, etanol, małe lejeczki.
Do probówki nalać ok. 2 cm3 badanego aldehydu i ok. 15 cm3 nasyconego roztworu NaHSO3. Probówkę zatkać korkiem i intensywnie wytrząsać przez kilka minut. Wydzielony osad odsączyć i przemyć niewielką ilością etanolu.
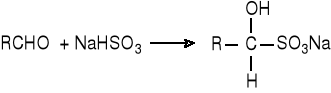
Reakcja z fenylohydrazyną.
Aldehyd benzoesowy, chlorowodorek fenylohydrazyny, octan sodu bezwodny, etanol.
Rozpuścić ok. 0.5 g badanego aldehydu w 5 cm3 etanolu. W drugiej probówce przygotować roztwór 0.5 g chlorowodorku fenylohydrazyny i 0.8 g bezwodnego octanu sodu w 5 cm3 wody destylowanej. Oba roztwory zlewamy razem i mocno wytrząsamy. Odsączyć otrzymany osad.
Równanie reakcji: ..........................................................................................
Reakcja z semikarbazydem.
Aldehyd benzoesowy, chlorowodorek semikarbazydu, octan sodu bezwodny, etanol.
Rozpuścić ok. 0.5 badanego aldehydu w 5 cm3 etanolu. W drugiej probówce przygotować roztwór 0.5 g chlorowodorku semikarbazydu i 0.8 g bezwodnego octanu sodu w 5 cm3 wody destylowanej. Oba roztwory zlewamy razem i mocno wytrząsamy. Otrzymany roztwór ogrzewamy przez kilka minut w zlewce z gorącą wodą i chłodzimy. Powstały osad odsączyć i przekrystalizować z etanolu.
Równanie reakcji: ..........................................................................................
5. Badanie kwasów karboksylowych i estrów.
Zakres materiału teoretycznego.
Budowa grupy karboksylowej. Kwasy karboksylowe, otrzymywanie, nomenklatura, reaktywność chemiczna. Występowanie kwasów karboksylowych w przyrodzie.
Chlorki i bezwodniki kwasowe, otrzymywanie, nomenklatura, reaktywność chemiczna.
Oznaczanie liczby zmydlania tłuszczu.
Ze względu na długi czas trwania reakcji należy ją nastawić na początku ćwiczeń.
Tłuszcze naturalne możemy scharakteryzować podając ich liczbę zmydlenia, liczbę kwasową, liczbę estrową, liczbę jodową.
Liczba zmydlenia (LZ) - liczba miligramów wodorotlenku potasu niezbędna do zmydlenia związanych estrowo kwasów tłuszczowych i zobojętnienia wolnych kwasów tłuszczowych znajdujących się w 1 g badanego tłuszczu.
Liczba kwasowa (LK) - liczba miligramów wodorotlenku potasu niezbędna do zobojętnienia wolnych kwasów tłuszczowych znajdujących się w 1 g badanego tłuszczu.
Liczba estrowa (LE) - liczba miligramów wodorotlenku potasu niezbędna do zmydlenia związanych estrowo kwasów tłuszczowych znajdujących się w 1g badanego tłuszczu.
Liczba jodowa (LI) - liczba gramów jodu jaka przereaguje ze 100 g badanego tłuszczu. Liczba jodowa pozwala ocenić czy dany tłuszcz zawiera dużo wiązań podwójnych.
Wykonanie oznaczenia:
Łaźnia wodna (2 szt.) biureta 50cm3 (2szt.), erlenmajerka 250cm3 (4 szt.), pipeta 25 cm3 (2 szt.), chłodnica powietrzna (2 szt.), tłuszcz, 0.5M alkoholowy roztwór KOH, 0.5M alkoholowy roztwór HCl, fenoloftaleina.
Na wadze technicznej odważyć ok. 2 do 2.5 g tłuszczu. Naważkę wprowadzić do erlenmajerki. Następnie do erlenmajerki odpipetpwać 25cm3 0.5M alkoholowego roztworu KOH. Zamontować powietrzną chłodnicę zwrotną i ustawić zestaw na łaźni wodnej. Ogrzewanie prowadzić aż do momentu zaniku kropelek badanego tłuszczu. Zawartość kolby należy często mieszać tak aby powierzchnia styku reagujących substancji była bardzo duża. Po zakończeniu reakcji miareczkujemy ciepły roztwór 0.5M alkoholowym roztworem HCl w obecności fenoloftaleiny.
W trakcie ogrzewania wykonujemy tzw. ślepą próbę, która polega na zmiareczkowaniu w obecności fenoloftaleiny 25cm3 0.5M alkoholowego roztworu KOH, 0.5M alkoholowym roztworem HCl.
Liczbę zmydlenia obliczamy ze wzoru:
![]()
![]()
gdzie:
V - objętość 0.5M alkoholowego roztworu HCl zużytego do zmiareczkowania próby ślepej, wyrażona w cm3.
V1 - objętość 0.5M alkoholowego roztworu HCl zużytego do zmiareczkowania próby właściwej, wyrażona w cm3.
28.055 - liczba miligramów wodorotlenku potasu znajdującego się w 1 cm3 używanego roztworu wodorotlenku potasu, (mg/cm3 )
a - masa odważki tłuszczu w gramach.
Równanie reakcji: ..........................................................................................
Badanie odczynu kwasów.
Kwas etanowy, kwas propanowy, kwas stearynowy, kwas benzoesowy.
W ponumerowanych probówkach umieścić po ok. 0.5 g badanych kwasów. Do każdej probówki dodać 2cm3 wody destylowanej, zawartość probówki wstrząsnąć i papierkiem uniwersalnym sprawdzić odczyn roztworu.
Napisać równania reakcji dysocjacji kwasów zgodnie z teorią Brönsteda, Lowry'ego.
..................................................................................................................................
Reakcja kwasu benzoesowego z wodorotlenkiem sodu.
5% roztwór wodorotlenku sodu, 5% alkoholowy roztwór kwasu benzoesowego, roztwór fenoloftaleiny.
Nalać do probówki ok.0.5 cm3 roztworu wodorotlenku sodu i dodać 2 krople roztworu fenoloftaleiny. Następnie kroplami dodawać alkoholowy roztwór kwasu benzoesowego aż do odbarwienia zawartości probówki.
Równanie reakcji. ..........................................................................................
Reakcja kwasu stearynowego z metalicznym sodem.
Kwas stearynowy, sód metaliczny.
Stopić w suchej probówce ok. 1 g kwasu stearynowego i dodać do niego kawałeczek sodu metalicznego wielkości ziarnka pszenicy. zbadać palność powstającego gazu.
Równanie reakcji. ..........................................................................................
Reakcja kwasu stearynowego z tlenkiem miedzi(II).
Kwas stearynowy, tlenek miedzi(II).
Stopić w suchej probówce ok. 5 g kwasu stearynowego i dodać do niego szczyptę tlenku miedzi(II). Obserwować zmianę zabarwienia zawartości probówki na zieloną.
Równanie reakcji. ..........................................................................................
6. Badanie amin i amidów kwasowych.
Zakres materiału teoretycznego.
Budowa grupy aminowej. Metody otrzymywania amin alifatycznych i aromatycznych. Wyjaśnienie zasadowego charakteru amin oraz porównanie amin aromatycznych i alifatycznych. Rzędowość amin.
Metody otrzymywania amidów kwasowych. Zasadowy charakter amidów oraz jego porównanie z zasadowym charakterem amin. Hydroliza amidów kwasowych.
Nomenklatura amin alifatycznych, aromatycznych oraz amidów kwasowych.
Budowa mocznika, jego otrzymywanie oraz zastosowanie w rolnictwie i produkcji tworzyw syntetycznych.
Wykrywanie amin.
Podczas stapiania soli amoniowych z tiocyjanianem potasu (KCNS) powstaje siarkowodór, który można bardzo łatwo wykryć przy pomocy papierka ołowiowego.
Benzen, kwas chlorowodorowy rozc. w stos. 1:10, tiocyjanian potasu stały, 5% roztwór azotanu(V) ołowiu(II),butyloamina.
Rozpuścić ok. 0,2 cm3 butyloaminy w 1 cm3 benzenu. Do otrzymanego roztworu dodać 3 - 4 krople rozcienczonego roztworu kwasu chlorowodorowego. Zawartość probówki odparować do sucha. Do suchej pozostałości dodać ok. 0.5 g tiocyjanianu potasu, wymieszać bagietką i wyprażyć. Do powstających gazów wprowadzić
wilgotny pasek bibuły nasączony roztworem azotanu(V) ołowiu(II).
KCNS + RNH3+Cl- KCl + H2S + RNHCN
Badanie odczynu amin.
Aminy alifatyczne wobec lakmusu wykazują słabo zasadowy odczyn a aminy aromatyczne wobec lakmusu są obojętne.
Papierek Kongo, 0.1M roztwór kwasu chlorowodorowego, butyloamina.
Papierek Kongo zabarwić na niebiesko 0.1M roztworem kwasu chlorowodorowego i nanieść na niego dwie krople butyloaminy. Wystąpienie czerwonego zabarwienia świadczy o obecności aminy.
b. 0.01M roztwór kwasu chlorowodorowego, alkoholowy roztwór oranżu metylowego, butyloamina, płytka do analiz kroplowych.
W zagłębieniu płytki do analiz kroplowych umieścić 2 -3 krople 0.01M roztworu kwasu chlorowodorowego. Dodawać po kropli alkoholowy roztwór oranżu metylowego aż do wystąpienia trwałego różowego zabarwienia. Następnie dodać 2 krople butyloaminy. Pojawienie się żółtego zabarwienia świadczy o obecności aminy.
Równanie reakcji: ..........................................................................................
Rozróżnianie rzędowości amin.
Wykrywanie amin alifatycznych pierwszo i drugorzędowych.
Mieszanina etanolu i disiarczku węgla w stos. 1:1, 10% roztwór azotanu(V) srebra w 10% roztworze kwasu azotowego(V), etyloamina lub butyloamina.
Do kilku kropli aminy dodać kilka kropli mieszaniny disiarczku węgla z etanolem. Po ok. 5 minutach jak z roztworu ulotni się disiarczek węgla dodajemy kilka kropli roztworu azotanu(V) srebra w kwasie azotowym(V). Ciemnienie mieszaniny lub pojawienie się czarnego osadu świadczy o obecności amin pierwszo- lub drugorzędowych.
CS2 + 2NH2R NHRCSSNH3R
NHRCSSNH3R + AgNO3 NHR·CS·NHR + Ag2S
CS2 + 2NHRR' NRR'·CS·SNHRR'
NRR'·CS·SNHRR' + AgNO3 NRR'·CS·NRR' + Ag2S
Badanie właściwości mocznika.
Azotan(V) mocznika.
18% roztwór mocznika, stężony kwas azotowy(V).
Do 1 cm3 roztworu mocznika dodać kilka kropli stężonego kwasu azotowego(V). Obserwować powstawanie białego osadu azotanu(V) mocznika.
Równanie reakcji: ..........................................................................................
Szczawian mocznika.
18% roztwór mocznika, nasycony roztwór kwasu szczawiowego.
Do 1 cm3 roztworu mocznika dodać kilka kropli nasyconego roztworu kwasu szczawiowego. Obserwować powstawanie białego osadu szczawianu mocznika.
Równanie reakcji: ..........................................................................................
Hydroliza mocznika.
Mocznik stały, 10% roztwór wodorotlenku sodu, uniwersalny papierek wskaźnikowy.
Szczyptę umowną badanej substancji ogrzewać z roztworem wodorotlenku sodu. Obecność amoniaku wykrywamy przy pomocy uniwersalnego papierka wskaźnikowego.
Równanie reakcji: ..........................................................................................
Mocznik stały, 20% kwas chlorowodorowy.
Ogrzewać szczyptę umowną mocznika z roztworem kwasu chlorowodorowego.
Podczas reakcji nie czuć zapachu amoniaku ponieważ zostaje on związany przez nadmiar kwasu chlorowodorowego.
Równanie reakcji: ..........................................................................................
Powstawanie biuretu.
Mocznik.
W suchej probówce ogrzewać ok. 0,5 g mocznika. W takcie ogrzewania mocznik ulega stopieniu i równocześnie wydziela się amoniak.
Równanie reakcji. ..........................................................................................
Reakcja biuretowa.
Biuret, 10% roztwór NaOH, 1% roztwór NaOH
Suchą pozostałość z reakcji wcześniejszej rozpuścić w kilku cm3 wody
dodać 1cm3 roztworu siarczanu(VI) miedzi(II). Pojawia się czerwonofioletowe zabarwienie.
Równanie reakcji. ..........................................................................................
1
M.J. Korohoda, J.R. Paśko, „Ćwiczenia z analizy i preparatyki organicznej”, Wydawnictwo Naukowe WSP, Kraków 1998, str. 78.
Korohoda M.J., Paśko J.R., Ćwiczenia z analizy i preparatyki organicznej, Wydawnictwo Naukowe WSP, Kraków 1998, str. 87.
Jerzmanowska Z., Analiza jakościowa związków organicznych, PZWL, Warszawa 1963, str. 60.
M.J. Korohoda, J.R. Paśko, „Ćwiczenia z analizy i preparatyki organicznej”, Wydawnictwo Naukowe WSP, Kraków 1998, str.89.
Matysikowa Z., Lenarcik B., Bujewski A., Zbiór doświadczeń z chemii organicznej, WSiP, Warszawa 1975, str. 99.
Jerzmanowska Z., Analiza jakościowa związków organicznych, PZWL, Warszawa 1963, str. 45.
Korohoda M.J., Paśko J.R., Ćwiczenia z analizy i preparatyki organicznej, Wydawnictwo Naukowe WSP, Kraków 1998, str. 95.
Jerzmanowska Z., Analiza jakościowa związków organicznych, PZWL, Warszawa 1963, str. 114.
Korohoda M.J., Paśko J.R., Ćwiczenia z analizy i preparatyki organicznej, Wydawnictwo Naukowe WSP, Kraków 1998, str. 104
Wyszukiwarka