Michał Płatek, klasa II "e" VLO, 14 kwietnia 2010 r.
PRZEGLĄD ZAGADNIEŃ Z ZAKRESU MYDEŁ
WSTĘP
Aby dobrze zrozumieć omawiane poniżej zagadnienia, należy zapoznać się z podstawowymi informacjami:
Definicja mydła: Mydłem nazywamy sól metalu alkalicznego1) (sodu, magnezu, litu, potasu) i wyższego kwasu tłuszczowego o 12-18 atomach węgla (palmitynowy, stearynowy, oleinowy). Należą do związków powierzchniowoczynnych. Mydła zostały wynalezione przez Fenicjan i są do dziś wykorzystywane jako środki myjące i piorące, co wynika z ich właściwości amfifilowych2).
1) Metale alkaliczne (litowce, potasowce) - pierwiastki I grupy układu okresowego (bez wodoru) o silnych własnościach metalicznych, tworzące z wodą silnie zasadowe (alkaliczne) wodorotlenki: lit, sód, potas, rubid, cez i frans.
2) Amfifilowość - jednoczesna, niepełna rozpuszczalność danego związku w dwóch różnych rozpuszczalnikach, której przyczyną jest występowanie hydrofilowych oraz hydrofobowych miceli (szczegóły dalej).
Podstawowe rodzaje mydeł: (podział ze względu na rodzaj metalu alkalicznego)
mydła sodowe (białe, twarde, wykorzystywane do produkcji mydeł w kostkach)
mydła potasowe (szare, maziste, wykorzystywane do produkcji "szarego mydła")
mydła magnezowe (ciekłe, wykorzystywane do produkcji szamponów, płynów do kąpieli i mydeł w płynie)
mydła litowe (pół-ciekłe, wykorzystywane jako dodatki do litowych smarów łożyskowych)
mydła wapniowe (wytrąca się jako "kłaczki" w reakcji mydła potasowego ze związkami twardej wody)
SURFAKTANTY (ŚRODKI POWIERZCHNIOWO CZYNNE)
Surfaktanty (ang. Surface active agent) to związki chemiczne, które posiadają zdolność do obniżania napięcia powierzchniowego cieczy. Własność ta ułatwia zwilżanie powierzchni ciał stałych przez te ciecze, a także umożliwia zmieszanie dwóch cieczy, które naturalnie tworzą dwie niemieszalne fazy (np. woda i olej). Cząsteczki surfaktantów mają zwykle wydłużony kształt i wykazują właściwości amfifliowe, to znaczy posiadają dwa wyraźne zakończenia, z których jedno jest hydrofilowe (w przypadku mydeł: jonowa grupa funkcyjna -COO-), natomiast drugie hydrofobowe (grupa węglowodorowa kwasu tłuszczowego).
Surfaktanty posiadają wiele praktycznych zastosowań. Są stosowane m.in jako:
detergenty (podstawowy składnik wszelkich środków czyszczących)
emulgatory (stosowane w farbach, kosmetykach i przemyśle spożywczym)
środki pianotwórcze
antybiotyki i herbicydy
Surfaktant występuje też w pęcherzykach płucnych człowieka i pełni ważną funkcję w oddychaniu - zmniejsza napięcie powierzchniowe na pęcherzykach (dzięki temu nie zmniejszają się) oraz minimalizuje opory sprężyste przy pracy płuc.
MECHANIZM MYCIA I PRANIA
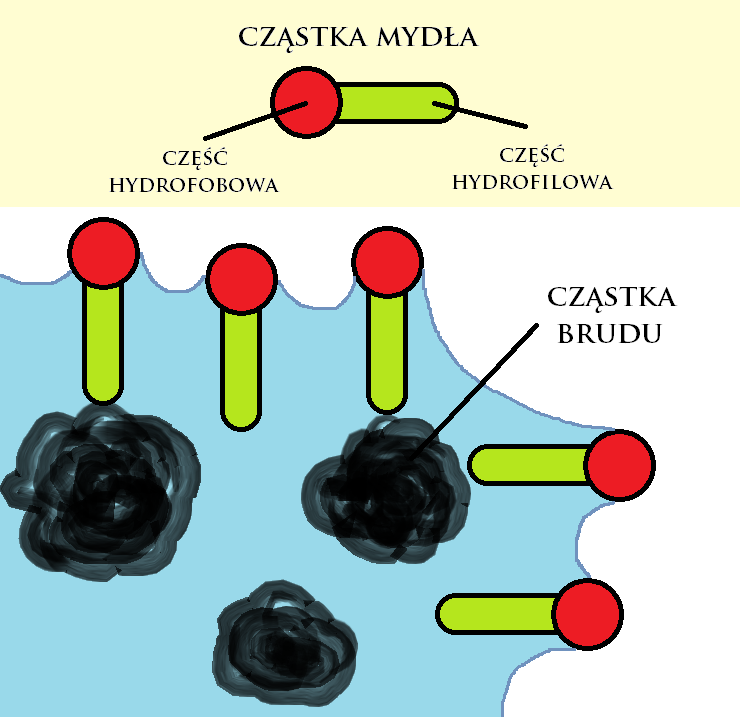
Mycie i pranie to procesy, które zawdzięczamy zdolności mydeł do obniżania napięcia powierzchniowego wody. Po wymieszaniu z wodą związki amfifilowe zawarte w mydle samorzutnie gromadzą się na powierzchni styku wody z inną fazą (na przykład granica woda-brudna koszula), żeby ich część hydrofobowa ("nie lubiąca" wody) znajdowała się poza jej objętością, przy okazji "rozbijając" strukturę tego styku, co prowadzi do obniżenia napięcia powierzchniowego.
Dzięki obniżeniu sił napięcia powierzchniowego, woda lepiej wnika w strukturę zanieczyszczonego materiału (tkaniny, skóry itp.), co pozwala na dotarcie do cząstek brudu (sadzy, krzemionki, soli mineralnych, barwników, składników potu, tłuszczu lub białka itp.) oraz ich usunięcie. Tarcie mechaniczne tkaniny powoduje powstanie emulsji brudu z wodą, a także piany, która zatrzymuje brud na powierzchni wody i uniemożliwia jego ponowne osiadanie na czyszczonej powierzchni.
Rysunek 1. Zachowanie cząstek mydła z zetknięciu z brudem. Autor: Michał Płatek
TWARDOŚĆ WODY I JEJ ZMIĘKCZANIE
Twardość wody - jest to cecha wody, o której decyduje stężenie soli wapnia, magnezu i innych metali, które są zdolne do tworzenia soli na wyższym niż pierwszy stopień utlenienia. Wodą twardą będzie więc taka, która zawiera znacznie ilości chlorków, siarczanów (VI), wodorowęglanów wapnia i magnezu. Twardość wody ma decydujący wpływ na napięcie powierzchniowe, które, im jest większe, tym bardziej utrudnia zwilżanie wszelkich powierzchni. Utrudnia to bardzo zmywanie naczyń i pranie. Podczas gotowania wody twardej powstaje tzw. kamień kotłowy (nierozpuszczalny osad węglanu wapnia lub magnezu), a używanie jej w pralce może spowodować usterki. Twarda woda posiada intensywny, metaliczny posmak, trudniej zaspokaja pragnienie i może działać w sposób przeczyszczający. W celu zmiękczenia wody należy używać detergentów - tym więcej, im twardsza jest woda.
Podział twardości wody:
nietrwała (przemijająca, węglanowa - jej źródłem są węglany Ca(HCO3)2 i Mg(HCO3)2, które można usunąć przez gotowanie)
trwałą (powodowana przez sole innych kwasów - chlorki, siarczany, azotany i inne, np. CaCl2, MgCl2, CaSO4, MgSO4)
Aby określić ogólną twardość wody, należy zsumować twardość węglanową oraz trwałą. Duża, nietrwała twardość wody jest problemem w procesach technologicznych obejmujących odparowywanie dużej ilości wody, gdyź gromadzi się znaczna ilość kamienia kotłowego.
Twardość wody wyraża się w stopniach niemieckich (°n lub °d), stopniach francuskich (°f) albo milivalach, określających zawartość CaO, CaCO3 lub jonów Ca2+ w litrze wody. Typowa twardość wody kranowej wynosi ok. 10 °n. Woda poniżej 3 °n jest uważana za miękką, zaś woda powyżej 30 °n jest uważana za twardą.
Zmiękczanie wody, czyli usuwanie związków powodujących twardość, osiąga się poprzez zastosowanie kilku metod:
destylacja
dekarbonizacja
metoda jonitowa poprzez dodawanie związków chemicznych tworzących rozpuszczalne kompleksy z wapniem i magnezem.
Dekarbonizacja wody polega na strąceniu soli wapnia i magnezu termicznie lub chemicznie, na przykład przy pomocy sody albo fosforanów. Metoda jonitowa to dodawanie związków chemicznych tworzących rozpuszczalne kompleksy z wapniem i magnezem.
Zmiękczanie stosuje się najczęściej w przypadku wody o zastosowaniu przemysłowym, np. chłodniczej, kotłowej, technologicznej.
Bibliografia:
M. Litwin, S. Styka-Wlazło, J. Szymanowska. Chemia organiczna. Wyd. 2. Nowa Era. 2004. ISBN 83-89272-94-6
http://pl.wikipedia.org/wiki/Substancje_powierzchniowo_czynne
http://www.watersystem.pl/system_uzdatniania_wody/zmiekczanie
http://portalwiedzy.onet.pl/49808,,,,zmiekczanie_wody,haslo.html
http://pl.wikipedia.org/wiki/Metal_alkaliczny
http://pl.wikipedia.org/wiki/Amfifilowość
http://pl.wikipedia.org/wiki/Napięcie_powierzchniowe
Wyszukiwarka