Białka
Budowa białek: Struktura I-rzędowa- sekwencja aminokwasów struktura II-rzędowa- Struktura α i β-helisa (w wyniku tworzenia się wiązań wodorowych) struktura III-rzędowa- konformacja cząsteczki (wzajemne ułożenie struktury II-rzędowej stabilizowane przez oddziaływanie reszt aminokwasowych oraz tworzenie mostków siarczkowy) struktura IV-aglomeracja cząsteczki (przestrzenna budowa białka zbudowane z kilku łańcuchów białkowych)
Funkcje białek: Enzymy, Hormony, Białka zapasowe, Białka budulcowe, Białka transportujące, Białka ochronne, Białka kurczliwe, Toksyny
Właściwości białek: Globularne- rozpuszczalne w wodzie (lizozym, insulina, mioglobina) Fibrylarne- nierozpuszczalne w wodzie (Kolagen, elastyna, keratyna)
Denaturacja białek: Rozpad wiązań stabilizujących strukturę II i III-rzędowa. Podczas denaturacji niszczone są wiązania wodorowe, a w obecności odczynników redukujących zerwaniu ulegają mostki dwusiarczkowe. Czynniki powodujące denaturacje: Podwyższona temperatura (60-70°C),Niskie i wysokie pH, Promieniowanie, Ultradźwięki, Detergenty, Rozpuszczalniki organiczne, Obecność jonów
Czy zdenaturowane białko jest białkiem pełnowartościowym? Nie. Denaturacja białka powoduje obniżenie wartości odżywczej, utratę właściwości funkcjonalnych. Nadmierne ogrzewanie produktów bogatych w białko powoduje zmniejszenie biologicznej dostępności wielu aminokwasów, przede wszystkim wskutek utrudnienia trawienia.
Jakie grupy funkcyjne występują w łańcucha bocznych aminokwasów białkowych? Łańcuch boczne są bardzo zróżnicowane Cząsteczka aminokwasu składa się z grupy aminowanej -NH3, karboksylowej -COOH, a także z atomu H i z grupy dodatkowej stanowiącej boczny łańcuch aminokwasu. Może to być pierścień aromatyczny, łańcuch alifatyczny, siarka,, gr. wodorotlenkowa, dodatkowa grupa aminowa lub karboksylowa.
Podaj 2 reakcje tych grup, które prowadzą do sieciowania białek? Ogrzewanie grup bogatych w białko może prowadzić do sieciowanie polimerów w reakcji Maillarda Oraz transamidacji
Czy sieciowanie białek wpływa na wartość białka jako źródła aminokwasu? Nadmierne ogrzewanie produktów bogatych w białko powoduje zmniejszenie biologicznej dostępności wielu aminokwasów, przede wszystkim wskutek utrudnienia trawienia.
Aminokwasy egzogenne Nie mogą być syntetyzowane w organizmie człowieka dlatego powinny być dostarczane z pożywieniem. Fenyloalanina, Izoleucyna, Leucyna, Lizyna, Metionina, Treonina, Tryptofan, Walina
Białka pełnowartościowe Zawierają wszystkie niezbędne aminokwasy egzogenne. Białka występujące w żywności pochodzenia zwierzęcego odznaczają się większa wartością biologiczna niż białka roślinne.
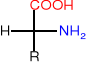
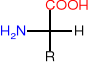
Recemizacja
Zasadowe środowisko i ogrzewanie powoduje recemizacje- powstają D-aminokwasy, które nie są przyswajalne.
L-aminokwas- gorzki D-aminokwas-słodki
Cukry
Dla dowolnie wybranej aldoheksozy narysuj formy współistniejące w wodnym roztworze. Wskaż formę dominującą . β-D glukoza bardziej trwała, ponieważ wszystkie podstawniki w pozycji ekwatorialnej. (korzystniejsza energetycznie)
Mutarotacja- zmiana skręcalności płaszczyzny światła spolaryzowanego roztworu spowodowana wzajemnym przekształcaniem się anomerów.
Cukry redukujące ulegają mutarotacji-(wszystkie cukry za wyjątkiem sacharozy), 2 formy anomeryczne
Cukry nieredukujące- sacharoza, nie ma form anomerycznych, nie ulega mutarotacji
Wytłumacz dlaczego monosacharydy ulegają reakcjom typowym dla grupy karbonylowej.
Monosacharydy posiadają grupę -CHO. Jest to grupa silnie polarna, przy czym częściowo ładunek ujemny znajduje się na atomie O, zaś dodatni na at. C. Powoduje to dużą reaktywność
Reakcja Maillarda- reakcje sacharydów redukujących z aminami
Skutki: Powstają brązowe pigmenty (melanoidyny); Powstają lotne substancje zapachowe; Powstają substancje smakowe; Powstają substancje o właściwościach redukujących(zapobiegające lub opóźniające utlenianie);Straty niezbędnych aminokwasów (lizyna, arginina);Powstaje akryloamid; Powstają substancje powodujące sieciowanie białek
Czynniki wpływające na szybkość reakcji Maillarda
Temperatura; Odczyn środowiska (obniżenie pH zmniejsza szybkość reakcji); Aktywność wody (maksimum szybkości reakcji przy aktywności wody 0.6-0.7); Rodzaj sacharydu (glukoza reaguje szybciej niż fruktoza); Obecność dwutlenku siarki lub jonów HSO3 (reakcja z grupami karbonylowymi); Obecność jonów metali przejściowych Cu(I), Fe (II).
Karmelizacja sacharydów
Reakcje w temperaturze > 100°C, Powstają: Brunatno zabarwione polimery ; Lotne substancje zapachowe ; Substancje smakowe
Karmele - stosuje się do barwienia i aromatyzowania żywności - powstawanie karmelu katalizują kwasy, zasady, sole prowadząc do produktu o odmiennych właściwościach i zastosowaniu
Celuloza i skrobia. Różnica
Skrobia- składa się z glukozy powiązanej wiązaniami 1,4-α-glikozydowymi. W wyniku częściowej hydrolizy skrobi powstaje maltoza, całkowita prowadzi do D-glukozy. Składa się z: -amylozy- łańcuch proste powiązane wiązaniami 1,4 -amylopektyna- występują wiązania 1,4, łańcuch te są połączone w punktach rozgałęzień wiązaniami 1,6
Celuloza- jest nierozgałęzionym polimerem glukozy połączonej wiązaniami 1,4-β-glikozydowymi
Jedyna chemiczna różnicą miedzy skrobia a celuloza jest stereochemia wiązania glikozydowego, a ściśle stereochemia węgla C1kazdej cząsteczki glukozy. W układzie pokarmowym człowieka są enzymy które mogą hydrolizować wiązania α-glikozydowe, nie ma natomiast enzymów potrzebnych do hydrolizy wiązania β-glikozydowego.
Disacharydy
Maltoza-
Celobioza-
Laktoza-
Sacharoza- Ponieważ dwa anomeryczne atomy węgla związane są glikozydowe, żaden z monosacharydów nie ma grupy hemiacetalowej. Dlatego żadna z jednostek nie może się znajdować w stanie równowagi z formą acykliczną. Sacharoza nie ulega mutarotacji ponieważ nie ma wolnej grupy aldehydowej, nie redukuje odczynników Tollensa, Fehlinga. Cukier nieredukujący.
W jakim środowisku następuje hydroliza wiązań glikozydowych? Kwaśnym
Chromatografia, woda itd
Którą z metod chromatografii uważasz za odpowiednia do rozdziału i analizy lipidów? Najczęściej wykorzystuje się w tym przypadku adsorpcyjna chromatografie kolumnową lub cienkowarstwową TLC. Lipidy neutralne eluuje się z kolumny wypełnionej żelem krzemionkowym za pomocą chloroformu, glikolipidy za pomocą acetonu a fosfolipidy za pomocą metanolu. Dalsze rozdzielenie neutralnych lipidów odbywa się na innej kolumnie krzemionkowej. I tak, węglowodory wymywa się heksanem, estry cholesterolu heksanem z dodatkiem 2% eteru, triacyloglicerole heksanem z dodatkiem 5% eteru, cholesterol i diacyloglicerole heksanem z dodatkiem 15% eteru oraz monoglicerole czystym eterem. Podobne efekty uzyskuje się prowadząc rozdzielenie metoda TLC na krzemionce z zastosowaniem mieszaniny heksanu i eteru zwykle z dodatkiem 1-2% kwasu octowego. Złożone lipidy rozdziela się na kolumnach za pomocą chloroformu zawierającego coraz większe ilości metanolu lub za pomocą TLC i odpowiedniej mieszaniny rozpuszczalników. Rf= droga przebyta przez substancję /droga przebyta przez rozpuszczalnik
Którą z metod chromatografii uważasz za najodpowiedniejszą do analizy związków zapachowych? Chromatografia gazowa GC, GLC. Oparta na oddziaływaniu składników z dwoma fazami przemieszczającymi się względem siebie. Analizowana mieszanina jest najpierw przeprowadzana w fazę gazową, następnie próbka jest „porywana” przez gaz nośny i przechodzi przez długa kolumnę w której następuje rozdział na poszczególne związki chemiczne. Na wyjściu kolumny znajduje się detektor, który wykrywa i mierzy stężenia kolejny składników mieszany w gazie nośnym. Czas przejścia danego związku przez całą kolumnę nosi nazwę czasu retencji.
Substancje lotne i trwałe w temp. do 200- 300C związki zapachowe, olejki eteryczne, lipidy, alkaloidy
Lotne pochodne nielotnych lub nietrwałych termicznie związków polarnych estry kwasów tłuszczowych, pochodne aminokwasów, monosacharydów
Co można analizować metodą HPLC?
Substancje polarne, nielotne, rozpuszczalne w wodzie (hydrofilowe), aminokwasy, peptydy, sacharydy, składniki mineralne
Substancje niepolarne, nierozpuszczalne w wodzie (lipofilowe lipidy, alkaloidy, witaminy
Pochodne substancji lotnych lub nietrwałych
Polimorfizm tłuszczów Tłuszcze, ściślej trójglicerole w stanie stałym wykazują zjawisko polimorfizmu, tzn. mogą występować w kilku odmianach krystalicznych. Przemiana jednej formy krystalicznej w drugą może zachodzić na skutek ogrzewania, chłodzenia lub też jako wynik krystalizacji z różnych rozpuszczalników. Na przykład tristearynian może występować w trzech formach krystalicznych o trzech różnych punktach topnienia. Najbardziej stabilna jest forma o najwyższej temperaturze wrzenia.
Rodzaje wody Woda nie związana („wolna”) - właściwości podobne do rozcieńczonych roztworów soli, połączona siecią wiazań wodorowych, ruchliwa Woda związana - otaczająca substancje rozpuszczone lub zawieszone, mniej aktywna; nie zamarza do temperatury -40ºC
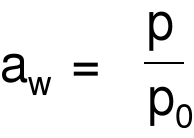
Aktywność wody
p - cząstkowa prężność pary wodnej nad surowcem w danej temp.
p0 - prężność pary czystej wody w tej samej temp.
Które z składników żywności są prekursorami substancji zapachowych podczas obróbki termicznej? Powstawanie substancji zapachowych podczas ogrzewania sacharydów z aminokwasami (leucyna+ skrobia =czekoladowy) Prekursorami substancji zapachowych lotnych są białka, aminokwasy, niebiałkowe związki azotowe, sacharydy, trójglicerole i ich pochodne, witaminy, hormony, nukleotydy. Z aminokwasów= kwasy (kwas fenylooctowy), aldehydy, indole. Z cukrów=furanony (furaneol), piranony
Kwasy tłuszczowe
Jakie kwasy określa się mianem NNKT? W jakich surowcach i w jakiej formie występują najczęściej? To grupa kwasów tłuszczowych , które nie są syntetyzowane w organizmie i trzeba je dostarczać wraz z pożywieniem. Są one niezbędne do prawidłowego rozwoju i funkcjonowania organizmu. Spełniają ważną rolę w zapobieganiu i leczeniu miażdżycy. ω-6 kwas linolowy: oleje roślinne (sojowy, kukurydziany, lniany, słonecznikowy), tłuszcz drobiowy, orzechy, nasiona; kwas arachidonowy: mięso, drób, jaja
ω-3 kwas linolenowy: orzech włoski, kiełki pszenicy, soja, nasiona; EPA i DHA: ludzkie mleko, ryby morskie (łosoś, makrela, tuńczyk, śledź)
Trójacyloglicerole. Podaj nazwę jednego nienasyconego kwasu tłuszczowego występującego w trójglicerolach.
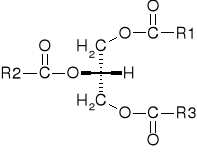
Cząsteczka glicerolu związana z trzema kwasami tłuszczowymi.
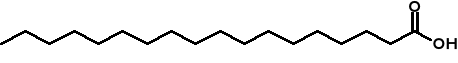
Nasycony- np. stearynowy
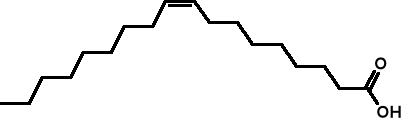
Nienasycone: cis-oleinowy
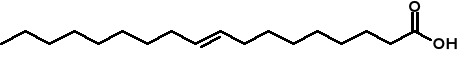
Trans-kwas elaidynowy
Jakie reakcje chemiczne wykorzystuje się w analizie składu kwasów tłuszczowych?
Transestryfikacja - alkoholiza trójacylogliceroli
Które kwasy łatwiej ulegają utlenianiu? Jakie są pierwotne produkty utleniania i jakim dalszym procesom ulegają? Lipidy nienasycone są bardziej podatne na utlenianie. Pierwotnym produktem reakcji są wodorotlenki, które ulegają dalszym reakcją degradacji. Powstają: ketony, aldehydy (zapach, reakcje z białkami) , alkohole, kwasy, epoksydy, alkeny.
Są to reakcje typu rodnikowego: 1. inicjacja - powstawanie rodników 2. propagacja - tworzenie produktu i nowego rodnika 3. terminacja - tworzenie produktów poprzez rekombinację rodników
Jaka reakcja chemiczna trójacylogliceroli jest postawą procesu utwardzania tłuszczów?
Uwodornienie :Zmiana konsystencji tłuszczu: ciekły stały
Skutki: Powstają triglicerydy o wyższej temperaturze topnienia; Zmniejsza się zawartość kwasów wielonienasyconych; Produkty nasycone są mniej podatne na procesy utleniania; Pojawiają się wiązania C=C o konfiguracji trans
Co wpływa na to, że w temperaturze pokojowej część tłuszczy jest w stanie ciekłym, a cześć jest stała? Tłuszcza stałe-nasycone(stearynowy, palmitynowy, masłowy) tłuszcze ciekłe-nienasycone (oleinowy, linolowy) Obecność wiązania podwójnego utrudnia tworzenie kryształów i powoduje obniżenie temperatury topnienia. Tłuszcze roślinne zawierają więcej nienasyconych kwasów tłuszczowych dlatego w temperaturze pokojowej są ciekłe.
Pigmenty
Czynniki wpływające na trwałość pigmentów Światło; Tlen; Metale; Utleniacze; Reduktory; Temperatura; Aktywność wody; Odczyn pH;
Mioglobina Mioglobina (Mb) + O2 = Oksymioglobina (MbO2) Mioglobina (Mb) (Fe2+) = Metmioglobina (MMb) (Fe3+)
Chlorofil Jest najbardziej rozpowszechnionym barwnikiem roślinnym. Występuje on w liściach i innych eksponowanych na światło częściach roślin. Chlorofil jest zaliczany do związków porfirynowych, czyli do związków, w których podstawowy szkielet cząsteczki stanowi układ czterech pierścieni pirolowych połączonych przez grupy metionowe. W centrum cząsteczki występuje atom magnezu połączony wiązaniami kowalencyjnymi i koordynacyjnymi z czterema atomami azotu pierścieni pirolowych. Z kilku znanych barwników chlorofilowych tylko dwa występują u roślin wyższych: chlorofil a - niebieskozielony i chlorofil b - żółtozielony.
-Sabilny w alkalicznym pH -Nietrwały w kwaśnym pH -Ulega fotodegradacji -Tworzy trwałe kompleksy z Cu i Zn -Allomeryzacja - w roztworze alkoholowym utlenia się do 10-hydroksychlorofilu i 10-metoksylaktonu chlorofilu (niebiesko-zielone)
Karetonoidy Barwniki są syntetyzowane głównie przez rośliny. W zielonych częsciach roślin towarzyszą ine chlorofilowi w chloroplastach. Występuja również w kwiatach, owocach, nasionach i korzeniach, gdzie gromadzą się w chromoplastach. Zdolność do syntezy barwników karotenoidowych wykazyja także glony oraz niektóre grzyby i bakterie. Zwierzęta nie mają zdolności syntetyzowania barwników karoteidowych, ale mogą wchłaniać, modyfikować i gromadzić karotenoidy dostarczone z paszą. Obecnie jest znanych ok.600 barwników karotenoidowych i ok. 200 otrzymanych w wyniku syntezy. Dzieli się je na dwie grupy: -karoteny- karetonoidy niezwierające tleny -ksantofile- karetonoidy zawierające w cząsteczce tlen w postaci grup hydroksylowych, epoksydowych i karbonylowych.
Właściwości karotenoidów -Nierozpuszczalne w wodzie -Rozpuszczalne w tłuszczach i rozpuszczalnikach. organicznych -Izomeryzują w podwyższonej temperaturze, w kwaśnym środowisku, pod wpływem światła -Autooksydacja prowadzi do utraty barwy -Przy niskim ciśnieniu tlenu są antyutleniaczami, -Przy wysokim ciśnieniu tlenu są prooksydantami -Dość stabilne w typowych warunkach przechowywania warzyw i owoców
Ksantofile Ksantofile to pochodne tlenowe karotenów (hydroksylowe, ketonowe, aldehydowe, karboksylowe). Mają barwę żółtą lub brązową (gr. ksanthos - żółty). Powstają one przy utlenianiu karotenów przy pomocy enzymów - tzw. oksydaz mieszanych. Najbardziej popularne są pochodne hydroksylowe, których najbardziej rozpowszechnionym przedstawicielem jest luteina.
Antocyjany Antocyjany to duża grupa barwników, bardzo rozpowszechnionych w świecie roślin , nadających owocom i kwiatom atrakcyjne kolory od pomarańczowego przez różne odcienie czerwieni i fioletu aż do barwy niebieskiej. Barwniki antocyjanowe są drugorzędowymi metabolitami roślin zaliczanymi do flawonoidów charakteryzujących się szkieletem węglowy C6-C3-C6. W roślinach występują w formie glikozydów polihydroksy i polimetoksy pochodnych kationu flawyliowego - 2-fenylobenzopiryliowego. -Rozpuszczalne w wodzie -Barwa zależy od pH -Nietrwałe -Najstabilniejsze w środowisku kwaśnym -Nietrwałe w podwyższonej temperaturze, w obecności tlenu -Degradacja pod wpływem światła i enzymów -Kompleksy z metalami -Kopigmentacja
Betalainy Barwniki te są obecne w różnych częściach roślin, a w komórkach gromadzą się głownie w wakuolach głownie w tkankach epidermy i subepidermy. Występowanie betalain w roślinach wyklucza obecność antycyjanów i odwrotnie. Do batalin zalicza się dwie grupy barwników: czerwonofioletowe betacyjaniny i żółte betaksantyny.Dla betalain jest charakterystyczny układ chromoforowy trzech podwójnych wiązań we fragmencie - 1, 7-diazoheptametinowym.
Właściwości betalain -Nietrwałe w alkalicznym pH -Nietrwałe w kwaśnym pH w podwyższonej temperaturze -Trwałe przy niskiej aktywności wody (aw 0.12) -Łatwo ulegają utlenianiu -Światło przyspiesza oksydatywną degradację -Kwas askorbinowy zapobiega ich utlenianiu
Witaminy
Rola witamin in vivo:
Koenzymy lub ich prekursory (tiamina, ryboflawina)
Antyoksydanty (kwas askorbinowy, witamina E)
Mechanizmy regulacji genetycznej (witamina A, D)
Funkcje specjalne (witamina A w procesie widzenia)
Wpływ witamin na zmiany chemiczne w żywności
Czynniki redukujące
Wychwytywacze rodników
Reagenty w procesach brązowienia
Prekursory substancji zapachowych i smakowych
Czynniki wpływające na zawartość witamin w surowcach i produktach
Zmienność podczas wzrostu i dojrzewania
Reakcje enzymatyczne zachodzące po zbiorze
Obróbka wstępna - mycie owoców i warzyw, przemiał ziarna zbóż
Blanszowanie i obróbka termiczna
Reakcje ze składnikami żywności i substancjami dodawanymi podczas procesów technologicznych (SO2, azotyny, substancje zmieniające pH)
Witamina A
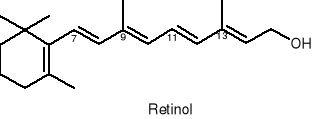
Prowitaminy A: β-karoten, α-karoten, kryptoksantyna, α-apo-8'-karotenal
Degradacja witaminy A: Procesy oksydacyjne, izomeryzacja wiązań C=C, degradacja termiczna
Witamina D
Powstaje w skórze człowieka pod wpływem światła
słonecznego z 7-dehydrocho
Ulega degradacji pod wpływem naświetlania
Ulega degradacji oksydacyjnej pod działaniem tlenu
Ulega degradacji w środowisku alkalicznym
Witamina E: β-, γ-, δ-tokoferole oraz tokotrienole wykazują działanie antyutleniające
Aktywność witaminy E- zależy od konfiguracji centrów chiralnych
Bogate źródła α-tokoferolu:
olej słonecznikowy,
olej z nasion bawełny,
olej kukurydziany,
olej sojowy,
olej z orzeszków ziemnych,
szpinak
Stabilna w warunkach beztlenowych
Ulega szybkiej degradacji w obecności tlenu cząsteczkowego
oraz wolnych rodników
Działanie antyoksydacyjne mają tokoferole i tokotrienole
- wychwytują wolne rodniki (fenolowa grupa OH)
Octan tokoferolu nie jest antyoksydantem
α-Tokoferol dodany przed wędzeniem do bekonu zapobiega
powstawaniu nitrozoamin (wychwytywanie rodników NO, NO2
α-Tokoferol wychwytuje singletowy tlen - utleniając się do chinonu
Witamina K
Menadion - produkt syntetyczny
Filochinon - produkt roślinny (szpinak, kalafior, kapusta)
Menachinony - produkty bakterii jelitowych
Odporna na ogrzewanie
Ulega degradacji fotochemicznej
Zredukowana do hydrochinonu zachowuje aktywność
Witaminy rozpuszczalne w wodzie
Kwas askorbinowy - witamina C
Tiamina (B1)
Ryboflawina (B2)
Niacyna (PP)
Witamina B6
Kwas foliowy
Biotyna (H)
Kwas pantotenowy (B5)
Witamina B12
Kwas L-askorbinowy
(witamina C)
Właściwości redukujące i antyoksydacyjne
Palmitynian lub acetale są rozpuszczalne w lipidach
Kwas dehydroaskorbinowy hydrolizuje do kwasu 2,3-diketo-
gulonowego (traci aktywność)
Łatwo utlenia się w obecności jonów metali Cu2+, Fe3+
Przy niskim stężeniu może być prooksydantem (generuje
rodniki hydroksylowe)
Degradacja prowadzi do produktów nienasyconych, polimerów,
brązowych pigmentów etc.
Funkcjonalne zastosowania witaminy C
Inhibicja enzymatycznego brązowienia
Wychwytywanie wolnych rodników i tlenu
Inhibicja tworzenia nitrozoamin (peklowanie)
Redukcja jonów metali
Regeneracja innych antyoksydantów (np. redukcja rodników tokoferoli)
Tiamina (witamina B1)
Dość odporna na utlenianie i światło
Nietrwała w roztworach obojętnych i alkalicznych
Nietrwała w obecności siarczynów
Trwała w produktach o niskiej aktywności wody
Degradowana enzymatycznie przez tiaminazy
Białka i cukry obniżają szybkość degradacji termicznej
Chlor (obecny w wodzie) przyspiesza degradację
Ryboflawina (witamina B2)
Trwała w roztworach kwaśnych
Nietrwała w roztworach obojętnych i alkalicznychDegradowana fotochemicznie do lumiflawiny i lumichromu
(traci aktywność)
Działa jako sensybilizator podczas fotoutleniania
(degradacja kwasu askorbinowego, lipidów etc.)
Niacyna (witamina PP)
Najtrwalsza z witamin
Odporna na działanie światła
Odporna na utlenianie
Stabilna podczas obróbki termicznej
Występuje także w postaci kompleksów z cukrami, białkami, fenolami - w tej formie nie jest aktywna
Witamina B6
Trwała w roztworach silnie kwaśnych
Degradowana fotochemicznie traci aktywność
Reaguje z wolnymi rodnikami tracąc aktywność
Podczas obróbki termicznej różne formy przekształcają się bez utraty aktywności (reakcje transaminacji)
Szybkość degradacji zależy od formy witaminy, temperatury, pH, obecności białek, aminokwasów, cukrów
Kwas foliowy
W naturze - tetrahydropochodna poliglutamylowa
Ulega degradacji oksydacyjnej (tlen, utleniacze)
Ulega degradacji fotochemicznej
Trwałość zależy od pH - przy pH 1-2 oraz 8-12 najwyższa,
przy pH 4-6 najniższa
Biotyna (witamina H)
Dwie formy w naturze - biotyna i biocytyna
Odporna na utlenianie
Odporna na działanie światła
Odporna na ogrzewanie
Degradacji ulega przy ekstremalnych pH
Silne utleniacze (H2O2) powodują utlenianie siarki
i utratę aktywności
Kwas pantotenowy
Występuje w koenzymie A
Trwały przy pH 5-7
Trwały podcza przechowywania żywności o niskiej aktywności wody
Nie reaguje z innymi składnikami żywności
Podczas ogrzewania hydrolizuje wiązanie amidowe
Witamina B12
Trwała podczas przechowywania i typowej obróbki termicznej
Długotrwała obróbka termiczna powoduje degradację
Degradacja fotochemiczna prowadzi do akwakobalaminy
Najbardziej stabilna przy pH 4-7
Tiamina i nikotynoamid przyspieszają degradację
Przy silnie kwaśnym i alkalicznym pH następuje hydroliza
i utrata aktywności
Wyszukiwarka