Ćwiczenia dodatkowe z chemii organicznej. Kolokwium pierwsze. 24.10.03.
1. (12 p.) Na 1,4-cykloheksadien rozpuszczony w tetrachlorku węgla podziałano nadmiarem bromu. Ile produktów otrzymano? (Odpowiedź na to pytanie może ułatwić rozważenie budowy produktów na wzorach, w których założono płaską budowę pierścienia). Dla każdego z produktów przedstaw, używając wzorów przestrzennych, równanie równowagi pomiędzy krzesłowymi konformerami i wskaż, w którą stronę każda z nich jest przesunięta.
2. (15 p.) Zaproponuj sposób syntezy 1-bromo-2-metylo-2-propanolu z izobutylenu. Przedstaw mechanizm reakcji. Za pomocą wzorów Newmana przedstaw wszystkie, różniące się energią, naprzemian- i naprzeciwległe konformacje produktu wynikające z obrotu dookoła wiązania C1-C2. Podaj ich nazwy biorąc pod uwagę wzajemne usytuowanie podstawników Br i OH.
3. (10 p.) Produktami utleniania pewnego sześcioczłonowego związku cyklicznego za pomocą KMnO4 na gorąco jest równomolowe mieszanina kwasu 3-oksobutanowego (CH3COCH2CO2H) i 2,4-pentanodionu (CH3COCH2COCH3). Podaj wzór i nazwę tego związku. Zaproponuj jego syntezę z nienasyconych węglowodorów łańcuchowych; podaj wzory i nazwy tych węglowodorów. Przedstaw schemat jego ozonolizy.
4. (12 p.) Na p-nitrotoluen podziałano mieszaniną dymiącego kwasu azotowego i stężonego kwasu siarkowego. Podaj wzór i nazwę głównego produktu. Przedstaw mechanizm reakcji. Wyjaśnij związek pomiędzy energią wewnętrzną kompleksów σ mogących się tworzyć w tym procesie a regioselektywnością reakcji.
5. (23 p.) Zaproponuj następujące syntezy
a) (E)-1,4-difenylo-1-butenu z etylobenzenu,
b) kwasu 3,5-dinitrobenzoesowego z toluenu,
c) m-nitroetylobenzenu z benzenu i innych reagentów organicznych,
d) 1-bromo-2-metylo-propan z izobutanu,
e) 3-bromo-2-metylopropen z 2-metylo-2-propanolu,
f) (Z)-3-heksen z (E)-3-heksenu,
6. (18 p.) Przedstaw poniższe równania reakcji za pomocą wzorów chemicznych. Podaj nazwy produktu (produktów).
a) 2,4-heksadien + Br2 (1 mol, niska temperatura) wskaż produkt główny,
b) + chlorowodór (w eterze) (nazwy można pominąć),
Przedstaw mechanizm powyższej reakcji
c) 1-buten + N-bromosukcynoimid (CCl4, hν)
d) 1-metylocykloheksen (1. [BH3], 2. nadtlenek wodoru, OH-)
e) 1,2-dimetylocyklopenten + KMnO4 (0 -50 C)
Pierwsze kolokwium. Ćwiczenia dodatkowe z chemii organicznej. 26.10.01. A
1. Dwa związki o wzorze sumarycznym C8H12 w reakcji ozonolizy dają ten sam, jeden produkt o wzorze CH3COCH2CH=O. Podaj wzory i nazwy obydwu substratów. Przedstaw przebieg reakcji ozonolizy. Podaj wzór produktu reakcji substratów z nadmanganianem potasowym na gorąco.
2. Zaproponuj syntezy następujących związków ze wskazanych substratów podając reagenty i warunki oraz wzory i nazwy związków powstających na kolejnych etapach:
a) cis-4,5-dietylocykloheksen z 3-heksynu i 1,3-butadienu,
b) 1-chloro-2-metylo-2-propanolu z izobutanu,
c) kwasu p-bromobenzoesowego z etylobenzenu,
d) trans-2-metylocykloheksanolu z 1-metylocykloheksenu. Przedstaw za pomocą wzorów przestrzennych trwałe konformery produktu,
e) 1-pentanol z 1-pentenu. Za pomocą wzorów Newmana przedstaw wszystkie, różniące się energią konformacje produktu wynikające z obrotu dookoła wiązania C1-C2. Podaj ich nazwy. Wskaż najmniej i najbardziej trwałą. Jakie czynniki decydują o energii wewnętrznej konformerów?
f) 1,4-difenylo-1-butynu z winylobenzenu,
g) m-nitropropylobenzenu z benzenu i innych dowolnych reagentów.
3. Na t-butylobenzen podziałano chlorkiem kwasu octowego (CH3COCl) w obecności chlorku glinu. Napisz równanie stechiometryczne reakcji. Przedstaw jej mechanizm. Na podstawie trwałości kompleksów σ uzasadnij jej regioselektywność.
4. Podaj wzory i nazwy produktów powstających w wyniku działania N-bromosukcynoimidu na 1-penten. Do jakiej klasy należy ta reakcja?
5. Przedstaw przebieg i podaj wzory oraz nazwy produktów reakcji 2,4-heksadienu z jednym molem bromu. W jaki sposób można wpływać na skład mieszaniny poreakcyjnej. Odpowiedź uzasadnij.
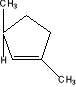
6. Przedstaw mechanizm reakcji 1,3-dimetylocyklpentenu (o budowie podanej poniżej) z bromowodorem w eterze etylowym. Jaki to jest typ reakcji? Czy jest ona a) regioselektywna, b) stereoselektywna? Wyjaśnij.
Pierwsze kolokwium. Ćwiczenia dodatkowe. 25.10.2002. A
1. (13 p.) 1,2-Dimetylo-1,4-cykloheksadien można otrzymać jako jedyny produkt w reakcji dienowej z węglowodorów A i B lub C i D. Proszę:
a) narysować za pomocą wzorów schematy obu reakcji oraz podać nazwy związków A, B, C i D,
b) podać wzór produktu powstającego z 1,2-dimetylo-1,4-cykloheksadienu pod działaniem gorącego, wodnego roztworu KMnO4,
c) podać wzór i nazwę produktu będącego wynikiem reakcji 1,2-dimetylo-1,4-cykloheksadienu z nadmiarem wodoru wobec palladu.
2. (18 p.)Na chlorobenzen podziałano chlorkiem izobutylu (1-chloro-2-metylopropanem) w obecności chlorku glinu. Proszę podać ogólną nazwę typu tej reakcji oraz przedstawić jej mechanizm. Proszę wyjaśnić związek pomiędzy regioselektywność reakcji a trwałością kompleksów σ jakie mogą się tu tworzyć.
3. (42 p.) Zaproponuj syntezy następujących związków ze wskazanych substratów podając reagenty i warunki oraz wzory i nazwy związków powstających na kolejnych etapach:
a) 2-chloro-1-fenyloetanol z etylobenzenu,
b) kwas 4-bromo-3-nitrobenzoesowy z toluenu,
c) cis-1,2-cykloheksanodiol (cis-1,2-dihydroksycykloheksan) z cykloheksanolu,
d) (E)-6-metylo-3-hepten z alkenów posiadających 4 atomy węgla w cząsteczce,
e) p-etyloacetofenon (p-Et-C6H4-C(O)CH3) z benzenu i chlorku kwasu octowego (CH3COCl),
f) trans-2-metylocykloheksanol z metylenocykloheksanu,
4. (14 p.) Proszę przedstawić mechanizm reakcji cykloheksenu z roztworem bromu w CCl4 i narysować wzory przestrzenne konformerów otrzymanego produktu wynikające z inwersji wiązań pierścienia. Proszę wskazać konformer mniej trwały?
5. (12 p.) Z dowolnego alkenu otrzymaj 1-butanol. Używając wzorów Newmana przedstaw wszystkie różniące się energią naprzeciw i naprzemianległe konformacje tego związku wynikające z obrotu dookoła wiązania C1-C2. Podaj ich nazwy oraz wskaż najtrwalszą.
6. (6 p.) Na 1,4-dimetylo-1,4-cykloheksadien podziałano nadmiarem bromowodoru w eterze etylowym. Ile związków otrzymano? Przedstaw ich wzory określające przestrzenne rozmieszczenie podstawników (dla uproszczenia atomy węgla pierścienia można ulokować na tej samej płaszczyźnie).
Kolokwium I. 30.03.2001 A
1. Podaj wzór i nazwę głównego produktu (lub głównych produktów) organicznego następujących reakcji lub zaznacz, że reakcja nie zachodzi.
a) 2-metylobutan + Br2 (Δt, hν),
b) cyklopenten + Br2 (CCl4),
c) 2-metylo-2-buten + HBr (eter),
d) styren + 1) [BH3], 2)H2O2/NaOH,
e) 1,3-dimetylocykloheksen + KMnO4 (Δt) - nazwę produktu można pominąć,
f) 1-butyn + NaOH (t. pokojowa),
g) 1-buten + Br2/H2O,
h) cyklopenten + 1) OsO4, 2) NaHSO3,
i) 2-pentyn + H2 (Pd, BaSO4),
j) chlorobenzen + chlorek izobutylu (AlCl3),
k) 1,3-pentadien + HBr,
l) 2,3-dimetylo-1,3-butadien + (E)-2-buten (Δt, Δp),
m) p-nitroizopropylobenzen + KMnO4 (Δt)
2. Narysuj wzory przestrzenne wszystkich izomerów dichlorocyklopropanu. Zaznacz gwiazdką asymetryczne atomy węgla. Czy wszystkie izomery są związkami chiralnymi? Uzasadnij. Określ stereochemiczną relację pomiędzy każdą parą izomerów.
3. Na 1-buten podziałano chlorowodorem w rozpuszczalniku organicznym.
a) przedstaw mechanizm reakcji i podaj jej nazwę,
b) na podstawie mechanizmu wyjaśnij, czy mieszanina poreakcyjna będzie wykazywała czynność optyczną,
c) narysuj wzory przestrzenne i odpowiadające im wzory Fischera otrzymanych produktów i określ konfigurację absolutną podstawników przy asymetrycznym atomie węgla,
d) narysuj wzory Newmana trwałych konformacji produktu wynikających z obrotu dookoła wiązania C2-C3. Podaj wspólną nazwę tych konformacji.
4. Chlorobenzen poddano działaniu mieszaniny nitrującej. Co otrzymano? Podaj nazwę reakcji i na podstawie mechanizmu uzasadnij jej regioselektywność (wykorzystaj porównanie trwałości kompleksów σ).
5. Używając wzorów przestrzennych narysuj krzesłowe konformacje trans-1,2-dibromocykloheksanu wynikające z inwersji wiązań pierścienia. Wyjaśnij, która z nich ma niższą energię i dlaczego. Jakie oddziaływania o tym decydują?
6. Zaproponuj syntezy związków z podanych substratów i innych potrzebnych reagentów. Zaznacz warunki niezbędne dla przeprowadzenia każdego etapu.
a) p-Nitropropylobenzen z benzenu,
b) (E)-2-heksen z propynu i propenu,
c) Kwas 4-chloro-3-nitrobenzoesowy z toluenu.
Pierwsze kolokwium z chemii organicznej. 22.03.2002. A
1. (20 p.) W wyniku reakcji Dielsa-Aldera między dwoma węglowodorami A i B otrzymano tylko jeden produkt, C, który poddano działaniu ozonu a następnie wody w redukującym środowisku. Otrzymano jako jedyny związek 2,4-heksanodion [CH3CH2C(O)CH2C(O)CH3]. Przedstaw schemat wymienionych reakcji podając ich warunki oraz nazwy związków A, B i C. Narysuj wzory produktów reakcji (mogą powstać dwa związki) związku C z nadmiarem wodoru wobec platyny zaznaczając przestrzenne rozmieszczenie podstawników. Dla uproszczenia występujące w związkach pierścienie można przedstawić jako płaskie.
2. (16 p.)Na 1-etylo-4-metylo-1,4-cykloheksadien podziałano nadmiarem bromowodoru w polarnym rozpuszczalniku. Ile produktów otrzymano? Odpowiedź uzasadnij na podstawie mechanizmu reakcji. Przedstaw wzory przestrzenne trwałych konformerów, wynikających z inwersji pierścienia dla jednego z otrzymanych produktów.
3. (18 p.)Toluen poddano działaniu 1-chloropropanu w obecności chlorku glinu. Przedstaw mechanizm tej reakcji i na podstawie trwałości kompleksów σ uzasadnij jej regioselektywność.
4. (23 p.) Podaj wzory produktów poniższych reakcji
a) p-Ksylen + CH3C(O)Cl + AlCl3
b) 5,5-Dimetylocyklopentadien + 1 mol HBr
Przedstaw mechanizm tej reakcji. Podaj nazwy produktów. (We wzorach i nazwach produktów budowę przestrzenną można zaniedbać).
c) 1-Butyn + 1) [BH3], 2) H2O2/ OH-
d) Fenyloeten + Br2 w H2O
e) Cyklopenten + KMnO4 aq (50 C)
f) 1-Fenylopropen + NBS (CCl4, Δt, hν)
g) 1-Fenylopropyn + Na + NH3 (c)
5. (26 p.) Zaproponuj syntezy następujących związków ze wskazanych substratów podając reagenty i warunki oraz wzory i nazwy związków powstających na kolejnych etapach:
a) (Z)-3-Okten z 1-butenu, jedynego substratu organicznego
b) Kwasu 2-bromo-4-nitrobenzoesowego z etylobenzenu
c) trans-2-Metylocykloheksanol z metylenocykloheksanu
d) 1-Bromo-1-fenylobutan z benzenu i innych potrzebnych reagentów
6. (11 p.) Za pomocą wzorów Newmana narysuj wszystkie naprzeciw- i naprzemianległe konformacje wynikające z obrotu dookoła wiązania pomiędzy atomami węgla w 1,2-dibromoroetanie. Podaj ich nazwy. Zaznacz konformację najbardziej i najmniej trwałą. Objaśnij jakie czynniki wpływają na zróżnicowanie energii wewnętrznej tych konformacji
Pierwsze kolokwium z chemii organicznej. 14.03.03. A
1. (21 p.) Ogrzewając mieszaninę dwóch węglowodorów A i B pod zwiększonym ciśnieniem otrzymano związek cykliczny C, który po uwodornieniu dał trans-1,2-dimetylocykloheksan (D).
a) Za pomocą wzorów chemicznych przedstaw schemat powyższych reakcji. Podaj nazwy wszystkich występujących w nim związków organicznych.
b) Narysuj wzory przestrzenne krzesłowych konformacji produktu D. Wyjaśnij, najlepiej posługując się odpowiednimi wzorami, jakie czynniki decydują o ich różnej energii potencjalnej. Wskaż konformację trwalszą.
c) Przedstaw wzory produktu reakcji związku C (pierścień cykloheksanu można tu potraktować jako płaski) z ozonem (E) oraz produktu hydrolizy związku E w środowisku redukującym.
2. (20 p.) Przedstaw mechanizmy poniższych reakcji. Wskaż etapy decydujące o szybkości każdej z nich.
a) 1-Metylocyklopenten + brom w wodzie.
b) 1,2-Dimetylocyklopenten + woda + kwas siarkowy (katalizator).
c) 1-Metylocyklopenten + HBr (RO-OR + hν - katalizatory).
d) 2,4-Heksadien + bromowodór (1 mol).
3. (24 p.) Podaj wzory produktów reakcji:
2-Metylo-2-buten +
a) bromowodór w eterze,
b) nadmanganian potasu w wodzie (niska temperatura),
1-Pentyn +
a) woda, (Hg2+, H+ - katalizatory),
b) I) borowodór, II) nadtlenek wodoru w środowisku zasadowym,
c) amidek sodu w ciekłym amoniaku,
d) 2 mole bromowodoru.
1-Metylocyklopenten +
a) I) tetratlenek osmu, II) wodorosiarczyn sodu
b) I) borowodór, II) nadtlenek wodoru w środowisku zasadowym,
1,4-Dimetylo-1,4-cykloheksadien +
a) KMnO4 aq., Δt.
Podaj także wzór innego izomerycznego związku, który da identyczny wynik reakcji utleniania
b) bromowodór w rozpuszczalniku organicznym - 2 mole. Rysując wzory produktów pierścień cykloheksanu można przyjąć jako płaski.
4. (18 p.) Zaproponuj schematy poniższych syntez. Reagenty nieorganiczne można stosować bez ograniczeń.
a) 2-Metylo-1,4-pentadien z izobutanu i acetylenu
b) (E)-2-penten z 1-chloropentanu.
5. (8 p.) Przedstaw za pomocą wzorów Newmana wszystkie, wynikające z obrotu dookoła wiązania C3-C4 konformacje 2,2,3-trimetylopentanu, którym odpowiadają minima energii. Wskaż konformację o najwyższej i najniższej energii potencjalnej.
KOLOKWIUM I
Chemia organiczna B, 25.03.04
1. (15 p) Na 4-tert-butylo-1-metylo-cykloheksen podziałano bromowodorem w polarnym rozpuszczalniku.
a. Ile produktów otrzymano? Podaj ich budowę. Odpowiedź uzasadnij na podstawie mechanizmu reakcji (pierścień można potraktować jako płaski).
b. Dla każdego produktu podaj wzór przestrzenny konformeru o najniższej energii.
2. (19 p) Dwa izomeryczne węglowodory A i B poddano ozonolizie otrzymując w każdym przypadku takie same produkty: aldehyd octowy (CH3CHO) i aldehyd masłowy (butanal, CH3CH2CH2CHO).
a. Podaj wzory i nazwy związków A i B.
b. Przedstaw przebieg reakcji ozonolizy A lub B.
c. Zaproponuj syntezę związków A i B z propenu jako jedynego substratu organicznego.
d. Podaj produkty utleniania związku A lub B za pomocą KMnO4/H2O w podwyższonej temperaturze.
3. (21 p) Przedstaw poniższe równania reakcji za pomocą wzorów chemicznych. Podaj wzór i nazwę produktu (lub produktów) lub zaznacz, że reakcja nie zachodzi. (19 p)
a. 2-metylobutan + Cl2 (h),
b. 1-etylocyklopenten + 1. [BH3], 2. H2O2/NaOH,
c. 1-etylocyklopenten + H2O/H2SO4 kat.
d. cykloheksen + KMnO4/H2O, niska temperatura (pierścień można potraktować jako płaski),
e. 1-pentyn + Br2 (1 mol),
f. 2-pentyn + NaNH2/NH3 (ciekły),
g. 2-butyn + HBr (nadmiar, środowisko polarne),
h. 3-heksen + NBS (N-bromosukcynoimid), (RO)2, CCl4, t.
4. (15 p) Podaj mechanizmy następujących reakcji:
a. 1-etylocykloheksen + Br2 w wodzie (pierścień można potraktować jako płaski),
b. 2,4-heksadien + Cl2 (1 mol),
c. 2-metylopropen + HBr (nadtlenki); polecenie dodatkowe - narysuj wzory Newmana, wynikających z obrotu dookoła wiązania C1-C2, konformacji produktu, którym odpowiadają minima energii.
5. (16 p) Wykorzystując reakcję Dielsa-Aldera zaproponuj syntezę cis- i trans-1,2-dimetylocykloheksanu z acyklicznych węglowodorów nienasyconych. Dla każdego izomeru przedstaw równanie równowagi pomiędzy krzesłowymi konformerami i wskaż, w którą stronę każda z nich jest przesunięta. Uzasadnij.
KOLOKWIUM I
Chemia organiczna B, 24.03.05
(20 p.) Podaj wzory strukturalne i nazwy izomerycznych węglowodorów A, B, C o wzorze sumarycznym C6H10 na podstawie następujących informacji: 1) tylko związek A reaguje z amoniakalnym roztworem AgNO3 dając osad; 2) każdy z węglowodorów A i B przyłącza w obecności kat. Ni 2 mole H2 dając heksan, a C przyłącza tylko 1 mol dając węglowodór o wzorze sumarycznym C6H12; 3) B utleniany KMnO4 daje kwas propanowy (2 mole, CH3CH2CO2H); 4) w wyniku ozonolizy C powstaje heksano-1,6-dial (O=HC(CH2)4CH=O). Napisz schematy wszystkich wymienionych reakcji.
(24 p.) Z 2-metylopropenu oraz innych niezbędnych reagentów otrzymać:
1-bromo-2-metylopropan,
3-bromo-2-metylopropen,
1,3-dibromo-2-metylopropan,
2-metylopropan-1-ol [(CH3)2CHCH2OH],
2-metylopropano-1,2-diol.
Polecenia dodatkowe: 1) zaproponuj syntezę 2-metylopropenu z 2-metylopropanu, 2) dla związku wymienionego w 1 narysuj wszystkie konformacje naprzeciwległe i naprzemianległe różniące się energią a wynikające z obrotu wokół wiązania C1-C2. wskaż, którym konformacją odpowiadają minima energetyczne, a którym maksima.
(18 p.) Na (Z)-heks-3-en podziałano bromem w wodzie. Podaj steryczny przebieg reakcji za pomocą wzorów przestrzennych albo wzorów rzutowych Newmana. Narysuj wzory Fischera produktów, podaj ich nazwy z uwzględnieniem konfiguracji absolutnej. Czy produkty są chiralne? Czy mieszanina poreakcyjna wykazuje czynność optyczną? Odpowiedzi proszę uzasadnić.
(14 p.) 2,3-Dimetylobuta-1,3-dien poddano reakcji z but-2-ynem w podwyższonej temperaturze i pod zwiększonym ciśnieniem. Podaj wzór oraz nazwę produktu. Produkt wymienionej reakcji poddano reakcji z nadmiarem wodoru w obecności kat. Pd otrzymując dwa stereoizomeryczne węglowodory. Podaj ich budowę przestrzenną zakładając płaską budowę pierścienia oraz narysuj ich konformacje krzesłowe.
(12 p.) Podaj produkty oraz mechanizmy następujących reakcji
2,3-dimetylobuta-1,3-dien + 1 mol Cl2 →
1,4-dimetylocykloheksen + H2O, kat. H2SO4 →
(8 p.) Z 1-bromobutanu jako jedynego odczynnika organicznego oraz dowolnych odczynników nieorganicznych otrzymać (Z)-okt-3-en oraz (E)-okt-3-en
1,4-dimetylocykloheksen + H2O, kat. H2SO4 →
(8 p.) Z 1-bromobutanu jako jedynego odczynnika organicznego oraz dowolnych odczynników nieorganicznych otrzymać (Z)-okt-3-en oraz (E)-okt-3-en.
Chemia Organiczna B
Kolokwium 1, 23.03.2006 r.
(20 p.) Zaproponuj syntezy następujących związków ze wskazanych substratów oraz innych niezbędnych reagentów. Podaj warunki kolejnych reakcji i użyte w nich reagenty.
a) (6) 1,3-dibromo-2-metylo-propanu z 2-metylopropanu
b) (3+3) trans-2-metylocykloheksanolu z 1-metylocykloheksanolu. (Schemat syntezy przedstaw zakładając płaską budowę pierścienia cykloheksanu.) Polecenie dodatkowe: za pomocą wzorów przestrzennych przedstaw równanie równowagi pomiędzy krzesłowymi konformerami otrzymanego związku, oraz wskaż, w którą stronę jest ona przesunięta. (3)
c) (8) (E)- i (Z)-heks-3-enu z but-1-enu i z etylenu. Heksyn 5 p., redukcje 2*1,5
(21 p.) Trzy izomeryczne związki A, B i C mają wzór sumaryczny C6H10. W reakcji z wodorem w obecności niklu dają taki sam produkt. W wyniku utleniania związku A w wodnym roztworze KMnO4 otrzymuje się związek o budowie: CH3COCH2CH2CH2CO2H (kwas 5-okso-heksanowy). Związek B jest chiralny. Związki A i C w reakcji z bromowodorem dają taki sam produkt. Podaj wzory strukturalne i nazwy związków A, B i C oraz napisz schematy wszystkich reakcji wymienionych w zadaniu. Podaj wzory produktów jakie powstaną podczas ozonolizy związków B i C.
A, B, C wzory i nazwy - 3*3; utlenianie A - 2, addycja HBr - 2*1,5; uwodornienie - 2*1,5; ozonoliza 2*2
(20 p.) Narysuj wzory przestrzenne, wzory rzutowe Fischera oraz podaj nazwy uwzględniające konfigurację absolutną wszystkich stereoizomerycznych 2,3-dibromobutanów. Wskaż pary enancjomerów oraz diastereoizomerów. Czy wszystkie one są chiralne? Odpowiedź uzasadnij. Jaki produkt powstanie podczas addycji bromu do (E)-but-2-enu. Podaj steryczny przebieg reakcji za pomocą wzorów przestrzennych.
Wzory i nazwy - 3*3; pary stereoizomerów 3*1; chiralność - 3; mechanizm - 5
(18 p.) Podaj produkty oraz mechanizmy następujących reakcji:
a) (6) 2-metylobut-2-en + Br2/H2O (nadmiar) →
b) (6) cyklopenten + KMnO4 (niska temperatura) →
c) (6) 1-metylocykloheksen + H2O/kat. H2SO4 stęż. (Mechnizm reakcji przedstaw zakładając płaską budowę pierścienia cykloheksanu.)
(17 p.) Przedstaw poniższe równania reakcji za pomocą wzorów chemicznych. Podaj wzór i nazwę produktu lub zaznacz, że reakcja nie zachodzi:
a) (2) but-1-en + NaNH2/ciekły amoniak →
b) (2) CH3CH2C≡C-Na+ + woda→
c) (2) pent-1-yn + 1 mol Br2 →
d) (2) heks-3-yn + 2 mole HCl →
e) (3) buta-1,3-dien + (E)-pent-2-en/t,p → (mieszanina racemiczna)
f) (3) heksa-2,4-dien + 1 mol Cl2→
g) (3) 1,2,4-trimetylocyklopenten + H2/kat. Ni → (mieszanina diastereoizomerów)
Ćwiczenia dodatkowe z chemii organicznej B
Kolokwium I 25.10.07
1. (24 p.)Butan poddano chlorowaniu (Cl2/h) otrzymując mieszaninę trzech związków A, B, i C (związki B i C są stereoizomerami), którą poddano reakcji z alkoholowym roztworem KOH otrzymując trzy izomeryczne produkty D, E i F (D i F są diasteroizomerami). Mieszaninę D, E i F poddano reakcji z HBr w środowisku polarnym otrzymując dwa stereoizomeryczne związki G i H.
Zapisz za pomocą wzorów chemicznych schemat zachodzących reakcji oraz podaj wzory i nazwy związków oznaczonych dużymi literami. Dla związków, które są steroizomerami narysuj wzory przestrzenne.
Podaj mechanizm reakcji chlorowania na przykładzie powstawania związku A.
Wyjaśnij dlaczego każdy ze związków D, E i F w reakcji z HBr da te same produkty G i H.
2. (32 p.) Zaproponuj syntezy następujących związków z podanych substratów organicznych oraz innych niezbędnych reagentów:
1-bromo-1-fenylopropanu z benzenu i chlorku propanoilu (CH3CH2COCl);
(Z)-okt-3-enu z but-1-enu;
cis-1,2-dimetylocykloheksanu z 2,3-dimetylobut-1,3-dienu; polecenie dodatkowe - proszę przedstawić równanie równowagi pomiędzy konformerami produktu;
kwasu 2-chloro-4-nitro-benzoesowego z toluenu;
mezo-2,3-dibromobutanu z alkenu zawierającego cztery atomy węgla; polecenia dodatkowe - schemat syntezy przedstaw na wzorach przestrzennych, narysuj wzór Fischera produktu.
3. (12 p.)Na etylobenzen podziałano chlorkiem izobutylu (1-chloro-2-metylopropanem) w obecności chlorku glinu. Napisz równanie stechiometryczne reakcji. Przedstaw jej mechanizm. Na podstawie trwałości kompleksów σ uzasadnij jej regioselektywność.
4. (16 p.) Dwa izomeryczne związki A i B utleniane wodnym roztworem nadmanganianu potasu na gorąco dają jeden ten sam produkt - CH3CH2COCH2COOH (2 mole). Podaj wzory i nazwy obu związków. Podaj wzór produktu ich ozonolizy. Który z wymienionych związków A i B można otrzymać w reakcji Dielsa-Aldera jako pojedynczy związek. Podaj substraty i warunki reakcji, w której on powstaje.
5. (17 p.) Przedstaw poniższe równania reakcji za pomocą wzorów chemicznych. Podaj nazwy produktu (produktów);
pent-1-en + N-bromsukcynoimid (NBS, CCl4, h) → A+B (izomery konstytucyjne);
heksa-2,4-dien + 1 mol Cl2 (środowisko polarne) → A+B (izomery konstytucyjne);
but-2-yn + 1 mol HBr (środowisko polarne) → A;
but-2-yn + 2 mole HCl (środowisko polarne) → A;
1-metylocyklopent-1-en + [BH3] → A (+ H2O2/OH−) → A;
1,2,3-trimetylcyklopeten + H2/Pd → A+B (diastereoizomery);
cykloheksen + KMnO4, aq (niska temperatura) → A
Kolokwium I
27.03.2008
1. (18 p.) (Z)-3,4-dimetyloheks-3-en poddano niezależnie dwóm reakcjom: z KMnO4,aq w 0°C oraz z Br2.
a) Przedstaw przebieg (mechanizm) obu reakcji za pomocą wzorów przestrzennych.
b) Narysuj wzory Fischera produktu(ów), oraz podaj nazwy uwzględniające konfigurację absolutną.
c) Czy produkty reakcji wykazują czynność optyczną? Uzasadnij odpowiedź. W jakiej relacji stereochemicznej pozostają produkty reakcji z bromem?
2. (14 p.) p-(Trifluorometylo)toluen poddano reakcji z mieszaniną nitrującą (HNO3,stęż. + H2SO4, stęż.)
a) Podaj mechanizm reakcji.
b) Wyjaśnij regioselektywność reakcji na podstawie trwałości kompleksów σ.
3. (15 p.) Zapisz reakcje za pomocą wzorów. Podaj wzory produktów, oraz nazwy produktów oznaczonych pogrubioną czcionką.
3-metylopentan + Br2/h → (produkt główny)
pent-1-en + HBr/(RO)2 →
1-etylocykloheksen + Br2/H2O (nadmiar)
etylobenzen + 1-chloropropan/kat. AlCl3 → A
but-1-yn + 2 mol HCl (środowisko polarne) →
(S)-3-metylopent-1-en + HBr (eter) → (narysuj wzory przestrzenne produktów)
2,3-dimetylobuta-1,3-dien + Cl2 (1 mol) →
4. (37 p.) Zaproponuj metody syntezy następujących związków z podanych substratów organicznych i niezbędnych reagentów nieorganicznych.
a) (Z)-1-fenylopent-2-enu z toluenu i but-1-ynu,
b) p-bromopropylobenzenu z benzenu i bezwodnika propanowego [(CH3CH2CO)2O],
c) trans-2-metylocykloheksanolu z etenu i 2-metylobuta-1,3-dienu; polecenie dodatkowe: przedstaw równowagę pomiędzy konformacjami krzesłowymi produktu;
d) kwasu 4-chloro-3-nitrobenzoesowego z benzenu i etylenu.
e) (E)-pent-2-enu z (Z)-pent-2-enu.
5. (12 p.) Podaj wzory strukturalne i nazwy izomerycznych węglowodorów A, B i C, o wzorze C6H10 mających następujące właściwości: 1) A i B przyłączają 2 mole, a C 1 mol bromu; 2) A i B ulegają redukcji wobec Pt dając ten sam alkan C6H14; 3) A reaguje z Na w ciekłym amoniaku dając produkt o wzorze C6H12, z którego po ozonolizie otrzymuje się aldehyd propionowy (CH3CH2CHO); 4) B strąca osad z amoniakalnego roztworu soli Cu(I); 5) ozonoliza C prowadzi do CH3CO(CH2)3CHO. Napisz schematy wszystkich wymienionych reakcji.
Ćwiczenia dodatkowe z chemii organicznej B
Kolokwium I 25.10.07
1. (24 p.) Butan poddano chlorowaniu (Cl2/h) otrzymując mieszaninę trzech związków A, B, i C (związki B i C są stereoizomerami), którą poddano reakcji z alkoholowym roztworem KOH otrzymując trzy izomeryczne produkty D, E i F (D i F są diasteroizomerami). Mieszaninę D, E i F poddano reakcji z HBr w środowisku polarnym otrzymując dwa stereoizomeryczne związki G i H.
Zapisz za pomocą wzorów chemicznych schemat zachodzących reakcji oraz podaj wzory i nazwy związków oznaczonych dużymi literami. Dla związków, które są steroizomerami narysuj wzory przestrzenne.
Podaj mechanizm reakcji chlorowania na przykładzie powstawania związku A.
Wyjaśnij dlaczego każdy ze związków D, E i F w reakcji z HBr da te same produkty G i H.
2. (32 p.) Zaproponuj syntezy następujących związków z podanych substratów organicznych oraz innych niezbędnych reagentów:
1-bromo-1-fenylopropanu z benzenu i chlorku propanoilu (CH3CH2COCl);
(Z)-okt-3-enu z but-1-enu;
cis-1,2-dimetylocykloheksanu z 2,3-dimetylobut-1,3-dienu; polecenie dodatkowe - proszę przedstawić równanie równowagi pomiędzy konformerami produktu;
kwasu 2-chloro-4-nitro-benzoesowego z toluenu;
mezo-2,3-dibromobutanu z alkenu zawierającego cztery atomy węgla; polecenia dodatkowe - schemat syntezy przedstaw na wzorach przestrzennych, narysuj wzór Fischera produktu.
3. (12 p.) Na etylobenzen podziałano chlorkiem izobutylu (1-chloro-2-metylopropanem) w obecności chlorku glinu. Napisz równanie stechiometryczne reakcji. Przedstaw jej mechanizm. Na podstawie trwałości kompleksów σ uzasadnij jej regioselektywność.
4. (16 p.) Dwa izomeryczne związki A i B utleniane wodnym roztworem nadmanganianu potasu na gorąco dają jeden ten sam produkt - CH3CH2COCH2COOH (2 mole). Podaj wzory i nazwy obu związków. Podaj wzór produktu ich ozonolizy. Który z wymienionych związków A i B można otrzymać w reakcji Dielsa-Aldera jako pojedynczy związek. Podaj substraty i warunki reakcji, w której on powstaje.
5. (17 p.) Przedstaw poniższe równania reakcji za pomocą wzorów chemicznych. Podaj nazwy produktu (produktów);
pent-1-en + N-bromsukcynoimid (NBS, CCl4, h) → A+B (izomery konstytucyjne);
heksa-2,4-dien + 1 mol Cl2 (środowisko polarne) → A+B (izomery konstytucyjne);
but-2-yn + 1 mol HBr (środowisko polarne) → A;
but-2-yn + 2 mole HCl (środowisko polarne) → A;
1-metylocyklopent-1-en + [BH3] → A (+ H2O2/OH−) → A;
1,2,3-trimetylcyklopeten + H2/Pd → A+B (diastereoizomery);
cykloheksen + KMnO4, aq (niska temperatura) → A
Wyszukiwarka