9. A L K O H O L E
Aleksander Kołodziejczyk 2011.
9.1 Wprowadzenie
Alkoholami nazywane są związki organiczne zawierające grupę hydroksylową (-OH) związaną z nasyconym atomem węgla, tzn. z atomem węgla o hybrydyzacji sp3. Związki, w których grupa hydroksylowa znajduje się przy atomie C o hybrydyzacji sp2 nazywają się enolami, a w szczególnym przypadku fenolami.
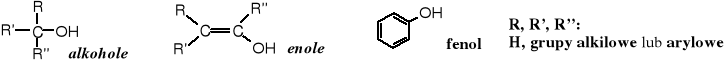
Znane są alkohole nienasycone i aromatyczne (nazwy zwyczajowe), ale w nich grupa -OH nie jest związana z C sp2.

Alkohole, z uwagi na rzędowość atomu węgla, z którym związana jest grupa hydroksylowa dzielą się na:
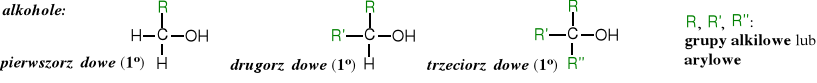
Alkohole można uważać za pochodne alkanów, w których atom wodoru został zastąpiony przez grupę -OH, lub za pochodne wody powstałe w wyniku zamiany jednego atomu wodoru na resztę alkilową.
![]()
9.2 Występowanie
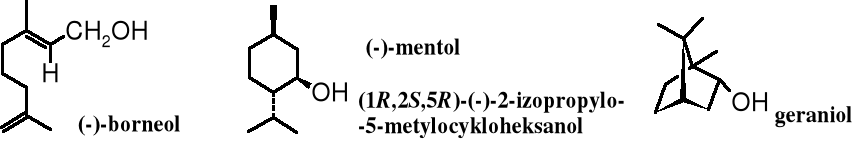
Alkohole są rozpowszechnione w przyrodzie. Występują bądź w stanie wolnym, bądź częściej - związanym, np. w postaci estrów. Najbardziej znanym alkoholem jest etanol - produkt fermentacji alkoholowej cukrów. Wiele naturalnych alkoholi występujących w stanie wolnym ma skomplikowaną budowę.
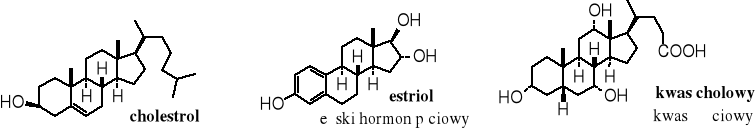
Grupa terpenoidów.
grupa steroli (steroidów)
Glicerol (dawniej gliceryna) - HOCH2CH(OH)CH2OH - można uznać za jeden z najpopularniejszych alkoholi, ponieważ w postaci związanej wchodzi w skład tłuszczów, czyli estrów glicerolu z kwasami tłuszczowymi. Glicerol jest ponadto składnikiem fosfolipidów. Estrami są też woski, czyli pochodne wyższych alkoholi i wyższych kwasów tłuszczowych.
Cukry, zarówno monocukry, oligocukry, jak i policukry (celuloza, skrobia i inne) mogą też być zaliczone do alkoholi, pomimo że mają jeszcze inną grupę funkcyjną, są bowiem polihydroksyaldehydami lub polihydroksyketonami. Cukry, głównie ze względu na policukry, są substancjami organicznymi, które w naturze przewyższają tonażowo wszystkie pozostałe związki organiczne razem wzięte. W największych ilościach występuje celuloza.
9.3 Nomenklatura
9.3.1 Nazewnictwo systematyczne
Według zasad IUPAC nazwy alkoholi wywodzą się od nazw alkanów o takim samym szkielecie węglowym (węglowodorów macierzystych), a tworzy się je przez dodanie do nazwy węglowodoru macierzystego przyrostka (końcówki) -ol, np. metan - metanol, etan - etanol; nazwa izopropanol jest niepoprawna, ponieważ nie ma izopropanu.
Lokanty dobiera się według zasady najniższego zestawu, a lokant określający położenie grupy hydroksylowej umieszcza się pomiędzy rdzeniem nazwy, a przyrostkiem -ol.
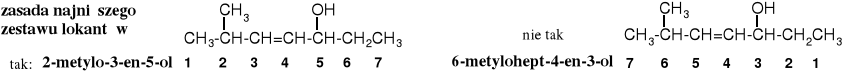
Zestaw lokantów: 2,3,5 3,4,6
9.3.2 Nazewnictwo podstawnikowe
W niektórych przypadkach grupę hydroksylową można traktować jako podstawnik tworząc nazwę przez umieszczenie słowa hydroksy- w części przedrostkowej, w kolejności alfabetycznej obok nazw innych podstawników.
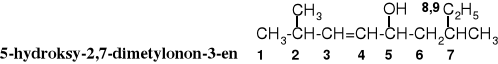
9.3.3 Nazewnictwo półsystematyczne
Stosowane jest też nazewnictwo półsystematyczne, polegające na tym, że do słowa alkohol dodaje się nazwę reszty alkilowej, do której połączona jest grupa -OH, np. alkohol metylowy, etylowy, propylowy, itd.
9.3.4 Nazewnictwo zwyczajowe
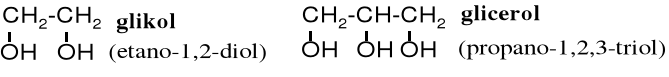
Niektóre alkohole, powszechnie znane przed ustaleniem zasad nazewnictwa IUPAC noszą nazwy zwyczajowe. Oprócz już wymienionych alkoholi: allilowego, benzylowego, geraniolu, mentolu, borneolu, cholesterolu oraz estradiolu do tej grupy należą, np. glikol czy glicerol.
9.3.5 Nazewnictwo karbinolowe
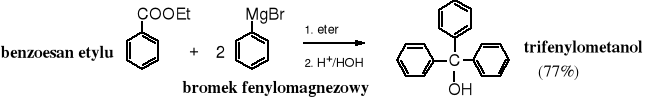
Jest jeszcze jeden znany, chociaż rzadko stosowany sposób nazywania alkoholi, używany głównie dla alkoholi 3o. Alkohole te traktuje się jako pochodne metanolu, w którym atomy wodoru zostały podstawione grupami alkilowymi lub arylowymi, np. trimetylometanol, trietylometanol, trifenylometanol. Dawniej, metanol był nazywany karbinolem.
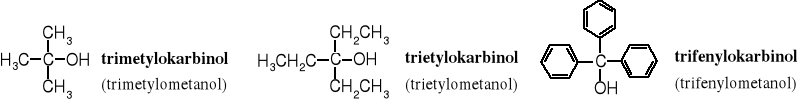
9.3.6 Diole i poliole
Związki zawierające dwie grupy hydroksylowe nazywane są diolami, z trzema triolami, ......, ogólnie poliolami. Poliole z trzema, czteroma, pięcioma, sześcioma i siedmioma grupami OH znane są pod nazwą alditoli, ponieważ powstają poprzez redukcję cukrów - aldoz. Diole zawierające grupy hydroksylowe przy sąsiadujących atomach węgla (1,2-diole) noszą nazwę glikoli, przy czym glikolem popularnie nazywany jest 1,2-dihydroksyetan.
Diole w zależności od wzajemnego położenia grup hydroksylowych dzielą się na gem-diole inaczej gem-glikole (gem znaczy bliźniacze), vic-glikole (sąsiadujące - glikole), -diole itd.

9.4 Otrzymywanie i zastosowanie alkoholi
9.4.1 Produkcja masowa
Metanol jest produkowany na skalę wielu mln ton rocznie poprzez uwodornienie tlenku węgla.
![]()
Gaz syntezowy (mieszanina CO i H2) jest tak nazwany, ponieważ służy między innymi do wytwarzania amoniaku oraz węglowodorów (benzyny); produkt reakcji zależy od warunków reakcji i użytego katalizatora.
Metanol, dzięki wykorzystywaniu taniego surowca, jakim jest gaz syntezowy jest również tanim, szeroko stosowanym rozpuszczalnikiem, jak i surowcem w syntezie organicznej. Dawniej metanol otrzymywano w procesie pirolizy drewna, stąd jego nazwa spirystus drzewny. Jest bardziej toksyczny od etanolu. Wyglądem i zapachem przypomina etanol, przez co był przyczyną wielu śmiertelnych zatruć.
Etanol jest wytwarzany głównie w procesie fermentacji alkoholowej z cukru. Należy do jednych z pierwszych substancji organicznych otrzymywanych w czystej postaci. Dawniej służył głównie w celach konsumpcyjnych (piwo, wino oraz napoje wysokoprocentowe) i w medycynie do odkażania czy przyrządzania alkoholowych roztworów leków. Obecnie oprócz tego, że jest stosowany jako surowiec i rozpuszczalnik w przemyśle chemicznym, coraz większe jego ilości znajdują zastosowanie jako biopaliwo w silnikach z napędem iskrowym; najczęściej w postaci dodatku do benzyn. W Brazylii - największym producencie bioetanolu - prawie połowa samochodów jest napędzana etanolem produkowanym z cukru trzcinowego. Może być też wytwarzany syntetycznie, np. poprzez hydratację etenu lub redukcję etanalu, jednak etanol fermentacyjny jest najtańszy. Wykorzystywanie cukru (cukrozy) i innych surowców żywnościowych do produkcji paliw jest przyczyną wzrostu ich ceny w ostatnim okresie.
Surowcem, z którego otrzymuje się etanol fermentacyjny jest zarówno cukroza (sacharoza), czyli cukier trzcinowy lub buraczany, jak i produkty roślinne zawierające cukry (proste lub złożone, np. skrobię). W wyniku fermentacji tych surowców powstaje produkt (np. wino) zawierający maksymalnie do 15% etanolu, większe jego stężenie niszczy drożdże. Napoje alkoholowe o wyższym stężeniu otrzymuje się poprzez destylację rozcieńczonych roztworów i rektyfikację. W trakcie rektyfikacji usuwane są resztki lotnych zanieczyszczeń (fuzli) i otrzymuje się tzw. rektyfikat, zwany spirytusem, zawierający 95% etanolu. Stanowi on tzw. mieszaninę azeotropową, wrzącą w określonej temperaturze bez zmiany składu. Do wytworzenia bezwodnego etanolu (alkoholu absolutnego) stosuje się specjalną procedurę odwadniającą, opartą na procesach fizycznych (np. destylacji azeotropowej, dodaniem bezwodnych sit molekularnych) lub chemicznych, wykorzystujących reakcje z substancjami odwadniającymi. Z soku winogronowego, zawierającego glukozę produkuje się wina. Z soków innych owoców (moszczu) wytwarza się „wina owocowe” (produkty winopodobne). Ostatnio Unia Europejska zezwoliła na określanie tych wyrobów także nazwą wina. Ze skrobi zawartej w ziemniakach czy zbożach otrzymuje się wyroby alkoholowe, które najczęściej po zatężeniu i rektyfikowaniu (oczyszczaniu) zostają przekształcone w napoje wysokoprocentowe - wódki czyste (~ 40%) lub spirytus (96%). Ze słodu jęczmiennego produkuje się piwo, a także whisky. Cukry złożone (skrobia czy cukroza) są przed fermentacją enzymatycznie hydrolizowane do cukrów prostych. Niektóre napoje alkoholowe powstają w wyniku fermentacji odpadów, np. rum otrzymuje się z przesączu po oddzieleniu cukru trzcinowego. Znane są także napoje alkoholowe otrzymywane z mleka (kumys). W mleku znajduje się laktoza - cukier mleczny.
W procesie fermentacji obok etanolu powstają też, chociaż w mniejszych ilościach inne związki, w tym metanol, etanal i wyższe alkohole, głównie butanole i nieco glicerolu. Niektóre z nich są przyczyną nieprzyjemnego zapachu produktów fermentacji (tzw. fuzli). Zostają one usunięte w procesie rektyfikacji.
Proces fermentacji cukrów można tak prowadzić (dobierając mikroorganizmy i warunki), żeby otrzymywać inne produkty niż etanol. W ten sposób wytwarza się na skalę przemysłową kwas cytrynowy i wiele aminokwasów, np. lizynę, fenyloalaninę, kwas glutaminowy, kwas asparaginowy i inne.
W dużych ilościach wytwarzany jest cykloheksanol, który służy głównie do otrzymywania kwasu adypinowego i kaprolaktamu. Surowcem do jego produkcji jest fenol (uwodornienie) lub cykloheksan (utlenienie).
Głównym źródłem glicerolu są tłuszcze, z których w wyniku hydrolizy (zmydlania) wydzielają się sole kwasów tłuszczowych (mydła) i glicerol. Ostatnio znaczne ilości tłuszczów przetwarza się w procesie transestryfikacji na biodiesiel, co jest powodem nadpodaży glicerolu.
KOH
tłuszcze + CH3OH _→ estry metylowe kw. tłuszczowych + glicerol
gem-Diole powstają w wyniku samorzutnego uwodnienia grupy karbonylowej aldehydów i ketonów. Jest to reakcja równowagowa, zwykle przesunięta mocno w kierunku nieuwodnionej grupy karbonylowej. Nieliczne aldehydy występują w wodnych roztworach w postaci uwodnionej (wodzianów), należą do nich metanal i trichloroetanal (chloral).
9. 4.2 Laboratoryje sposoby otrzymywania alkoholi
Alkohole można otrzymywać w reakcji hydrolizy, np. halogenków alkilowych czy eterów, hydratacji alkenów, redukcji wyżej utlenionych związków, w tym aldehydów, ketonów i kwasów karboksylowych oraz ich pochodnych, np. estrów, a także addycji związków Grignarda do związków karbonylowych.
Hydratacja alkenów
Przyłączenie cząsteczki wody w środowisku kwaśnym do podwójnego wiązania C=C daje produkt zgodnie z regułą Markownikowa.
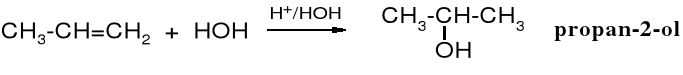
Alkeny przyłączają też cząsteczkę wody w obecności katalizatorów heterogenicznych. Reakcja ta zachodzi w wysokiej temperaturze i pod zwiększonym ciśnieniem wobec katalizatorów kwaśnych, np. zeolitów, żelu krzemionkowego zakwaszonego kwasem fosforowym, itp.
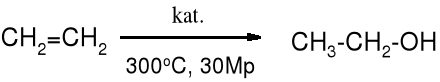
Hydroborowanie i oksyrtęciowanie
Podwójne wiązanie C=C można również uwodnić pośrednio za pomocą hydroborowania lub oksyrtęciowania. Hydroborowanie biegnie niezgodnie z regułą Markownikowa, w przeciwieństwie do oksyrtęciowania.
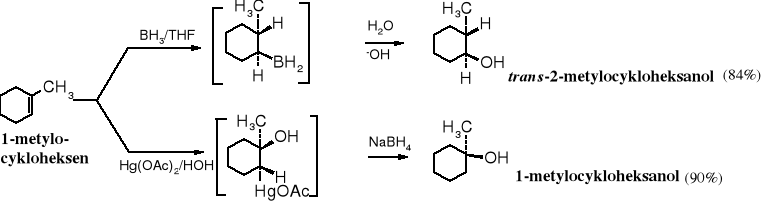
Utlenianie podwójnego wiązania C=C
Wicinalne glikole otrzymuje się najczęściej przez utlenienie alkenów lub hydrolizę epoksyzwiązków albo wicinalnych halogenopochodnych. W przypadku syntezy vic-glikoli cyklicznych powstają produkty trans- lub cis- w zależności od wybranej metody. Utlenianie alkenów za pomocą KMnO4 lub OsO4 prowadzi do cis-dioli, a hydroliza epoksyzwiązków do trans-izomerów.
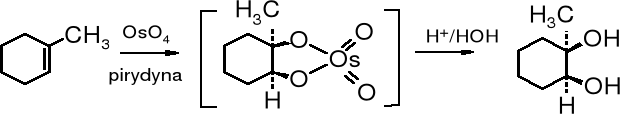
1-metylocykloheksen cykliczny ester cis-1-metylocykloheksano-1,2-diol
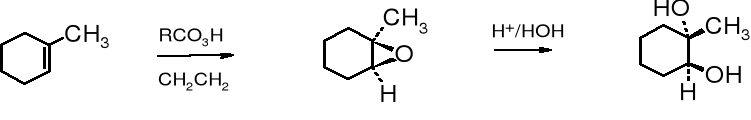
1-metylocykloheksen 1,2-epoksy-1-metylocykloheksan trans-1-metylo-cykloheksano-1,2-diol
Redukcja aldehydów i ketonów
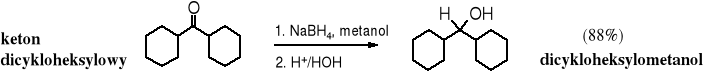
Najdogodniejszymi reduktorami aldehydów i ketonów są niektóre wodorki; reduktorem z wyboru jest tetrahydroboran sodu (wodorek borowo-sodowy) - NaBH4. Redukcja związków karbonylowych za pomocą NaBH4 biegnie łatwo w roztworze metanolowo- (etanolowo-) wodnym. Zastosowanie silniejszego reduktora, jakim jest tetrahydroglinian litu (dawna nazwa wodorek litowo-glinowy - LiAlH4) wymaga bezwodnego środowiska, a ponadto jest mniej selektywna, ponieważ redukuje również inne, odporniejsze na redukcję związki, jak kwasy karboksylowe i ich pochodne. Aldehydy i ketony trudno ulegają redukcji katalitycznej (w obecności Pt czy Pd) do alkoholi.
Redukcja aldehydów prowadzi do alkoholi 1o, a ketonów do alkoholi 2o.

Redukcja kwasów karboksylowych i ich pochodnych (estrów)
Kwasy karboksylowe i ich pochodne wymagają silniejszych reduktorów niż aldehydy, dlatego do ich redukcji używa się tetrahydroglinianu litu. Redukcja za pomocą wodorków jest reakcją częściowo selektywną, np. zachowane zostają wiązania wielokrotne.
![]()
Redukcja estrów sodem w etanolu (Bouveaulta-Blanca) ma już znaczenie historyczne.
Zadanie: napisz schemat redukcji maślanu etylu sodem w etanolu.
W przemyśle, zarówno kwasy, jak i estry redukuje się wodorem w obecności katalizatorów heterogennych.
![]()
Tłuszcze można poddać redukcji bezpośrednio lub po ich hydrolizie do kwasów.
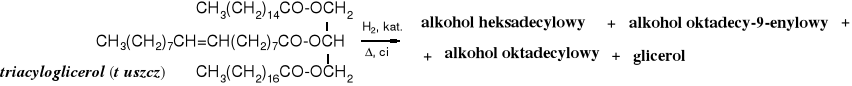
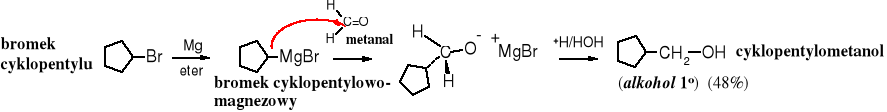
Addycja związków Grignarda do aldehydów lub ketonów (estrów)
Związki Grignarda reagują z grupą karbonylową w wyniku czego tworzą się alkohole. Z metanalu powstają alkohole 1o, z pozostałych aldehydów - alkohole 2o, a z ketonów i estrów - alkohole 3o. Mechanizm tej reakcji jest przedstawiony w rozdziale 12. Związki karbonylowe.
Przykłady
Z metanalu otrzymuje się alkohole 1o zawierające 1 atom węgla więcej niż halogenek alkilu użyty do uzyskania związku Grignarda.
Alkohole 1o zbudowane z 2 atomów węgla więcej niż halogenek alkilu użyty do wytworzenia związku Grignarda powstają w podobnej reakcji, z tym że związki Grignarda poddaje się działaniu tlenku etylenu.
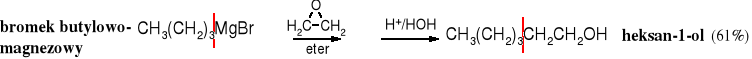
Z aldehydów w reakcji ze związkami Grignarda powstają alkohole 2o.
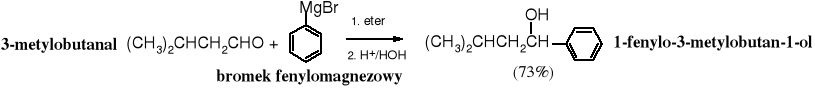
Z ketonów, estrów i chlorków kwasowych tworzą się alkohole 3o.
9.5 Właściwości fizyczne
9.5.1 Rozpuszczalność
Metanol, etanol i propanole rozpuszczają się wodzie bardzo dobrze - mieszają się z nią w każdym stosunku. Wraz ze wzrostem masy cząsteczkowej alkoholu rośnie jego część hydrofobowa (węglowodorowa) i z tego powodu zmniejsza się jego rozpuszczalność w wodzie. Jedynie 12,5g n-butanolu i sec-butanolu, 2,7g n-pentanolu lub 0,6g n-heksanolu rozpuszcza się odpowiednio w 100 ml wody w 20oC, natomiast tert-butanol miesza się z wodą w każdym stosunku. Dodatkowa grupa hydroksylowa znacznie zwiększa rozpuszczalność w wodzie, np. heksa-1,6-diol też miesza się z wodą w każdym stosunku. Alkohole rozpuszczają się dobrze w rozpuszczalnikach organicznych, nawet w węglowodorach, za wyjątkiem metanolu, którego rozpuszczalność w ciekłych węglowodorach jest ograniczona. Również dodatek nie całkiem bezwodnego etanolu (biopaliwa) do benzyny powoduje rozdzielenie się paliwa na dwie warstwy - górną węglowodorowo-etanolową i dolną - wodno-etanolową.
Alkohole są dobrymi rozpuszczalnikami dla wielu substancji organicznych. W alkoholach trudno rozpuszczają się substancje bardzo polarne, np. większość soli, cukrów, aminokwasów czy białek; nie rozpuszcza się też wiele polimerów; metanol i etanol trudno rozpuszczają tłuszcze i parafinę.
9.6.2 Temperatura wrzenia i topnienia - wiązania wodorowe
Niższe węglowodory (do butanu), a także niższe halogenki alkilowe, etery oraz metanal są gazami, natomiast już metanol jest cieczą i to o stosunkowo wysokiej temperaturze wrzenia - 65oC, co w porównaniu w etanem, a więc substancją o podobnej masie cząsteczkowej, wygląda na anomalię. Ta anomalia jest najbardziej widoczna w przypadku alkoholi niższych.
Porównanie wartości temperatur wrzenia wybranych alkanów, eterów i alkoholi, Tabela 9.1
o zbliżonych masach cząsteczkowych
Alkan wzór |
tw [oC] |
Eter wzór |
tw [oC] |
Alkohol wzór |
tw [oC] |
metan CH4 |
-162 |
- |
- |
- |
- |
etan CH3CH3 |
-89 |
- |
- |
metanol CH3OH |
65 |
propan C3H8 |
-42 |
dimetylowy CH3OCH3 |
-25 |
etanol C2H5OH |
78 |
n-butan C4H10 |
-0,5 |
etylowo-metylowy C2H5OCH3 |
11 |
n-propanol C3H7OH |
97 |
n-pentan C5H12 |
36 |
dietylowy C2H5OC2H5 |
35 |
n-butanol C4H9OH |
118 |
n-heksan C6H14 |
69 |
etylowo-propylowy C2H5OC3H7 |
64 |
n-pentanol C5H11OH |
136 |
n-heptan C7H16 |
98 |
dipropylowy C3H7OC3H7 |
91 |
n-heksanol C6H13OH |
157 |
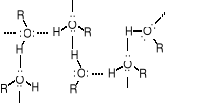
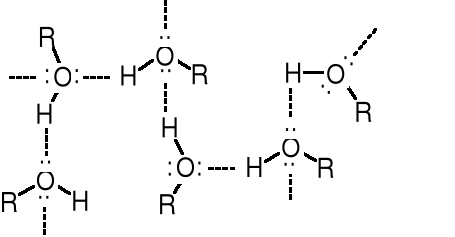
Przyczyną wysokiej temperatury wrzenia alkoholi są wiązania wodorowe pomiędzy atomami H oraz tlenu grup -OH. W wyniku asocjacji cząsteczek R-O-H powstają agregaty o masach cząsteczkowych znacznie przekraczających masę cząsteczkową pojedynczych cząsteczek alkoholu. Pozorny wzrost MM jest odpowiedzialny za wysokie temperatury wrzenia alkoholi. Alkohole wrą w temperaturze wyższej niż można spodziewać się porównując ich masy cząsteczkowe, np. z alkanami, ponieważ w ich przypadku potrzebna jest większa (dodatkowa) energia do rozrywania wiązań wodorowych tworzących agregaty. Cząsteczki alkenów i innych niskopolarnych związków przyciągają się nawzajem głównie siłami van der Waalsa - znacznie słabszymi od wiązań wodorowych.
Cząsteczki alkoholu połączone wiązaniami wodorowymi tworzą agregaty
Wiązania wodorowe powstają pomiędzy silnie elektroujemnymi atomami (F, Cl, O lub N), a atomami wodoru związanymi z takimi samymi elektroujemnymi atomami (F-H, Cl-H, -O-H czy -N-H). Im bardziej elektroujemny atom, z którym związany jest atom wodoru, tym silniejsze tworzy się wiązanie wodorowe i tym bardziej wzrasta temperatura wrzenia odpowiednich związków. Można to prześledzić na przykładzie wody, amoniaku i siarkowodoru. Woda jest cieczą o tw. 100oC, a pozostałe związki są gazami o tw. odpowiednio -33 i -61oC.
W węglowodorach, eterach, aldehydach, ketonach, estrach, itp. nie ma możliwości tworzenia wiązań wodorowych, dlatego związki tego typu (o zbliżonych masach cząsteczkowych) wrą w podobnym zakresie temperatury.
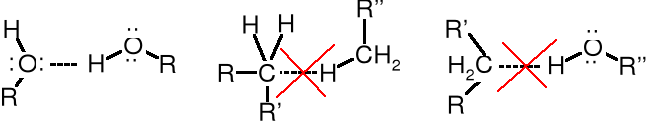
Alkohole, kwasy, amidy, cukry i podobne związki mają znacznie podwyższone temperatury wrzenia i topnienia w porównaniu do przedstawicieli poprzednio wymienionej grupy związków (porównywać należy właściwości substancji o zbliżonych masach cząsteczkowych). Jeszcze wyższe temperatury wrzenia i bardzo wysokie temperatury topnienia (często przed stopieniem się dochodzi do ich rozkładu) mają aminokwasy, ponieważ tworzą one sole wewnętrzne, w których wiązania jonowe podobnie, jak i w innych solach zwiększają więzi międzycząsteczkowe.
Również atomy wodoru C-kwasów mogą tworzyć z elektroujemnymi atomami, np. tlenu wiązania przypominające wiązania wodorowe, są one jednak tak słabe, że nie wpływają znacząco na podniesienie temperatur wrzenia tych związków.
9.6 Właściwości chemiczne
9.6.1 Kwasowość, alkoholany
Wiązanie pomiędzy atomem wodoru a atomem tlenu w grupie -O-H jest mocno spolaryzowane i łatwo polaryzowalne, co ułatwia jego dysocjację i dlatego alkohole wykazują właściwości kwasowe. Nie są jednak kwasami, ponieważ ich wodne roztwory nie mają odczynu kwaśnego (wobec papierka uniwersalnego); pKa etanolu wynosi 16.
![]()
Stała kwasowości alkoholu Ka.
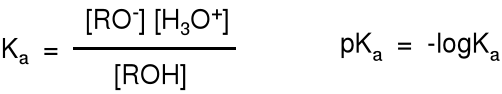
Im mniejsza wartość pKa, tym mocniejszy kwas, np. pKa dla kwasu solnego wynosi -7, dla kwasu octowego 4,5, a dla etanolu 16.
Porównanie kwasowości alkoholi i kwasów Tabela 9.2
Związek |
Wzór |
pKa |
b. słabe kwasy
⇓
kwasy średniej mocy
b. mocny kwas |
tert-butanol |
(CH3)3CH-OH |
18,0 |
|
etanol |
CH3CH2-OH |
15,9 |
|
woda |
HOH |
15,7 |
|
metanol |
CH3-OH |
15,5 |
|
2,2,2-trifloroetanol |
CF3CH2-OH |
12,4 |
|
nonafluoro-tert-butanol |
(CF3)3C-OH |
5,4 |
|
kwas octowy |
CH3COOH |
4,7 |
|
kwas solny |
HCl |
-7 |
|
Grupy elektrodonorowe zmniejszają kwasowość alkoholi, zaś elektroakceptorowe zwiększają ich kwasowość.

Grupy elektrodonorowe oddziałują niekorzystnie na stabilność anionu poprzez zwiększanie ładunku ujemnego na atomie tlenu. Grupy elektroakceptorowe zwiększają stabilność anionu w wyniku rozproszenia ładunku ujemnego na większą część cząsteczkę.
Alkohole reagują z metalami podobnie jak kwasy, tzn. wydziela się wodór i tworzą się sole, nazywane alkoholanami. Reaktywność alkoholi w tej reakcji słabnie wraz ze wzrostem masy cząsteczkowej. Najbardziej reaktywny jest metanol - ma najsilniejsze właściwości kwasowe pośród alkoholi niepodstawionych elektroujemnymi grupami.
Im bardziej reaktywny metal tym większa szybkość reakcji z alkoholem, np. sód energiczniej reaguje z etanolem niż magnez.
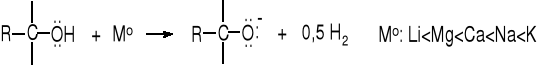
Alkoholany powstają też w reakcjach alkoholi z zasadami.

Wodorki sodu czy potasu reagują z alkoholami szybciej niż same metale.
Alkoholany, jako sole bardzo słabych kwasów łatwo ulegają hydrolizie, dlatego do ich otrzymywania wykorzystuje się silne zasady, a nie wodorotlenki, z których powstaje woda,
![]()
etanol wodorotlenek sodu etanolan sodu etanol amidek sodu etanolan sodu
Alkoholany należą do silnych zasad (są silniejszymi zasadami niż wodorotlenki metali alkalicznych), ponadto wykazują dobre właściwości nukleofilowe.
Alkohole reagują ze związkami Grignarda, podobnie jak kwasy, przy czym powstaje alkoholan i wydziela się węglowodór.
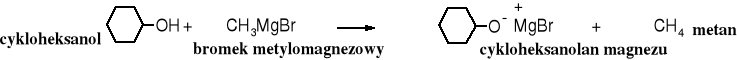
9.6.2 Utlenianie
Utlenianie alkoholi 1o i 2o
Alkohole 1o i 2o są podane na utlenianie. Z alkoholi 2o powstają ketony, a z 1o kwasy karboksylowe, jeżeli jednak utlenianie prowadzi się w odpowiednich warunkach to z alkoholi 1o można otrzymać aldehydy. Z kwasów karboksylowych, aldehydów czy ketonów w reakcjach redukcji powstają odpowiednie alkohole. Alkohole 3o utleniają się do nadtlenków.
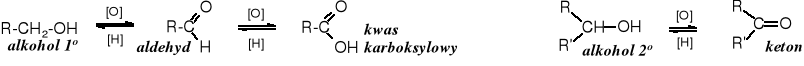
Utleniacze: K2Cr2O7, Na2Cr2O7, CrO3, KMnO4, HNO3, O2/kat.
![]()
Aldehydy utleniają się łatwiej do kwasu niż alkohole do aldehydów, dlatego też powyższa metoda syntezy aldehydów nadaje się jedynie do otrzymywania aldehydów lotnych, tzn. takich, które w warunkach reakcji zaraz po powstaniu łatwo i szybko są usuwane ze środowiska utleniającego. Aldehydy, jak wiemy mają niższą temperaturę wrzenia niż odpowiadające im alkohole, dlatego utrzymując temperaturę reakcji powyżej temperatury wrzenia aldehydu, można go łatwo oddestylować w miarę postępu reakcji i uchronić przed utlenieniem do kwasu.
![]()
Oznaką postępu reakcji utleniania za pomocą dichromianów jest zmiana barwy z pomarańczowej (Cr2O72-) na niebiesko-zieloną (Cr3+). W reakcjach prowadzących do otrzymywania aldehydów utleniacza dodaje się stopniowo tak, żeby nie było go w nadmiarze.
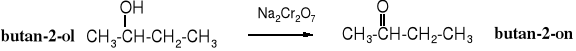
Roztwór chlorochromianu pirydyny (PCC) - C5H6NCrO3Cl - w dichlorometanie jest dogodnym czynnikiem utleniającym alkohole 1o do aldehydów. Ma zastosowanie głównie laboratoryjne, w przemyśle jest za drogi. W przemysłowych procesach utlenieniach najczęściej stosuje się powietrze lub tlen gazowy.
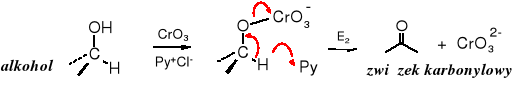
Mechanizm reakcji
Reakcja biegnie poprzez utworzenie odpowiedniego estru i eliminację anionu chromianu (IV).
Tritlenek chromu (CrO3) w wodnym roztworze kwasu siarkowego, nazywany odczynnikiem Jonesa służy do utleniania alkoholi 1o do kwasów karboksylowych.
![]()
Najlepszym sposobem na otrzymywanie aldehydów z alkoholi 1o jest metoda Swerna, polegająca na utlenieniu alkoholu za pomocą dimetylosulfotlenku w obecności chlorku oksalilu i rozbudowanej aminy 3o, np. trietyloaminy.
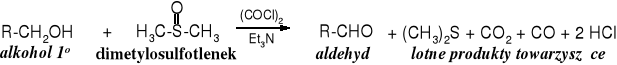
Reakcja utleniania alkoholi 2o nie sprawia większych trudności, ponieważ zwykle zatrzymuje się na etapie ketonu.
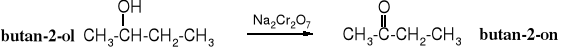
Pod wpływem silnych utleniaczy i w drastycznych warunkach ketony też ulegają utlenieniu, przy czym następuje destrukcja cząsteczki.
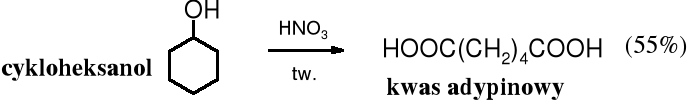
W przemyśle, kwas adypinowy otrzymuje się na dużą skalę poprzez utlenianie powietrzem cykloheksanolu lub cykloheksanonu.
Utlenianie vic-dioli
Diole wicynalne pod wpływem kwasu nadjodowego lub tetraoctanu ołowiu ulegają specyficznemu utlenieniu z rozerwaniem wiązania pomiędzy atomami węgla, przy których znajdowały się grupy hydroksylowe. Powstają przy tym związki karbonylowe - aldehydy lub ketony - w zależności od rzędowości atomów węgla.
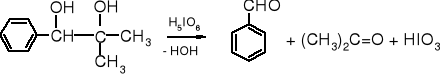
1-fenylo-2-metylopropano-1,2-diol benzaldehyd aceton
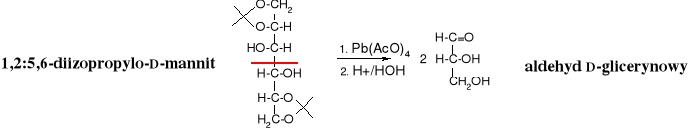
Mechanizm reakcji
Reakcja biegnie poprzez cykliczny ester, który ulega rozpadowi.
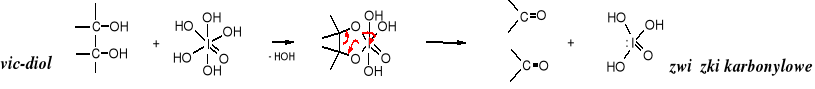
Diole wicynalne mogą w ten sposób być utlenione jedynie wówczas, kiedy obie grupy hydroksylowe są ułożone wzajemnie w sposób cis-. trans-Dihydroksydekalina jest niewrażliwa na działanie kwasu nadjodowego czy tetraoctanu ołowiu.
9.6.3 Dehydratacja alkoholi
W wyniku dehydratacji (odwodnienia), czyli oddzielenia cząsteczki wody z alkoholi powstają alkeny:
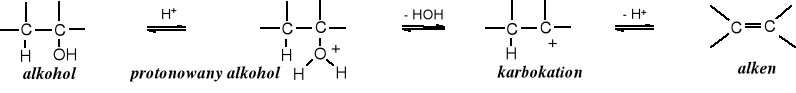
Szybkość reakcji dehydratacji alkoholi zależy od ich rzędowości; najszybciej i najłatwiej ulegają jej alkohole 3o.
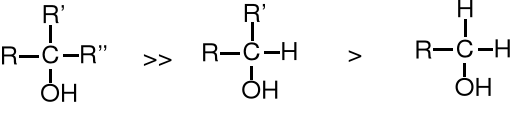
Dehydratację alkoholi przeprowadza się najczęściej w kwasie siarkowym. Jedynie alkohole 3o łatwo tracą wodę w łagodnych warunkach. Alkohole 2o wymagają bardziej stężonego kwasu i wyższej temperatury (75% H2SO4, 100oC), a na alkoholach 1o można wymusić dehydratację dopiero stężonym kwasem siarkowym w temperaturze 150oC.
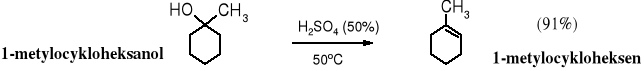
Mechanizm dehydratacji katalizowanej kwasem.
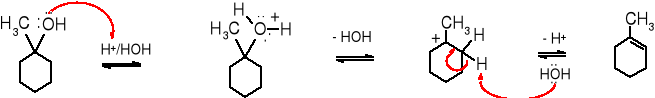
metylocykloheksanol (alkohol) protonowany alkohol karbokation 1-metylocykloheksen (alken)
Zależność szybkości dehydratacji alkoholi od ich rzędowości wynika z odmiennego mechanizmu reakcji. Dehydratacja alkoholi 2o i 3o pod wpływem kwasu biegnie wg mechanizmu E1, a więc jej szybkość jest uzależniona od trwałości i szybkości powstawania karbokationów oraz oczywiście od stężenia alkoholu. Dowodem na to, że przejściowo tworzy się karbokation są alkeny o budowie zgodnej z regułą Zajcewa oraz produkty przegrupowania, powstające wówczas, kiedy zaistnieje możliwość utworzenia trwalszego karbokationu.

Przegrupowanie
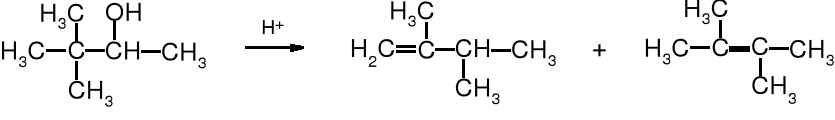
2,2-dimetylobutan-3-ol 2,3-dimetylobut-1-en (29%) 2,3-dimetylobut-2-en (71%)
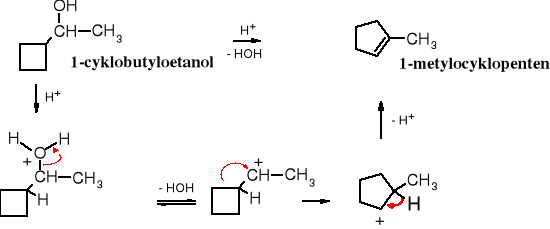
9.6.4 Przegrupowanie pinakolinowe
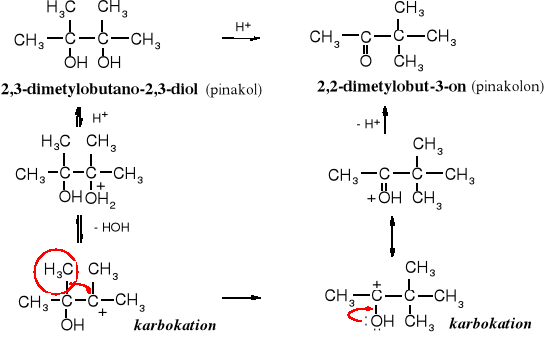
Wicinalne diole, zawierające grupy -OH przy 3o atomach węgla (pinakole) ulegają w środowisku kwaśnym przegrupowaniu do pinakolonu (ketonu). Reakcja ta znana jest pod nazwą przegrupowania pinakolinowego.
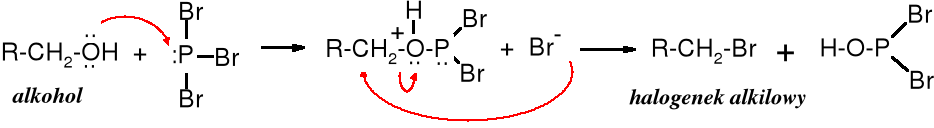
Reakcja z halogenkami fosforu
Dehydratację alkoholi prowadzi się także za pomocą POCl3. W tym przypadku reakcja biegnie wg mechanizmu E2, przy czym przejściowo tworzy się ester dichlorofosforanowy z szybkością zależną od stężenia alkoholu i POCl3. Grupa -OH nie jest grupą łatwo odchodzącą, dlatego ulega eliminacji w postaci cząsteczki wody (po sprotonowaniu w środowisku kwaśnym) lub środowisku zasadowym jako reszta kwasu tworzącego ester.
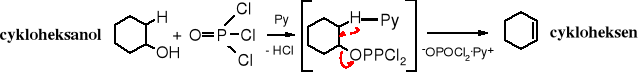
Dehydratacja alkoholi 2o i 3o po wpływem POCl3 następuje w łagodniejszych warunkach (0oC) niż w obecności kwasów. Pirydyna pełni rolę zarówno katalizatora (zasady), jak i rozpuszczalnika. Alkohole 1o w obecności POCl3 są przekształcane w chlorki alkilowe.
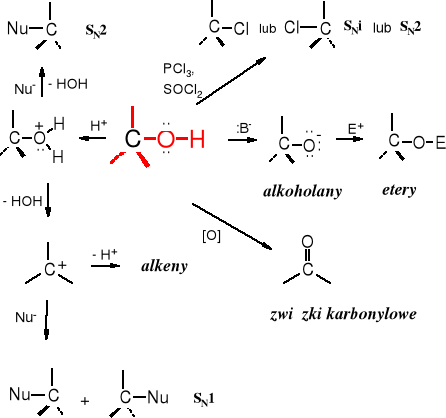
9.7.5 Podstawienie grupy hydroksylowej w alkoholach
Reakcja z hologenowodorami
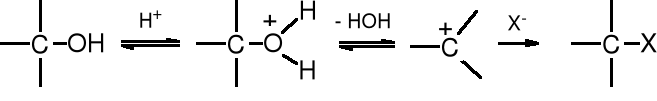
Grupa -OH jest grupą źle odchodzącą, ale w środowisku kwaśnym ulega protonowaniu i może zostać odszczepiona pod postacią cząsteczki wody - HOH. Powstały kation po przyłączeniu nukleofila (anionu) przekształca się w odpowiednią pochodną. Jest to reakcja substytucji nukleofilowej - SN, przy czym alkohol pełni rolę słabego elektrofila.
![]()
![]()
Reakcja może biec wg mechanizmu SN2 lub SN1. Jeżeli po protonowania grupy -OH następuje przyłącznie nukleofila, utworzenie pięciowalencyjnego produktu pośredniego, a następnie odejście cząsteczki HOH, to mamy do czynienia z reakcją SN2. Natomiast, reakcja biegnie mechanizmem SN1, kiedy po przyłączeniu protonu dochodzi do odszczepienie cząsteczki wody i utworzenia karbokationu, do którego z kolei przyłącza się anion. Do karbokationu w powyższej reakcji przyłącza się jon Br-, a nie HSO4-, ponieważ anion bromkowy jest dużo lepszym nukleofilem niż wodorosiarczanowy.
W środowisku obojętnym nie dochodzi wymiany grupy -OH na Br, ponieważ brakuje protonu, który zapoczątkowałby reakcję poprzez przyłączenie się do grupy -OH.
Z etanolu pod wpływem kwasu bromowodorowego powstaje bromek etylu, podobnie jak w reakcji etanolu z bromkiem potasu w obecności kwasu siarkowego. Reakcja biegnie wg mechanizmu SN2.
![]()
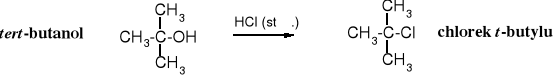
Alkohol t-butylowy reaguje z halogenowodorami wg mechanizmu SN1, o czym można wnioskować z kinetyki reakcji - jej szybkość zależy jedynie od stężenia alkoholu.
Mechanizm reakcji.
SN2 - alkohole 1o i metanol
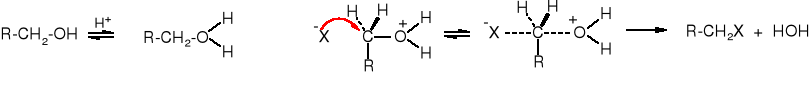
SN1 - wszystkie alkohole za wyjątkiem metanolu i alkoholi 1o
Alkohole allilowy i benzylowy wykazują dużą reaktywność w tego typu reakcjach, a substytucja grupy -OH na -X zachodzi zarówno wg mechanizmu SN1, jak i SN2 i dlatego są bardziej podatne na substytucję nukleofilową od innych alkoholi. Szereg aktywności alkoholi w reakcjach SN wygląda następująco:
![]()
allilowy i benzylowy 3o 2 o 0 o 1 o
Reakcja z innymi odczynnikami podstawiającymi grupę hydroksylową
Grupę hydroksylową w alkoholach 1o i 2o można łatwo zamienić na halogen za pomocą takich odczynników jak PX3 lub SOCl2. Reakcja zachodzi bez przegrupowania, co świadczy, że biegnie ona mechanizmem innym niż uprzednio omawiana.
Reakcję alkoholi z chlorkiem tionylu stosuje się często do otrzymywania chlorowcopochodnych. Jest ona dogodna z tego powodu, że powstają one z dużą wydajnością, a obok produktu głównego tworzą się jedynie lotne, łatwe do usunięcia związki.
C15H31CH2-OH + SOCl2 _→ C15H31CH2-Cl + SO2 + HCl
heksadekan-1-ol chlorek tionylu chlorek heksadecylu
Reakcja ta jest interesująca również z innych powodów. Otóż w zależności od środowiska biegnie z inwersją lub retencją konfiguracji. W obecności kwasów obserwuje się retencję konfiguracji, a w środowisku zasadowym dochodzi do inwersji konfiguracji.
Mechanizm reakcji z SOCl2 w środowisku kwaśnym.
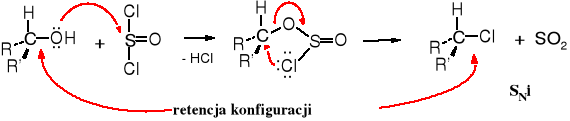
Reakcja alkoholi z SOCl2 w środowisku zasadowym.
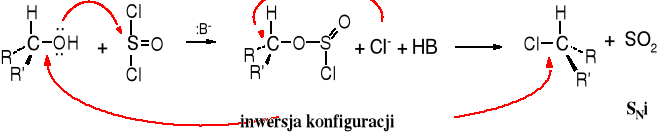
Reakcja SOCl2 z alkoholami w środowisku kwaśnym biegnie z retencją konfiguracji. Tego typu mechanizm nazwany jest SNi, przy czym „i” oznacza interior (ang.), czyli wewnętrzny. Jest to substytucja wewnątrzcząsteczowa, ponieważ atom chloru podstawiający grupę -OH znajduje się w tej samej cząsteczce.
W środowisku zasadowym dochodzi do inwersji konfiguracji, ponieważ reakcja biegnie wg mechanizmu SN2.
R e a k t y w n o ś ć a l k o h o l i (podsumowanie)
10
Wyszukiwarka