Poprawa części obliczeniowej
1.Obliczam stałe szybkości reakcji hydrolizy estru w środowisku HCl o stężeniu:
a) c = 0,5 mol/dm3
![]()
Dla V1
![]()
[ s-1 ]
Dla V2
![]()
[ s-1 ]
Skoro pierwsza wartość k odskakuje od pozostałych nie uwzględniam jej w obliczeniach średniej:
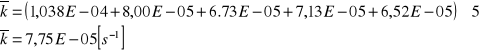
![]()
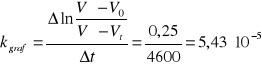
[ s-1 ]
![]()
![]()
![]()
[ s-1 ]
b) c = 1,5 mol/dm3
Dla V1
![]()
[ s-1 ]
Dla V2
![]()
[ s-1 ]
Skoro pierwsza wartość k odskakuje od pozostałych nie uwzględniam jej w obliczeniach średniej:
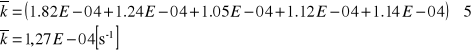
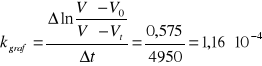
![]()
![]()
[ s-1 ]
2. Obliczam prędkość chwilową badanej reakcji:
obliczam stężenie produktu x po czasie t1, t2, t3…:
a) c = 0,5 mol/dm3
![]()
![]()
![]()
![]()
![]()
![]()
b) c = 1,5 mol/dm3
![]()
![]()
![]()
wykreśliłam krzywe ilustrujące zależność x = f(t). Poprowadziłam styczne do krzywych w punkcie odpowiadającym wybranej chwili t i obliczyłam tg α tych prostych:
a) c = 0,5 mol/dm3
x1=200 x2=4900
y1=0,012 y2=0,023
![]()
[mol/l*s]
b) c = 1,5 mol/dm3
x1=600 x2=4700
y1=0,022 y2=0,043
![]()
[mol/l*s]
Kwas solny c = 0,5 mol/dm3
czas [min] |
czas [s] |
Vt |
ln |
kobl [s-1] |
kśr [s-1] |
kgraf [s-1] |
knum[s-1] |
x [mol/l] |
vchwilowa [mol/l*s] |
0 |
0 |
10,5 |
0 |
0 |
|
|
|
0 |
2,34*10-6 |
10 |
600 |
11,5 |
0,1268 |
0,0002113 |
|
|
|
0,01 |
|
27 |
1620 |
11,8 |
0,1681 |
0,0001038 |
|
|
|
0,013 |
|
41 |
2460 |
12 |
0,1967 |
0,0000800 |
7,75*10-5 |
5,43*10-5 |
7,10*10-5 |
0,015 |
|
56 |
3360 |
12,2 |
0,2261 |
0,0000673 |
|
|
|
0,017 |
|
71 |
4260 |
12,7 |
0,3037 |
0,0000713 |
|
|
|
0,022 |
|
86 |
5160 |
12,9 |
0,3365 |
0,0000652 |
|
|
|
0,024 |
|
niesk. |
|
18,9 |
0 |
|
|
|
|
0,084 |
|
Kwas solny C =1,5 mol dm3
czas [min]
|
czas [s] |
Vt |
ln |
kobl [s-1] |
kśr [s-1] |
kgraf [s-1] |
knum[s-1] |
x [mol/l] |
vchwilowa [mol/l*s] |
0 |
0 |
31,5 |
0 |
0 |
|
|
|
0 |
5,12*10-6 |
10 |
600 |
33,4 |
0,1915 |
0,000319 |
|
|
|
0,019 |
|
25 |
1500 |
34,1 |
0,2725 |
0,000182 |
|
|
|
0,026 |
|
40 |
2400 |
34,3 |
0,2969 |
0,000124 |
1,27*10-4 |
1,16*10-4 |
1,16*10-4 |
0,028 |
|
55 |
3300 |
34,7 |
0,3475 |
0,000105 |
|
|
|
0,032 |
|
70 |
4200 |
35,6 |
0,4718 |
0,000112 |
|
|
|
0,041 |
|
85 |
5100 |
36,3 |
0,5805 |
0,000114 |
|
|
|
0,048 |
|
niesk |
|
42,4 |
0 |
0 |
|
|
|
0,109 |
|
Wnioski
Stała szybkości reakcji w środowisku kwasu solnego o c=0,5 mol/l (7,10*10-5[s-1]), jak i szybkość chwilowa w tych warunkach (2,34*10-6[mol/l*s]) posiadają mniejsze wartości niż przy stężeniu c=1,5 mol/l (k=1,16*10-4[s-1], vchwil=5,12*10-6[mol/l*s] ). Wynika to z faktu, że im większe stężenie kwasu czyli stężenie jonów wodorowych, tym większa stała szybkości reakcji. Reakcja opisana w tym doświadczeniu przebiega szybciej im jest większe stężenie kwasu. Jony wodorowe są katalizatorem i powodują wzrost szybkości tej reakcji.
Wyszukiwarka