Mitochondrium:
Błony mitochodrialne
Mitochondrium otaczają dwie błony białkowo-lipidowe, obie podobne w budowie do zwykłej błony komórkowej, ale o bardzo różnych właściwościach. Błona zewnętrzna otaczająca całe organellum jest naszpikowana białkami zwanymi porynami. Poryny są w istocie dużymi kanałami, przez które mogą się przedostawać wszystkie cząsteczki o masie nie przekraczającej 6000 daltonów. Większe cząsteczki mogą pokonać zewnętrzną błonę tylko przy pomocy transportu aktywnego.
Błona wewnętrzna nie zawiera poryn i jest nieprzepuszczalna - transport jonów i innych cząsteczek do jej wnętrza wymaga specjalnych transporterów błonowych. Umożliwia to wytworzenie gradientu protonowego niezbędnego do działania łańcucha oddechowego. Szczególnym fosfolipidem w błonie jest kardiolipina, lipid typowy dla komórek bakteryjnych. Enzymem markerowym (markerem) błony wewnętrznej jest oksydaza cytochromu c.
Błona wewnętrzna tworzy wpuklenia - grzebienie mitochondrialne, w których zakotwiczone są enzymy łańcucha oddechowego. Wpuklenia zwiększają powierzchnię błony - i tak np. w mitochondriach wątroby powierzchnia wewnętrznej błony mitochondrialnej jest pięciokrotnie większa od powierzchni zewnętrznej błony mitochondrialnej.
Macierz mitochondrialna
Wnętrze mitochondrium wypełnia macierz (matriks) mitochondrialna. Jest to rodzaj żelu - wodny roztwór białek i metabolitów zużywanych na potrzeby mitochondrium. Białkami wewnętrznymi mitochondrium są wszystkie enzymy β-oksydacji kwasów tłuszczowych, cyklu Krebsa, syntezy steroidów itp. Macierz zawiera również mitochodndrialny DNA (mtDNA) w formie pierścieniowej, pozbawiony jest histonów, DNA mitochondrialny charakteryzuje się małą liczbą sekwencji niekodujących, rybosomy mitochondrialne i tRNA mitochondrialne.
Utlenianie biologiczne
Jest wielostopniowym biochemicznym procesem utleniania związków organicznych związanym z wytwarzaniem energii użytecznej metabolicznie. Oddychanie przebiega w każdej żywej komórce w sposób stały. Zachodzi ono nawet wtedy, gdy inne procesy metaboliczne zostaną zahamowane.
C6H12O6 + 6O2 → 6CO2 + 6H2O
Oddychanie komórkowe składa się z 3 etapów:
Glikolizy:
Glukoza przekształcana jest do kwasu pirogronowego i powstają niewielkie ilości ATP oraz NADH.
Cyklu Krebsa
Określany także cyklem kwasu cytrynowego lub cyklem kwasów trikarboksylowych, w którym kwas pirogronowy po przekształceniu do acetylo-CoA w cyklu przemian przekształcany jest do CO2 z wytworzeniem NADH, FADH2 oraz GTP lub ATP.
Łańcucha oddechowego
Oddychanie końcowe, czyli mitochondrialny łańcuch transportu elektronów i fosforylacja oksydacyjna. W tym etapie zredukowane nukleotydy NADH, FADH2 są utleniane. W efekcie szeregu reakcji powstaje woda, a uwalniana energia zamieniana jest na ATP.
ATP jako przenośnik energii:
ATP
Spalanie wodoru w tlenie zachodzące in vitro jest procesem gwałtownym i silnie egzoergicznym. Energia chemiczna zostaje zamieniona w całości na energię cieplną. Spalanie wodoru w komórkach zachodzi powoli, wieloetapowo, a znacząca czesć uwalnianej energii jest magazynowana w postaci energii chemicznej, której głównym nośnikiem staje się ATP. Energia zmagazynowana w ATP jest zużytkowana przede wszytkim do skurczu mięśni szkieletowych, skurczu mięśnia sercowego, utzrymania gradientu stężeń jonów I metabolitow po odbydwu stronach błon biologicznych, dzielących wnętrze komórki na przedzialy oraz na pokrycie kosztow energetycznych procesów anabolicznych. Sprzęganie procesów wytwarzających energię z procesami zużywającymi energię zachodzi poprzez wspólne metabolity. Jednym z nich jest ADP. Jest on substratem zużywanym do syntezy ATP w procesach wytwarzających energię I produktem rozpadu ATP w procesach zużywających energię.
Dwie reakcje chemiczne mają wspólne pośredniki gdy produkt pierwszej reakcji jest substratem następnej:
A+B -----> C+D
D+X------->Y+Z
D jest wspólnym pośrednikiem w ciągu tej reakcji I może służyc jako przenośnik energii chemicznej pomiędzy dwiema reakcjami. W wielu sprzężonych reakcjach funcję takiego wspólnego pośrednika pełni ATP. Jedne reakcje prowadzą do syntezy ATP przez przeniesienie reszty fosforanowej z bogatego w energię pośrednika na ADP ( fosforylacja substratowa) lub poprzez bezpośrednie wiązanie fosforanu nieorganicznego poprzez wiązanie z ADP kosztem energii wyzwalanej w trakcie transport protonów I elektronów przez mitochondrailny łancuch oddechowy. Wykorzystanie energii ATP zachodzi różnymi drogami. Moze dojsć do rozpadu ATP z wytworzeniem ADP I fosforanu nieorganicznego (Pi), lub ATP rozpada się do AMP I pirofosforanu nieorganicznego. W wielu sytuacjach energia zmagazynowana w ATP jest wykorzystywana przez przeniesienie reszty fosoforanowej z ATP na inna czasteczke, np glukoze, co aktywuje ten susbtrat I umożliwia jego właczenie do różnych szlaków metabolicznych, jak glikoliza, szlak pentozofosforanowy, biosynteza glikogenu. ATP w procesnie integracji procesów egzoergicznych I endoergicznych : jest produktem reakcji egzoergicznych I substratem zużywanym w procesach endoergicznych. W podobny sposob aktywują substraty inne nukleotydytrifosforanowe: urydynotrifosforan (UTP) lub cytydynotrifosforan(CTP).
Procesy egzoergiczne :
glikoliza
oksydacyjna dekarboksylacja pirogronianu
utlenianie oceanu w cyklu Krebsa
utlenianie cial ketonowych
utlenianie kwasów tluszczowych I glicerolu
Procesy endoergiczne:
skurcz miesni
synteza biomolekuł
transport czynny
neurotransmisja
fosforylacja cukrów I bialek
Związki fosforanowe o wysokiej energii
Głównymi nosnikami energii użytecznej biologicznie są ATP I inne nukleotydy trifosforanowe ( ale ich znaczenie jest mniejsze) ATP sklada się z adeniny, rybozy I trzech reszt kwasu ortofosforowego. Jedna z nich jest polaczona wiązaniem estrowym poprzez grupe OH przy węglu 5'rybozy, a wszytkie trzy pomiedzy sobą są zespolone wiązaniami bezwodnikowymi o wysokiej energii. Cząsteczka ATP ma 2 takie wiazania.
Jezeli odlączy się jedna grupa fosforanowa powstanie aDP, związek posiadający jedno wiązanie bezwodnikowe, bogate w energię. Standardowa wolna energia delta G hydrolizy każdego wiązania bezwodnikowego w ATP wynosi okolo 30 kJ/ mol. Z powodu wysoko ujemnej wartości delta G tej reakcji, ATP I aDP są nazywane związkami bogatymi w energię. Porównywalne wartości delta G maja reakcje hydrolizy innych nukleotydow di I trifosforanowych. Istnieją zwiazki fosforanowe o zawartości energii znacznie wyższej niż w ATP. Należą do nich 1,3 - bisfosfoglicerynian, fofoenolopirogronian, fosfokreatyna. Wartośc delta G reakcji hydrolizy tych związków wynosi okolo 42kJ/mol. Nie mogą one być jednak bezpośrednimi dawcami energii dla reakcji endoergicznych. Uczestniczą natomiast w fosforylacji substratowej, czyli fosforylacji na poziomie substratu. Proces ten polega na tworzeniu ATP kosztem rozpadu wspomnianych związków. Nie jest związany z funcjonowaniem łancucha oddechowego. Jest to drugi (obok fosforylacji oksydacyjnej) mechanizm tworzenia ATP, szczegolnie ważny dla komórek o metabolizmie beztlenowym. Wśród związkow tej grupy na szczególną uwagę zasługuje fosfokreatyna, która jest rezerwuarem energii potrzebnej do skurczu mięsnia. Bezpśrednim dawcą energii dla tego procesu jest ATP, lecz jego zasoby w komorkach mięsniowych wystarczalyby zaledwie na 1 do kilku sekund. ATP musi być więc natychmiast odtwarzany. Doraźny mechanizm szybkiego odtwarzania ATP polega na przenoszeniu reszty fosforanowej z fosfokreatyny na ADP. Reakcje te katalizuje kinaza kreatynowa.
Inne metabolity, zawierajace grupy fosforanowe, cechują sie niską zawartościa energii. Bezwzględna wartość delta G reakcji ich hydrolizy wynosi poniżej 17 kJ/mol. Do nich należa przede wszytkim estry fosforanow glicerolu, inozytolu, aminoalkoholi, cukrow prostych oraz wszytkie nukleotydy monofosforanowe. ATP pełni więc szczegolną role przenośnika energii. Nie ma w komorce innych mechanizmow, ktore moglyby umożliwić przenoszenie grup fosforanowych bezpośrednio z donorow o bardzo wysokiej energii na akceptory o niskiej energii z pominięciem ATP.
Inne związki bogate w energie
Wiązania tioestrowe między siarką koenzymu A I grupa karboksylowa kwasu organicznego są także polączeniami bogatoenergetycznymi. Niektore z nich tworzą sie kosztem rozpadu ATP do AMP I pirofosforanu. Kwasy tłuszczowe są w formie aktywnej, jako acyloCoA mogą wlączać sie zarówno do procesu beta -oksydacji, ktory jest szlakiem katabolicznym, jaki I do biosyntezy estrow glicerolu lub estrow cholesterolu, ktore to procesy są szlakami anabolicznymi. Tak więc acyloCoA jest kolejnym przykladem metabolitu sprzegającego proces kataboliczny z procesem anabolicznym. Karbamilofosforan jest produktem interakcji CO2 I NH3 w procesie biosyntezy mocznika lub zasad pirymidynowych. Jest on nośnikiem energii pochodzącej z rozpadu dwoch cząteczek ATP.
Związki fosforanowe o niskiej energii
Organizacja łańcucha transportu protonów i elektronów:
Elementy składowe łańcucha transportu elektronów
Łańcuch transportu elektronów, który przeprowadza fosforylację oksydacyjną, występuje w błonie mitochondrialnej w wielu kopiach. Nazywany również łańcuchem oddechowym, składa się prawie z 40 białek, z których ok. 15 bierze bezpośredni udział w transporcie elektronów. Białka tworzące łańcuch oddechowy są pogrupowane w trzy duże enzymatyczne kompleksy oddechowe, z których każdy zawiera wiele różnych białek. W skład poszczególnych kompleksów wchodzą białka transbłonowe, które mocno osadzają kompleks w wewnętrznej błoni mitochondrialnej.
W przenoszeniu elektronów od substratu do tlenu uczestniczą
Dehydrogenazy nikotynamidowe. Współdziałają one z NAD i NADP. Tego typu dehydrogenaz jest około 200. Enzymy te przenoszą odwracalnie jeden atom wodoru i jeden elektron na utlenioną postać NAD+ lub NADP+, z uwolnieniem protonu. Większość dehydrogenaz działa specyficznie z NAD, inne działają specyficznie tylko z NADP. Są również takie dehydrogenazy, które mogą działać z obydwoma koenzymami. Istnieje możliwość wymiany wodoru i elektronów między dehydrogenazami o różnych koenzymach. Reakcje tego typu katalizują transhydro-genazy.
Dehydrogenazy współdziałające z flawinami. Białka tych dehydrogenaz są związane z nukleotydami flawinowymi, niekiedy zawierają także niehemowe żelazo. Do tego typu dehydrogenaz należy: dehydrogenaza NADH, która jest białkiem żelazowo-siarkowym, działającym z FMN, ponadto dehydrogenaza bursztynianowa, cholinowa lub acylo-CoA współdziałające z FAD.
Dehydrogenazy współdziałające z liponianem. Wchodzą one w skład kompleksu enzymów oksydacyjnej dekarboksylacji 2-oksokwasów. Zredukowany liponian jest następnie utleniany przez dehydrogenazę liponianową, która współdziała z FAD.
a poza tym:
FLAWOPROTEINY POŚREDNICZĄCE (Fp). Występują one poza wymienionymi już dehydrogenazami flawinowymi. Fp zawierają barwniki flawinowe, bardzo często żelazo niehemowe, siarkę, a niekiedy cynk. Metaloflawoproteiny uczestniczą m.in. w działaniu dehydrogenaz NADH, powodując ich utlenienie. Niektóre dehydrogenazy współdziałające z nukleotydami flawinowymi, jak np. dehydrogenaza acylo-CoA, współdziałają także z flawoproteinami przenoszącymi elektrony (ETF).
Flawoproteiny pośredniczące prawdopodobnie uczestniczą w przejściu dwu-elektronowych reakcji utleniania w reakcje jednoelektronowe.
UBICHINON (koenzym Q). Jest on syntetyzowany w komórkach z tyrozyny. Ubichinon stanowi ostatnie ogniwo łańcucha oddechowego, do którego dochodzą atomy wodoru. Dalej przenoszone są już tylko elektrony. Budowa koenzymu Q jest zbliżona do witamin E i K, przez co może pełnić rolę antyoksydanta budzącego nadzieję w leczeniu chorób wieku starczego. W łańcuchu oddechowym występuje on w ilości proporcjonalnie większej od innych składników. Ubichinon jest ruchomym elementem łańcucha, zbierającym równoważniki redukujące z flawoprotein i przekazującym je cytochromom.
CoQ jest także miejscem ich powstawania zgodnie ze schematem reakcji:
UKŁAD CYTOCHROMOWY.
Cytochromy stanowią układ, w którym każda cząsteczka cytochromu przenosi jeden elektron na zasadzie zmiany wartościowości żelaza. Prawdopodobnie pierwszym biorcą elektronów od ubichinonu jest cytochrom b o masie cząsteczkowej 28 kDa. Może on występować w postaci polimeru o masie około 4 MDa. Dalszym przenośnikiem jest cytochrom c1, a następnie cytochrom c.
Cytochrom c1 jest lipoproteiną o masie cząsteczkowej około 360 kDa. Okazało się, że jest to polimer zbudowany z podjednostek o masie 51 kDa, zawierających po 1 atomie żelaza..
Cytochrom c jest najlepiej poznany ze wszystkich cytochromów. Masa jego cząsteczki wynosi 13 kDa. Zawiera on 104 reszty aminokwasowe, znany jest jego skład aminokwasowy oraz struktura przestrzenna. Cytochrom c jest jedynym cytochromem rozpuszczalnym i podobnie jak CoQ jest ruchomym składnikiem łańcucha oddechowego, łączącym jego kompleksy funkcyjne.
Ostatnie ogniwo łańcucha stanowią Cytochromy aa3, nazywane oksydazą cytochromową. Jest to kompleks 13 podjednostek polipeptydowych, przy czym właściwości katalityczne są przypisywane trzem najcięższym podjednostkom kodowanym przez mitochondrialny DNA. Tym niemniej liczba podjednostek oksydazy cytochromowej jest zmienna (prokarionty posiadają ich najmniej). W skład tego enzymu wchodzą dwa układy żelazoporfiry nowe, z których każdy oprócz żelaza zawiera atom miedzi. Oksydaza cytochromowa ma duże powinowactwo do tlenu. Reakcja, którą enzym ten katalizuje, jest nieodwracalna.
W mitochondrialnym łańcuchu oddechowym (rys. 2) w miejscu działania ubichinonu mogą występować substancje towarzyszące temu koenzymowi: witaminy K oraz witaminy E. Od miejsca występowania ubichinonu elektrony są przenoszone pojedynczo przez układy cytochromów na tlen. Natomiast protony, uwalniane na etapie koenzymów nukleotydowych oraz ubichinonu, łączą się bezpośrednio z jonem tlenkowym (O2-), tworząc cząsteczkę wody.
Kompleksy oddechowe
1) kompleks dehydrogenazy NADH.(wyżej)
2) kompleks oksydazy cytochromowej.
3) kompleks cytochromów b-c1
Przenosi elektrony z koenzymu Q po stronie matriksowej do cytochromu c po stronie cytoplazmatycznej.
kompleks III cytochromów b-c1
Każdy zawiera jony metali i grupy chemiczne, które formują drogę dla elektronów przechodzących przez dany kompleks. Te trzy kompleksy oddechowe są miejscami pompowania protonów; każdy z nich można sobie wyobrazić jako białkową maszynę pompującą protony w poprzek błony w czasie, gdy przez kompleks przechodzą elektrony.
Inhibitory transportu elektronów
Hamowanie przenoszenia elektronów w łańcuchu oddechowym może dotyczyć różnych etapów. Wiele substancji z grupy barbituranów, jad rybi - rotenon, niektóre steroidy oraz związki rtęci hamują utlenianie substratów, katalizowane przez dehydrogenazy współdziałające z NAD.
Łańcuch oddechowy może zostać zablokowany w miejscu transportu elektronów między cytochromem b a cytochromem c przez antymycynę A, dimerkaptopropanol oraz naftochinony. Ostatni etap transportu elektronów przez oksydazę cytochromową bardzo skutecznie blokuje KCN oraz CO. Antybiotyk oligomycyna blokuje łańcuch oddechowy oraz fosforylację oksydacyjną nawet w nienaruszonych mitochondriach.
Wyzwalanie energii podczas transportu elektronów
Pary oksydacyjno-redukcyjne
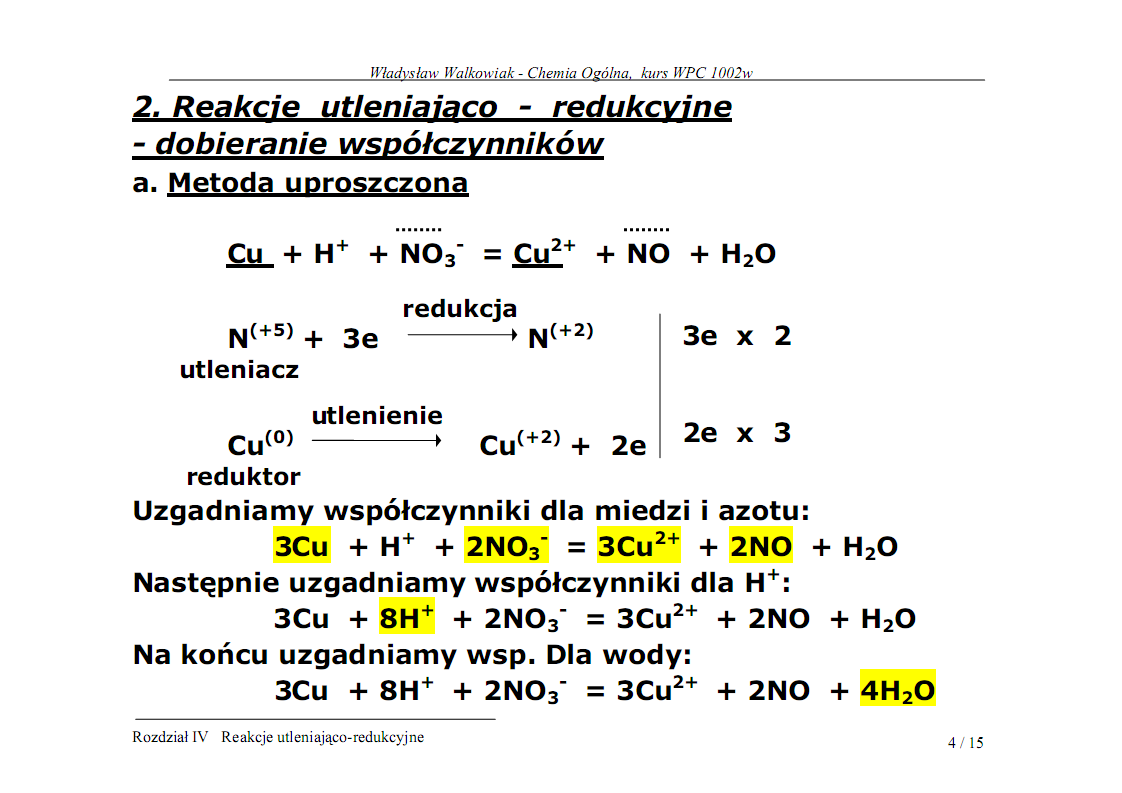
W Każdej reakcji utleniania - redukcji liczba elektronów oddanych przez atom jednego pierwiastka(reduktora) musi być równa liczbie elektronów pobranych przez atom drugiego pierwiastka (utleniacza). Zachodzi zmiana stopni utlenienia reagentów.
Każdą reakcję redoks można rozpisać na pojedyncze akty utleniania i redukcji, które są nazywane reakcjami połówkowymi, przy czym bilans elektronowy i masowy tych aktów musi być zerowy. Takie rozpisanie reakcji redoks pomaga zrozumieć, co się właściwie dzieje w jej trakcie, warto jednak pamiętać, że pojedyncze akty redukcji i utleniania nie są opisem zjawisk, które rzeczywiście zachodzą w jej trakcie, lecz tylko teoretycznym zapisem zmian stopnia utlenienia poszczególnych atomów i grup.
Rzeczywisty mechanizm danej reakcji jest zwykle dużo bardziej złożony. Dla odróżnienia tych pojedynczych aktów redukcji i utlenienia od faktycznych reakcji używa się zwykle do ich zapisu znaku "=" a nie "→". W zapisie tym symbol "e-" oznacza przekazanie lub przyjęcie elektronu, jednak nie w sensie dosłownym, lecz takim jaki jest przyjęty w definicji stopnia utlenienia. Podobnie liczby występujące w górnych indeksach tych równań nie oznaczają faktycznego ładunku jaki przyjmują dane atomy lub grupy lecz właśnie ich wyjściowy i końcowy stopień utlenienia.
Pierwiastek lub związek chemiczny będący w analizowanej reakcji redoks donorem (dawcą) elektronów nazywany jest reduktorem, zaś substancja będąca akceptorem elektronów nazywana jest utleniaczem.
Przykład bilansu redoks:
Reakcja sumaryczna:
O2 + C → CO2
Reakcja połówkowa redukcji:
Reakacja połówkowa utlenienia:
Standardowy potencjał redukcyjny (E0)
Każde półogniwo ma określoną wartość potencjału redukcyjnego, który wyraża się wzorem Nersta :

Zależność między entalpią swobodną a siłą elektromotoryczną
SEM - różnica potencjałów zmierzona w warunkach równowagi reakcji.
np.
utlenianie : 5Fe(2+) - 5e = 5Fe(3+) E = 0,77 V
redukcja : MnO4(-) + 5e + 8H(+) = Mn(2+) + 4H2O E = 1,51 V
zapis ogniwa
Pt | Fe(3+), Fe(2+) || Mno4(-), Mn(2+), H(+) | Pt
SEM = 1,151 V - 0,77 V = 0,74V
Pomiędzy SEM, a entalpią swobodną występuje zależność :
ΔG = - nFSEM
gdzie
F = stała Faradaya = 96485 C/mol
n = liczba elektronów różniąca formę zredukowaną od wyjściowej
Równania okso-redukcyjne

Fosforylacja oksydacyjna
szlak metaboliczny, w wyniku którego energia uwalniana podczas utleniania zredukowanych nukleotydów przekształcana jest w energię ATP.
podczas f. oksydacyjnej, w wyniku szeregu reakcji redoks, elektrony przenoszone są ze zredukowanych nukleotydów NADH+ i FADH2 na pełniący funkcję akceptora elektronów tlen. Reakcje te prowadzą do zmagazynowania energii służącej następnie do syntezy ATP.
łańcuch oddechowy - zestaw enzymów biorących udział w przenoszeniu elektronów.
Energia uwalniana podczas transportu elektronów w łańcuchu oddechowym zużywana jest do przenoszenia protonów przez wewnętrzną błonę mitochondrialną, proces ten przez jego odkrywcę został nazwany chemiosmozą. Energia potencjalna gromadzona jest w postaci gradientu pH i potencjału elektrycznego w poprzek błony. Zgromadzona w tej formie energia wykorzystywana jest przez kompleks enzymatyczny syntazy ATP, który pozwala protonom przejść przez błonę zgodnie z gradientem stężeń. Enzym ten zamienia jednocześnie energię gradientu pH i elektrycznego na energię wiązań chemicznych ATP, wytwarzanego przez przyłączenie do ADP reszty kwasu ortofosforowego, czyli reakcji fosforylacji. Niezwykłość reakcji syntezy ATP związana jest z obracaniem się części enzymu napędzanej przepływającymi protonami, przypominając działanie silnika elektrycznego. Obrót części enzymu odłącza wytworzoną cząsteczkę ATP.
jest ważnym procesem metabolicznym, ale w jej wyniku powstają reaktywne formy tlenu, takie jak nadtlenek wodoru oraz wolne rodniki niszczące komórki, więc powodujące choroby i prawdopodobnie przyspieszające procesy starzenia się
Czynniki regulujące oddychanie komórkowe
Szybkość przemian zachodzących podczas glikolizy regulowana jest przez kilka enzymów. Miejscem kontroli są w różnym stopniu wszystkie enzymy przeprowadzające reakcje nieodwracalne.
1. fosfofruktokinaza - hamuje ją wysoki poziom ATP oraz jonów H+ pojawiających się podczas fermentacji mlekowej; pozytywny regulator - AMP
2. heksokinaza - hamowana przez glukozo - 6 - fosforan
3. kinaza pirogronianowa - hamowany jest przez ATP, a aktywowany przez fruktozo-1,6-bisfosforan
4. dehydrogenaza pirogronianowa - reguluje zachodzenie reakcji w mitochondriach. Kompleks dehydrogenazy pirogronianowej zawiera dwa enzymy niebiorące udziału w przekształcaniu pirogronianu do acetylo-CoA, a jedynie regulujące aktywność całego kompleksu. Kinaza dehydrogenazy pirogronianowej poprzez przyłączenie fosforanu hamuje aktywność kompleksu. Do fosforylacji dochodzi, gdy w mitochondriach znajduje się duża ilość ATP, a więc zapotrzebowanie na energie jest pokryte w wystarczającym stopniu. Gdy ilość ATP w mitochondriach ulega zmniejszeniu, kompleks dehydrogenazy ulega aktywacji poprzez odłączenie fosforanu przez fosfatazę P-PDH, która jest trwale powiązana z kompleksem. Dzięki kinazie i fosfatazie kluczowy dla reakcji mitochondrialnych enzym może być "włączany" i "wyłączany" zależnie od zapotrzebowania komórki na energię. Fosforylacja kompleksu zależy także od stosunku NADH/NAD+ oraz acetylo-CoA/CoA. Aktywność kompleksu regulują więc także produkty reakcji przez niego katalizowanej. Zależność taka jest ważna, ponieważ cykl Krebsa nie służy jedynie do produkcji energii użytecznej metabolicznie, ale także do wytwarzania metabolitów użytecznych w wielu procesach syntezy zachodzących w komórce (np. syntezie aminokwasów). Także sam przebieg cyklu Krebsa jest regulowany. Dehydrogenaza izocytrynianowa podlega stymulacji allosterycznej przez ADP. Zwiększenie aktywności enzymu powodują także NAD+ oraz jony Mg2+. ATP zaś pełni funkcję inhibitora enzymu. Kontrola obejmuje także dehydrogenazę α-ketoglutaranu. Jej aktywność ulega obniżeniu, gdy wzrasta stężenie produktów katalizowanej reakcji NADH i bursztynylo-CoA oraz podnosi się poziom ATP
Wyszukiwarka