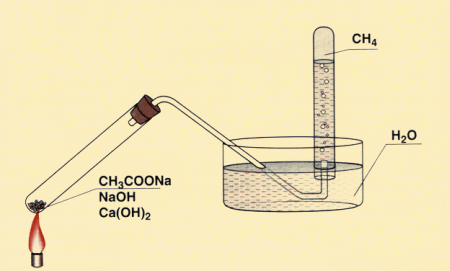
3. Ogrzewanie mieszaniny octanu sodu z wodorotlenkiem sodu (dekarboksylacja) :
CH3COONa + NaOH → CH4 + Na2CO3
OTRZYMYWANIE METANU
Metan występuje w przyrodzie jako podstawowy składnik gazu ziemnego, gazu „błotnego” oraz biogazu.
Synteza z pierwiastków (reakcja ta zachodzi w temperaturze 5000 C).:
C + 2H2 → CH4

3. Ogrzewanie mieszaniny octanu sodu z wodorotlenkiem sodu (dekarboksylacja) :
CH3COONa + NaOH → CH4 + Na2CO3
reakcja węglika glinu z kwasem (np.solnym):
Al4C3 + 12HCl → 4AlCl3 + 3 CH4
reakcja węglika glinu z wodą:
Al4C3 + 12H2O → 4Al(OH)3 + 3 CH4
6. Synteza Fischera-Tropscha - jest to metoda polegająca na otrzymywaniu alkanów i alkenów z gazu syntezowego (mieszaniny tlenku węgla II oraz wodoru). Reakcja ta wymaga wielu katalizatorów są to tlenki metali : żelaza, kobaltu, rutenu i niklu. W przemyśle najczęściej używane są ze względów ekonomicznych związki żelaza i kobaltu.
CO + 3H2 --Q, Ni--> CH4 + H2O
Ogólnie: n CO + (2n + 1)H2 __Co(ThO2)MgO, 200°C__> CnH2n+2 + nH2O
OTRZYMYWANIE INNYCH ALKANÓW :
1. Uwodornienie węglowodorów nienasyconych :
− alken + H2 → alkan
− alkin + 2H2 → alkan
katalizatorami w powyższych reakcjach są najczęściej: Pt, Pd, Ni.
Inne alkany, w tym również metan, można otrzymać w reakcji dekarboksylacji soli kwasów karboksylowych:
![]()
3. Synteza Würtza - reakcja chlorowcopochodnych węglowodorów alifatycznych z sodem, która prowadzi do powstania wyższych węglowodorów (składających się z reszt wyjściowych chlorowcopochodnych) oraz halogenków sodu.
Np.:2CH3-Cl + 2Na → CH3-CH3 + 2NaCl
4. Kraking - Jest to reakcja mająca na celu rozkład cząsteczek weglowdorów na mniejsze cząsteczki - przebiega w temperaturze 400-600oC i w obecności katalizatora.
alkan --> H2 + alkany o mniejszych czasteczkach + alkeny
OTRZYMYWANIE ETYLENU
Eten można otrzymać przez termiczny rozkład polietylenu.
(CH2-CH2)n _ → n CH2 = CH2
Przebieg i opis doświadczenia:
Odczynniki: polietylen
Sprzęt: probówka z boczną rurką odprowadzającą, zlewka, probówka do zbierania gazu
Przebieg doświadczenia
Do probówki z boczną rurką wrzucamy kawałek pociętej folii polietylenowej, na przykład woreczka foliowego. Następnie dno probówki ogrzewamy energicznie płomieniem palnika i zbieramy wydzielający się gaz.
Spostrzeżenia jakich powinien dokonać uczeń: W wyniku ogrzewania polietylenu nastąpiło wydzielanie się gazu.
Wnioski jakie powinien sformułować uczeń: Powstającym gazem jest węglowodór nienasycony — eten.
Piroliza ( rozkład w wysokiej temperaturze ) metanu:
2CH4 - temp-→ C2 H2 + 3H2
Odwodnienie etanolu:
C2H5OH Al2O3 C2 H4 + H2O
4. Reakcja eliminacji:
fluorowca z difluorowcoalkanów - ( dwa atomu fluorowca znajdują się przy sąsiednich atomach węgla)
C2H4Cl2 + Zn → C2 H4 + ZnCl2
CH2-CH2 + Zn → CH2=CH2 + ZnCl2
Cl Cl
- fluorowcowodoru z monofluorowcoalkanu (w alkoholowych roztworach zasad)
C2H5Br + KOH ![]()
C2H4 + KBr + H2O
C2H5Cl + KOH ![]()
C2 H4 + KCl + H2O
OTRZYMYWANIE INNYCH ALKENÓW
Otrzymywanie alkenów opiera się przede wszystkim na reakcji eliminacji
1. Odwodnienie alkoholi - reakcja wymaga obecności kwasu i ciepła
CH3-CH2-OH → CH2=CH2 + H2O
Odszczepienie chlorowcowodorów
CH3−CH−CH3 + NaOH → CH2=CH−CH3 + NaBr + H2O
│
Br
3. Odszczepienie chlorowców
CH3-CHBr-CH2Br + Zn → CH3-CH=CH2 + ZnBr2
OTRZYMYWANIE ACETYLENU
Acetylen C2H2 na skalę przemysłową i laboratoryjnie otrzymuje się w reakcji
hydrolizy węglika wapniowego (karbidu)
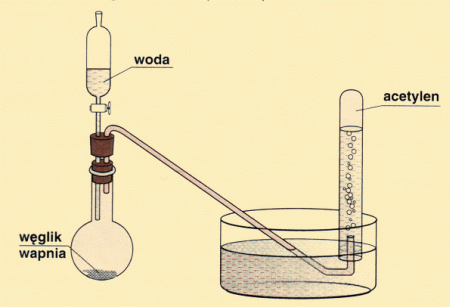
CaC2 + 2H2O --> C2H2 + Ca(OH)2
Spostrzeżenia jakich powinien dokonać uczeń: Po dodaniu do węgliku wapnia wody, nastąpiła gwałtowna reakcja chemiczna, w wyniku której wydzielał się bezbarwny gaz.
Wnioski jakie powinien sformułować uczeń: W wyniku reakcji węgliku wapnia z wodą powstaje etyn, w myśl równania reakcji:
CaC2 + 2H2O → Ca(OH)2 + C2H2
2. syntezy z pierwiastków
2C + H2 <=> C2H2 - reakcja silnie egzotermiczna,
3. z metanu (temperatura 1500oC)
2CH4 --> C2H2 + 3H2
OTRZYMYWANIE ALKINÓW
Oderwanie czterech atomów fluorowca od tetrahalogenków
Od pochodnej alkanu mającej dwa atomy fluorowca przy sąsiednich atomach węgla
można oderwać dwie cząsteczki fluorowcowodoru