![]()
(4)
Numer ćwiczenia : 2 |
Temat ćwiczenia : Ogniwa chemiczne |
Data wykonania : 3.03.2003 |
Grupa : 4 Zespół : B |
Wykonawcy ćwiczenia : Szymon Kowalski Tomasz Pierzyński |
Ocena : |
Cel ćwiczenia
Celem ćwiczenia jest zmierzenie siły elektromotorycznej (SEM) ogniw Daniella o różnych stężeniach roztworów oraz wyznaczenie iloczynu rozpuszczalności trudnorozpuszczalnej soli srebra (np. AgCl, AgI, AgSCN) na podstawie pomiarów SEM ogniwa miedziowo-srebrowego podczas miareczkowania roztworu AgNO3 roztworem odpowiedniej soli (np. KCl, KI, KSCN).
Wprowadzenie
Metal M zanurzony do roztworu swoich jonów Mn+ tworzy układ zwany półogniwem lub elektrodą Mn+/M. Na powierzchni metalu zachodzą równocześnie dwa procesy: proces przechodzenia atomów (w postaci jonów) z metalu do roztworu oraz proces przeciwny, wydzielanie jonów z roztworu na powierzchni metalu (w postaci atomów). W procesach tych biorą udział elektrony metalu, które są przenoszone pomiędzy fazą metaliczną a jonami w roztworze. Jeżeli reakcja elektrodowa przebiega według równania:
Mn+ + ne- = M (1)
to elektroda metaliczna ładuje się do pewnego potencjału. Elektroda, na której powierzchni przebiega proces przedstawiany reakcją (1), stanowi przykład elektrody reagującej chemicznie z roztworem. Istnieją jednakże elektrody, w których metal (zwykle obojętny chemicznie, np. platyna) stanowi jedynie źródło elektronów dla procesu elektrodowego biegnącego z udziałem substancji rozpuszczonych w roztworze. Jeżeli postać utlenioną substancji oznaczymy skrótowo przez Ox, zaś postać zredukowaną przez Red, to reakcję elektrodową zachodzącą na powierzchni obojętnego metalu można przedstawić w postaci:
Ox + ne- = Red (2)
Podobnie jak potencjału wewnętrznego fazy, tak i potencjału pojedynczego półogniwa (elektrody) nie można zmierzyć. Zmierzyć można jedynie różnicę potencjałów między dwiema elektrodami. Układ złożony z dwóch elektrod nazywamy ogniwem galwanicznym lub krótko ogniwem. W elektrochemii budowę ogniwa przedstawia się za pomocą schematu, który dla ogniwa Daniella jest następujący:
(-) Zn | Zn SO 4 || CuSO4 | Cu (+)
Znaki (-) i ( + ) oznaczają odpowiednio elektrodę ujemną i dodatnią ogniwa. Kreska pionowa | oznacza granicę faz, zaś znak || oznacza obecność tzw. klucza elektrolitycznego, wstawianego do ogniwa celem eliminacji potencjału dyfuzyjnego, występującego na granicy dwóch roztworów. Według konwencji sztokholmskiej siła elektromotoryczna ogniwa jest równa, co do wielkości i co do znaku, potencjałowi elektrycznemu prawego przewodnika metalicznego, gdy - przy otwartym ogniwie - potencjał elektryczny takiego samego przewodnika po stronie lewej wynosi umowne zero.
Źródłem SEM ogniwa jest reakcja elektrochemiczna będąca sumą reakcji zachodzących na poszczególnych elektrodach. W ogniwie Daniella reakcje elektrodowe są następujące:
(+) : Cu 2+ + 2e- = Cu
(-): Zn = Zn 2+ + 2e-
Ich suma daje reakcję elektrochemiczną ogniwa:
Cu 2+ + Zn = Zn 2+ + Cu (3)
SEM ogniwa zależy od stężeń reagentów oraz parametrów zewnętrznych (ciśnienia i temperatury). Zależność SEM od stężeń (ściślej od aktywności) reagentów przedstawia równanie Nernsta. Rozważmy ogniwo, w którym przebiega reakcja:
aA + bB + ... = lL + mM + ....
Zmiana entalpii swobodnej reakcji wynosi:
![]()
(4)
gdzie np. μL oznacza potencjał chemiczny składnika L:
![]()
(5)
zaś μLo , aL oznaczają odpowiednio standardowy potencjał chemiczny składnika L i jego aktywność. Korzystając z wyrażenia (5) można równanie (4) przedstawić w postaci:
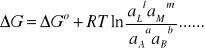
(6)
Ponieważ praca maksymalna ogniwa ΔG i praca elektryczna ogniwa są równoważne:
![]()
(7)
gdzie n- liczba elektronów biorących udział w reakcji ogniwa,
F- stała Faradaya,
E - SEM
z równań (6) i (7) otrzymujemy równanie Nernsta:
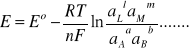
(8)
W równaniu Nernsta E0 oznacza tzw. standardową SEM ogniwa równą:
![]()
(9)
zaś symbole ai oznaczają aktywności reagentów.
Opracowanie wyników
1. OGNIWO DANIELLA
Lp. |
Stężenie roztworów [ M ] |
Rodzaj ogniwa |
Eteor [ V ] |
Edośw [ V ] |
Edośwśrednie [ V ] |
1. |
0,1 ZnSO4 0,1 CuSO4 |
Zn/ZnSO4/KCl/CuSO4/Cu |
1,1003 |
1,077 1,079 1,079 1,080 1,083 |
1,0796
|
2. |
0,5 ZnSO4 0,5 CuSO4 |
Zn/ZnSO4/KCl/CuSO4/Cu |
1,1003 |
1,084 1,085 1,087 1,089 1,089 |
1,0868
|
3. |
1,0 ZnSO4 1,0 CuSO4 |
Zn/ZnSO4/KCl/CuSO4/Cu |
1,1003 |
1,094 1,096 1,097 1,099 1,100 |
1,0972
|
4. |
0,1 ZnSO4 1,0 CuSO4 |
Zn/ZnSO4/KCl/CuSO4/Cu |
1,1144 |
1,107 1,107 1,106 1,105 1,105 |
1,106
|
5. |
1,0 ZnSO4 0,1 CuSO4 |
Zn/ZnSO4/KCl/CuSO4/Cu |
1,0862 |
1,076 1,075 1,077 1,079 1,079 |
1,0772
|
WYZNACZAM TEORETYCZNE SEM OGNIWA DANIELLA :
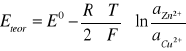
gdzie :
E0 - standardowa SEM ogniwa
F - stała Faradaya równa 96493 C
R - stała gazowa równa 8,314 J/ mol*K
aZn2+ - aktywność jonów cynkowych
aCu2+ - aktywność jonów miedziowych
T = 298 K
1.E0 = E0Cu - E0Zn
E0Cu = 0,339 [ V ]
E0Zn = -0,7611 [ V ]
E0 = 0,339 - ( -0,7611 ) = 1,1001 V
aZn2+ = f * c
gdzie :
f - współczynnik aktywności jonów Zn2+ równy 0,206 dla stężenia 0,1 M
c - stężenie roztworu ZnSO4 równe 0,1 M
aZn2+ = 0,206 * 0,1 = 0,0206 mol/dm3
aCu2+ = f * c
gdzie :
f - współczynnik aktywności jonów Cu2+ równy 0,210 dla stężenia 0,1 M
c - stężenie roztworu CuSO4 równe 0,1 M
aCu2+ = 0,210 * 0,1 = 0,021 mol/dm3
Eteor = 1,1001 - [ ( 8,314 * 298 ) / ( 2 * 96493 ) ] * ln [ 0,0206 / 0,021 ] = 1,1003 V
Ed = Eteor - Edośwśrednie [ V ]
Ed - potencjał dyfuzyjny
Ed = 1,1003 - 1,0796 = 0,0207 V
E0 = 1,1001 V
aZn2+ = 0,102 * 0,5 = 0,051 V
aCu2+ = 0,104 * 0,5 = 0,052 V
Eteor = 1,1003 V
Ed = 1,1003 - 1,0868 = 0,0135 V
E0 = 1,1001 V
aZn2+ = 0,0620 * 1,0 = 0,062 mol/dm3
aCu2+ = 0,0630 * 1,0 = 0,063 mol/dm3
Eteor = 1,1003 V
Ed = 1,1003 - 1,0972 = 0,0031 V
E0 = 1,1001 V
aZn2+ = 0,206 * 0,1 = 0,0206 V
aCu2+ = 0,063 * 1,0 = 0,063 V
Eteor = 1,1144 V
Ed = 1,1144 - 1,106 = 0,0084 V
5. E0 = 1,1001 V
aZn2+ = 0,0620 * 1,0 = 0,062 mol/dm3
aCu2+ = 0,210 *0,1 = 0,021 mol/dm3
Eteor = 1,0862 V
Ed = 1,0862 - 1,0772 = 0,009 V
2. OGNIWO MIEDZIOWO - SREBROWE
Edośw [ V ] |
Edośwśrednie [ V ] |
Eteor [ V ] |
0,373 0,370 0,372 0,371 0,371 |
0,3714 |
0,3748 |
OBLICZAM TEORETYCZNE SEM OGNIWA MIEDZIOWO - SREBROWEGO :
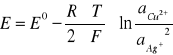
gdzie :
aCu2+ - aktywność jonów miedzi
aAg+ - aktywność jonów srebra
aCu2+ = 0,0630 * 1,0 = 0,063 mol/dm3
aAg+ = 0,901 * 0,01 = 0,00901 mol/dm3
E0 = E0Ag - E0Cu
E0Ag = 0,799 V
E0Cu = 0,339 V
E0 = 0,46 V
E = 0,3748 V
WYZNACZAM OBJĘTOŚĆ VKCl W PUNKCIE RÓWNOWAŻNIKOWYM
Stężenie KCl [ M ] |
Objętość VKCl [ ml ] |
E [ V ] |
dV |
dE |
dE/dV |
dV2 |
dE2 |
d2E |
d2E/dV2 |
0,1 |
1,5 |
0,36 |
0,5 |
0,003 |
0,006 |
0,25 |
0,000009 |
0,000007 |
0,000028 |
0,1 |
2 |
0,357 |
0,5 |
0,004 |
0,008 |
0,25 |
0,000016 |
0,000000 |
0,000000 |
0,1 |
2,5 |
0,353 |
0,5 |
0,004 |
0,008 |
0,25 |
0,000016 |
0,000009 |
0,000036 |
0,1 |
3 |
0,349 |
0,5 |
0,005 |
0,01 |
0,25 |
0,000025 |
0,000000 |
0,000000 |
0,1 |
3,5 |
0,344 |
0,5 |
0,005 |
0,01 |
0,25 |
0,000025 |
-0,000009 |
-0,000036 |
0,1 |
4 |
0,339 |
0,2 |
0,004 |
0,02 |
0,04 |
0,000016 |
-0,000012 |
-0,000300 |
0,1 |
4,2 |
0,335 |
0,2 |
0,002 |
0,01 |
0,04 |
0,000004 |
0,000012 |
0,000300 |
0,1 |
4,4 |
0,333 |
0,2 |
0,004 |
0,02 |
0,04 |
0,000016 |
0,000009 |
0,000225 |
0,1 |
4,6 |
0,329 |
0,3 |
0,005 |
0,0167 |
0,09 |
0,000025 |
-0,000021 |
-0,000233 |
0,1 |
4,9 |
0,324 |
0,1 |
0,002 |
0,02 |
0,01 |
0,000004 |
0,000021 |
0,002100 |
0,1 |
5 |
0,322 |
0,2 |
0,005 |
0,025 |
0,04 |
0,000025 |
0,000011 |
0,000275 |
0,1 |
5,2 |
0,317 |
0,2 |
0,006 |
0,03 |
0,04 |
0,000036 |
0,000028 |
0,000700 |
0,1 |
5,4 |
0,311 |
0,2 |
0,008 |
0,04 |
0,04 |
0,000064 |
0,000017 |
0,000425 |
0,1 |
5,6 |
0,303 |
0,2 |
0,009 |
0,045 |
0,04 |
0,000081 |
0,000280 |
0,007000 |
0,1 |
5,8 |
0,294 |
0,2 |
0,019 |
0,095 |
0,04 |
0,000361 |
0,001848 |
0,046200 |
0,1 |
6 |
0,275 |
0,1 |
0,047 |
0,47 |
0,01 |
0,002209 |
-0,001368 |
-0,136800 |
0,1 |
6,1 |
0,228 |
0,1 |
0,029 |
0,29 |
0,01 |
0,000841 |
0,003384 |
0,338400 |
0,1 |
6,2 |
0,199 |
0,1 |
0,065 |
0,65 |
0,01 |
0,004225 |
-0,004000 |
-0,400000 |
0,1 |
6,3 |
0,134 |
0,1 |
0,015 |
0,15 |
0,01 |
0,000225 |
-0,000029 |
-0,002900 |
0,1 |
6,4 |
0,119 |
0,1 |
0,014 |
0,14 |
0,01 |
0,000196 |
-0,000132 |
-0,013200 |
0,1 |
6,5 |
0,105 |
0,1 |
0,008 |
0,08 |
0,01 |
0,000064 |
-0,000028 |
-0,002800 |
0,1 |
6,6 |
0,097 |
0,1 |
0,006 |
0,06 |
0,01 |
0,000036 |
-0,000011 |
-0,001100 |
0,1 |
6,7 |
0,091 |
0,1 |
0,005 |
0,05 |
0,01 |
0,000025 |
-0,000009 |
-0,000900 |
0,1 |
6,8 |
0,086 |
0,1 |
0,004 |
0,04 |
0,01 |
0,000016 |
0,000000 |
0,000000 |
0,1 |
6,9 |
0,082 |
0,2 |
0,004 |
0,02 |
0,04 |
0,000016 |
0,000240 |
0,006000 |
0,1 |
7,1 |
0,078 |
0,9 |
0,016 |
0,0178 |
0,81 |
0,000256 |
-0,000135 |
-0,000167 |
0,1 |
8 |
0,062 |
1 |
0,011 |
0,011 |
1 |
0,000121 |
-0,000072 |
-0,000072 |
0,1 |
9 |
0,051 |
1 |
0,007 |
0,007 |
1 |
0,000049 |
-0,000040 |
-0,000040 |
0,1 |
10 |
0,044 |
0,5 |
0,003 |
0,006 |
0,25 |
0,000009 |
-0,000005 |
-0,000020 |
0,1 |
10,5 |
0,041 |
0,5 |
0,002 |
0,004 |
0,25 |
0,000004 |
0,000000 |
0,000000 |
0,1 |
11 |
0,039 |
0,5 |
0,002 |
0,004 |
0,25 |
0,000004 |
0,000000 |
0,000000 |
0,1 |
11,5 |
0,037 |
0,5 |
0,002 |
0,004 |
0,25 |
0,000004 |
0,000012 |
0,000048 |
0,1 |
12 |
0,035 |
1 |
0,004 |
0,004 |
1 |
0,000016 |
-0,000012 |
-0,000012 |
0,1 |
13 |
0,031 |
1 |
0,002 |
0,002 |
1 |
0,000004 |
|
|
0,1 |
14 |
0,029 |
|
|
|
|
|
|
|
dV = Vn+1 - Vn
dE = En - En+1
d2E = dEn+12 - dEn2
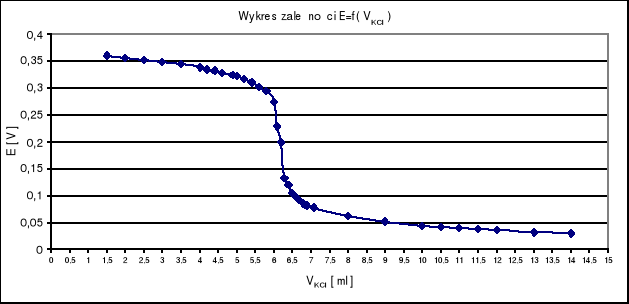
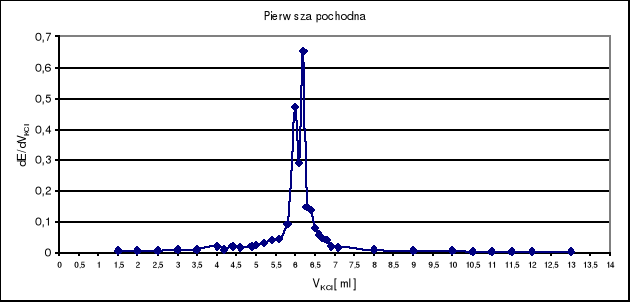
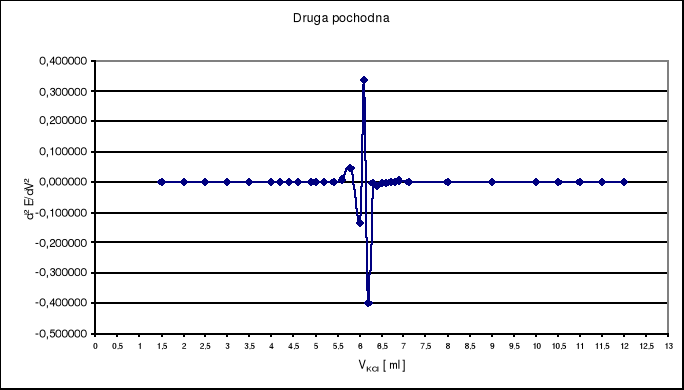
Objętość VKCl w punkcie równoważnikowym odczytuję z wykresu pierwszej i drugiej pochodnej i wynosi ona VKCl = 6,2 ml .
Z wykresu E = f ( VKCl ) odczytuję wartość SEM ogniwa w punkcie równoważnikowym i wynosi ona ER = 0,199 V .
OBLICZAM AKTYWNOŚĆ JONÓW Ag+ PRZY KTÓREJ SEM BADANEGO OGNIWA PRZYJMUJE WARTOŚĆ ZERO :
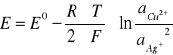
E = 0 V
E0 = 0,46 V
R = 8,314 J / mol * K
T = 298 K
F = 96493 C
aCu2+ = 0,0630 * 1,0 = 0,063 mol/dm3
aAg+ = exp {[ ( E - E0 ) * F /( R * T) ] + [( ln aCu2+ ) / 2 ]}
aAg+ = 4,16 * 10 -9 mol / dm3
WYZNACZAM ILOCZYN ROZPUSZCZALNOŚCI AgCl :
LAgCl = aAg+ * aCl-
gdzie LAgCl to iloczyn rozpuszczalności AgCl
W punkcie równoważnikowym stężenia i aktywności jonów Ag+ i Cl- będą sobie równe . Dlatego iloczyn rozpuszczalności AgCl można przedstawić w następującej postaci :
LAgCl = ( aAg+ )2
Wyznaczam aktywność jonów Ag+ w punkcie równoważnikowym :
aAg+ = exp {[ ( ER - E0 ) * F /( R * T) ] + [( ln aCu2+ )/ 2 ]}
ER = 0,199 V
aAg+ = 9,66 * 10 -6 mol / dm3
LAgCl = ( aAg+ )2
LAgCl = 9,33 * 10-11
WNIOSKI :
Wartości doświadczalne SEM obydwu ogniw różnią się nieznacznie od wartości teoretycznych . Częściowo może to być spowodowane niedokładnością przyrządów , niezbyt dokładnym przeprowadzaniem ćwiczenia . Jednak w głównej mierze jest to spowodowane nie uwzględnieniem potencjału dyfuzyjnego .
Wartość iloczynu rozpuszczalności AgCl wyznaczona w ćwiczeniu wynosi LAgCl = 9,33 * 10-11 i różni się od wartości tablicowej o jeden rząd wielkości (LAgCl = 9,3 * 10-10 - dane tablicowe ) . Jest to spowodowane prawdopodobnie wystąpieniem błędów podczas wykonywania ćwiczenia .