Wykład 2
Rozpuszczalność
określa powinowactwo substancji rozpuszczonej do rozpuszczalnika
miarą rozpuszczalności jest stężenie substancji rozpuszczanej w stanie nasycenia roztworu
ilość części rozpuszczalnika koniecznych do rozpuszczenia 1 cz. Substancji rozpuszczanej
maksymalne stężenie substancji, jakie można uzyskać rozpuszczając ją w danym rozpuszczalniku (np. w g/ml)
Określenie rozpuszczalności |
Rozpuszczalność 1 cz. substancji w x cz. rozpuszczalnika |
|
bardzo łatwo rozpuszczalny |
mniej niż |
1 |
łatwo rozpuszczalny |
|
1-10 |
rozpuszczalny |
|
10-30 |
dość trudno rozpuszczalny |
|
30-100 |
trudno rozpuszczalny |
|
100-1 000 |
bardzo trudno rozpuszczalny |
|
1 000-10 000 |
praktycznie nierozpuszczalny |
więcej niż |
10 000 |
Stopień rozpuszczalności substancji leczniczej wg FP VI
Stałe cząstki => rozpuszczanie => lek w roztworze => wchłanianie => lek we krwi
Klasyfikacja BCS (Biopharm. Classif. System)
Klasa I dobra rozpuszczalność dobre wchłanianie |
Klasa II mała rozpuszczalność dobre wchłanianie |
Klasa III dobra rozpuszczalność słabe wchłanianie |
Klasa IV mała rozpuszczalność słabe wchłanianie |
(slajd DSC07820)
Wzrost szybkości rozpuszczania
substancje mikronizowane
stałe rozproszenia (nośniki hydrofilowe)
nanocząsteczki stabilizowane
proszki porowate, stabilizowane
WZROST ROZPUSZCZALNOŚCI
sole i analogi hydrofilowe
chemiczna modyfikacja cząsteczki
współrozpuszczalniki (kosolwenty)
kopleksowanie z substancjami hydrofilowymi
cyklodekstryny
solubilizacja
solubilizacje hydrotropowe i micelarne
układy micelarne
micelle fosfolipidowe
emulsje submikronowi
mikroemulsje
systemy samoemulgujące
Rozpuszczalność ciał stałych w cieczach zależy od:
rodzaju ciała stałego i rodzaju użytego rozpuszczalnika (similia similibus solvuntur)
temperatury
ln S2/S1=ΔHrozp./R=T2-T1/T1+T2 (wzór może zawierać błąd - przyp. spisującego)
S2, S1 - rozpuszczalność ciała stałego w temperaturze T2 i T1
ΔHrozp. - ciepło rozpuszczania w stanie nasycenia roztworu
Temperatura
Rozpuszczalność może wzrastać (częściej) albo maleć ze wzrostem temperatury, a wpływ na to ma energia oddziaływania substancja rozpuszczona - rozpuszczalnik
Reguła przekory
Proces egzotermiczny - dostarczenie ciepła powoduje przesunięcie równowagi w kierunku mniejszej rozpuszczalności
Proces endotermiczny - rozpuszczalność rośnie wraz ze wzrostem temperatury
Rozpuszczalność zależy od temperatury
Wzrost rozpuszczalności wraz ze wzrostem temperatury - większość soli
Spadek rozpuszczalności wraz ze wzrostem temperatury - np. Na2SO4*10H2O, metyloceluloza
Rozpuszczania niezależna od temperatury - NaCl, K2CrO4
Rozpuszczalność uwodnionego siarczanu sodu rośnie wraz z temperaturą (proces egzotermiczny) i osiąga maks. Przy T= 32,4ºC, powyżej tej temperatury rozpuszczalność maleje gdy rośnie temperatura (proces endotermiczny)
Metyloceluloza rozpuszcza się lepiej w niższych temperaturach, w temp. > 50ºC, na skutek zmniejszenia hydratacji, następuje jej wytrącenie. Roztwory metylocelulozy, tzw. kleiki, sporządza się umieszczając je na pewien czas w temperaturze 4ºC.
Substancje rozpuszczane „na ciepło” w recepturze aptecznej
kwas borny
mleczan etakrydyny (Rivanolum)
chlorowodorek papaweryny
aminofenazon
aminofilina
pabialgina
ichtiol
MIKRONIZACJA
przyjmuje się cząstki poniżej 10 µm
brak definicji w FP VII, Ph.Eur.
definicja z FP VI: 80% cząstek nie większych niż 10 µm, pozostałe nie większe niż 50 µm
definicja z BP 2001: „superfine powder” 90% cząstek nie większych niż 10 µm
Młyny
Kulowy
Strumieniowy - podstawowa metoda mikronizacji wykorzystywana w proszkach inhalacyjnych
Koloidalny - substancje należy zawiesić
Suszenie rozpylone
Metody strąceniowe
Kontrolowane wytrącanie podczas dyfuzji rozpuszczalnika do fazy rozpraszającej
Wytrącanie podczas gwałtownego parowania podczas rozpylania o wody (EPAS)
Metody kriogeniczne - rozpylanie do ciekłego azotu
STAŁE ROZPROSZENIA
Mieszaniny fizycznych substancji trudno rozpuszczalnych z hydrofilowymi nośnikami
nośniki np. makrogol, poliwinylopiralidon, mocznik
zwiększanie rozpuszczalności w wodzie: m.in. kwasu acetylosalicylowego, gryzeofulwiny, papaweryny, nifedypiny
zastosowana metoda decyduje o poprawie szybkości rozpuszczania substancji leczniczej
met. stapiania
met. odparowania
met. stapiania + odparowania
met. suszenia rozpylonego
met. HSM (hot spin mixing)
I. Rozproszenia stałe
układy zawierające substancję leczniczą trudno rozpuszczalną oraz łatwo rozpuszczalny, nietoksyczny i w zastosowanych ilościach pozbawiony własnego działania leczniczego nośnik
cel: poprawa dostępności farmaceutycznej i biologicznej
najdokładniej zbadano: gryzeofulwinę, fenytoinę, indometacynę, hydrokortyzon
II. Rozproszenia stałe
układy zawierające substancję leczniczą łatwo rozpuszczalną w wodzie oraz słabo rozpuszczalny, nietoksyczny i w zastosowanych ilościach pozbawiony własnego działania leczniczego nośnik
cel: uzyskanie przedłużonego działania substancji leczniczej
najdokładniej zbadano: oksprenolol, lidokainę
Dobór właściwego nośnika
makrogole np. 1450, 3000, 4000, 6000, 10000
mała toksyczność, stosunkowo niska temperatura topnienia (możliwość wykorzystania met. stapiania)
tolerancja przez organizmy polepsza się wraz ze wzrostem liczby grup tlenku etylenu w polimerze
PVP
związki azotowe: mocznik, nikotynamid
kwasy: cytrynowy, bursztynowy, cholowy, dezoksycholowy
cukry: dekstroza, mannitol, sorbitol, ksylitol
pochodne celulozy: etyloceluloza, hydroksypropyloceluloza, hydroksypropylometyloceluloza
Zmiana pH roztworu - tworzenie soli
większość substancji leczniczych to słabe kwasy lub słabe zasady - ich rozpuszczalność zależy od pH rozpuszczalnika
przez dobór odpowiedniego pH i w konsekwencji tworzenie soli, można zwiększyć rozpuszczalność tych substancji nawet 1000-krotnie
Zasada/kwas |
Rozp. |
Sól kwasu/sól zasady |
Rozp. |
Papaweryna |
1:50 000 |
Chlorowodorek papaweryny |
1:40 |
Prokaina |
1:770 |
Chlorowodorek prokainy |
1:1 |
Fenobarbital |
1:5 000 |
Fenobarbital sodu |
1:1,5 |
Kwas acetylosalicylowy |
1:300 |
ASA/CaCO3 (Calcipiryna) |
1:4 |
(nie do nauki, jako obraz tego co było napisane na slajdzie)
Chemiczna modyfikacja cząsteczki
wprowadzenie do cząsteczki substancji leczniczej grup hydrofilowych ułatwiających rozpuszczanie
karboksylowych
aminowych
amidowych
hydroksylowych
sulfonowych
polioksyetylenowych
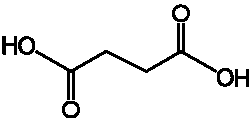
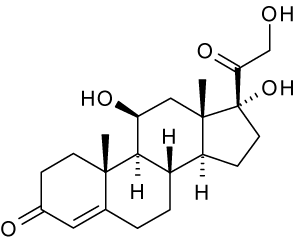
kwas bursztynowy
<= hydrokortyzon - praktycznie nierozpuszczalny w wodzie
Ester wodorobursztynian hydrokortyzonu
+ NaOH
Sól sodowa wodorobursztynianu hydrokortyzonu =>łatwo rozpuszczalny w wodzie (1:3)
spadek rozpuszczalności spowodowany wiązaniami wodorowymi wolnych grup hydroksylowych
celuloza - liniowy polimer glukozy, w którym wolne reszty hydroksylowe biorą udział w tworzeniu wiązań wodorowych pomiędzy łańcuchami celulozy, co sprawia, że celuloza jest nierozpuszczalna w wodzie
zwiększenie rozpuszczalności wymaga zmniejszenia ilości wiązań wodorowych, przez podstawienie grup hydroksylowych (metyloceluloza, hydroksypropyloceluloza)
KOMPLEKSOWANIE ZWIĄZKÓW LECZNICZYCH Z SUBSTANCJAMI HYDROFILOWYMI
płyn Lugola (Solutio Lugoli)
wodny roztwór jodu
jod nie rozpuszcza się w wodzie, ale rozpuszcza się w obecności jodku potasu. Powstaje kompleks jodu cząsteczkowego i jodku potasu, po jego dysocjacji w roztworze znajdują się jony K+ i I3-
Povidone - lodine
połączenie kompleksowe jodu z poliwinylopirolidonem
PVP ułatwia rozpuszczalność w wodzie i wnikanie jodu do wnętrza komórek drobnoustrojów
Betadine, globulki dopochwowe (20 mg), maść (100mg/g), roztwór do stosowania zewnętrznego (100 mg J/ml)
Braunovidon - maść (100mg/g)
Polodina-R - roztwór do stosowania zewnętrznego (100 mg/g)
Polseptol - maść (100 mg/g), globulki dopochwowe (20 mg)
PV lod - krem (100mg/g), roztwór (100 mg/g)
PVP - lodine - krem (100 mg/g)
KOMPLEKSOWANIE Z CYKLODEKSTRYNAMI
Naturalne α, β, γ cyklodekstryny
otrzymywane przez enzymatyczną degradację skrobi
cykliczne oligosacharydy zbudowane z 6, 7 lub 8 cząsteczek glukozy, związanych w strukturę o kształcie stożka ściętego
zewnętrzna powierzchnia stożka ma charakter hydrofilowy
na węższej podstawie przy węglach C6 - I-rzędowe grupy -OH
na szerszej podstawie przy węglach C2 i C3 - II-rzędowe grupy -OH
wnętrze stożka jest puste i ma charakter hydrofobowy, za który odpowiedzialny są atomy wodoru oraz atomy tlenu w położeniu 4,5
CD o liczbie mniejszej niż 6 nie mogą istnieć z przyczyn sferycznych a 9 członowa δ-CD o kształcie zdeformowanego cylindra, jest najbardziej podatna na hydrolizę i kompleksuje jedynie większe cząsteczki leków, np. spironolakton i digitoksyna
są słabo rozpuszczalne w wodzie np. β-CD 1,85g/100ml
wiązania wodorowe między grupami -OH w obrębie poszczególnych cząsteczek Glu w pierścieniu
wiązania wodorowe między grupami -OH cząsteczek sąsiadujących ze sobą
przeprowadza się modyfikację cząsteczek CD przez podstawienie wolnych grup -OH
Zalety kompleksów inkluzyjnych
zwiększenie rozpuszczalności substancji leczniczej
liniowa zależność między rozpuszczalnością a stężeniem cyklodekstryny
w trakcie rozcieńczania skompleksowanego leku nie wytrąca się osad
zwiększenie trwałości substancji leczniczej
zwiększenie dostępności biologicznej leku
obniżenie lotności substancji leczniczej
ograniczenie działania drażniącego
zmniejszenie toksyczności substancji leczniczej
korekta smaku
Warunki utworzenia kompleksu
jej rozpuszczalność w wodzie powinna być mniejsza niż 10 mg/ml
jej temperatura topnienia nie powinna przekraczać 250ºC
cząsteczka nie może się składać z więcej niż pięciu skondensowanych pierścieni
jej masa molowa powinna się mieścić w granicach 100-400
Bezpieczeństwo stosowania
p.o.
bezpieczne, praktycznie nie wchłaniane z przewodu pokarmowego
s.c., i.m.
mogą powodować martwicę w miejscu wstrzyknięcia
i.v.
mogą kumulować się w komórkach nabłonka proksymalnej części kanalików nerkowych powodując ostre stany zapalne
mogą wywołać hemolizę (mają wysokie powinowactwo do lipidów i usuwają fosfolipidy, cholesterol i proteiny z powierzchni erytrocytów)
można przeciwdziałać tym działaniom modyfikacją chemiczną ich cząsteczek, zmianą wymiarów wnęki itp.
Pochodne hydroksypropylowe
bardzo dobrze rozpuszczalne w wodzie (>50%)
wraz ze wzrostem stopnia podstawienia rośnie aktywność powierzchniowa, a maleje aktywność hemolityczna
mogą być stosowane w preparatach do iniekcji oraz na błony śluzowe
digoksyna, digitoksyna, chlorambucil, melfalan, ASA, doksorubicyna, omeprazol, hormony steroidowe
Pochodne hydroksyetylowe
niska aktywność hemolityczna, nie wykazują aktywności powierzchniowej, nawet w dużych stężeniach nie drażnią tkanki mięśniowej
fenytoina, diazepan, hydroksychlorotiazyd, ibuprofen, digoksyna
Rozgałęzione cyklodekstryny
podstawione mono- i disacharydami (glukoza, maltoza), słabsze właściwości solubilizowania innych cząstek
wykorzystywane w preparatach parenteralnych: kompleksy nie ulegają wytrąceniu nawet w dużych stężeniach cyklodekstryn
diazepam, nifedypina, nisoldypina, fenytoina, prednizolon, progesteron, testosteron, pochodne 5-fluorouracylu, prostaglandyna E-1
Polimery cyklodekstryn
usieciowione epoksydami, głównie epichlorohydryną, używane przede wszystkim jako substancje rozsadzające do tabletek, poprawiają szybkośc rozpuszczania i wchłanianie
fenytoina
Pochodne etylowe
stosowane jako nośniki hydrofobowe w celu obniżenia rozpuszczalności substancji hydrofilowych łatwo rozpuszczalnych w wodzie, w efekcie uzyskanie przedłużonego działania leku
diltiazem, indometacyna
Pochodne metylowe
całkowicie nietoksyczne po podaniu doustnym (niewchłaniane z przewodu pokarmowego), po podaniu podskórnym i domięśniowym może wystąpić martwica w miejscu wstrzyknięcia, po podaniu dożylnym istnieje niebezpieczeństwo kumulacji w komórkach nabłonka proksymalnej części kanalików nerkowych
pochodne dimetylowe - dobrze rozpuszczalne w wodzie, całkowicie wydalane do moczu, wysoka aktywność hemolityczna
pochodne trimetylowe - łatwo krystalizują - groźne stany zapalne w kanalikach nerkowych, wysoka aktywność hemolityczna
zwiększenie rozpuszczalności: indometacyna, progesteron, maślan hydrokortyzonu, pochodne benzodiazepiny
zwiększenie trwałości: daunorubicyna, prostaglandyny, chlorambucil
obniżenie trwałości: ASA, mitomycyna
zwiększenie dostępności biologicznej: fluorbiprofen, pochodne 5-fluorouracylu, chlorambucil, insulina, ketoprofen
Kompleks lek dekstryna jest uważany za nowy lek , a taki podlega pełnej procedurze rejestracji.
W jakim celu stosuje się cyklodekstryny?
aby zwiększyć rozpuszczalność
aby zwiększyć skuteczność leku
by zwiększyć przenikanie leku przez błony i dostępność biologiczną
aby uzyskać fizyczną stabilność leku
aby przekształcić leki płynne w mikrokrystaliczne proszki
aby zapobiec interakcjom lek-lek
aby zmniejszyć miejscowe działanie drażniące
Współrozpuszczalniki (kosolweny)
wprowadzanie do roztworu rozpuszczalników innych niż woda i jednocześnie mieszających się z wodą
najczęściej etanol (iniekcje, 250 g/l), glikol propylenowy (iniekcje 70g/l), makrogol, glicerol
metoda często stosowana w recepturze aptecznej oraz w preparatyce roztworów do wstrzykiwań
istotne jest aby lek rozpuścić w jak najmniejszej objętości rozpuszczalnika, ale jej całkowite zastąpienie jest niemożliwe
SOLUBILIZACJA HYDROTROPOWA I SOLUBILIZACJA MICELARNA
Solubilizator - substancja pośrednicząca w rozpuszczaniu związków słabo rozpuszczalnych w wodzie. Umożliwia uzyskanie roztworów o stężeniu przekraczającym stężenie nasyconych roztworów tychże substancji
najczęściej stosowane: mocznik i jego pochodne, dimetyloacetamid, benzoesan sodu, polisorbaty (Tween)
Solubilizacja hydrotropowa
Polega na zastosowaniu związków hydrofilowych, które zwiększają rozpuszczalność substancji leczniczej w wodzie przez tworzenie słabych asocjatów, z cząsteczkami substancji rozpuszczanej
estrów, eterów, amidów, cukrów, alkoholi wielowodorotlenowych, kwasów organicznych i ich soli
Cząsteczki substancji rozpuszczanej zyskują dzięki temu grupy hydrofilowe (OH, COOH, NH2, CO) pochodzące z cząsteczek solubilizatorów i stają się bardziej rozpuszczalne w wodzie
Solubilizacja micelarna
polega na zastosowaniu związków powierzchniowo czynnych rozpuszczalnych w wodzie
tworzą one w wodzie micele kierując
grupy hydrofilowe na zewnątrz, w kierunku fazy wodnej
grupy lipidowe do wnętrza miceli
solubilizacja zachodzi prawdopodobnie przede wszystkim w micelach typu palisadowego
HLB - hydrophilic-lipophilic- balance
liczba określa udział grup hydrofilowych i lipofilowych w cząsteczce
w zależności od wartości liczby HLB tenzydy mogą być lepiej rozpuszczalne w wodzie lub tłuszczach
wraz ze wzrostem liczby HLB rosną właściwości hydrofilowe
w procesie solubilizacji micelarnej stosuje się tenzydy dobrze rozpuszczalne w wodzie, o liczbie HLB 14-20 (skala jest 20-stopniowa)
Solubilizatory
w praktyce bardziej praktyczne zastosowanie mają tenzydy niejonowe
mniejsza toksyczność
dają mniej niezgodności z substancjami leczniczymi lub substancjami pomocniczymi
stężenie solubilizatora powinno być większe niż krytyczne stężenie micelarne, ponieważ musi dojść do utworzenia miceli
stężenia s. micelarnych (0,2-5%) są mniejsze niż s. hydrotropowych (nawet 20%)
temperatura przechowywania roztworów solubilizowanych do 5ºC
Stosowane solubilizatory
estry alkoholi i kwasów tłuszczowych
woski pszczele, olbrot, lanolina
estry sorbitanu i wyższych kwasów tłuszczowych (Span)
estry polioksyetylenosorbitanu z kwasami tłuszczowymi
polisorbat - Tween
estry polioksyetylenoglicerolu z kwasai tłuszczowymi
Targat, Cremophor - polioksyetylowany uwodorniony olej racznikowy)
etery wyższych alkoholi tłuszczowych z polioksyetylenoglikolami (Brij)
mydło potasowe (do użytku zewnętrznego) - wypadające z użycia
Solutio Vitamini aquosa
witaminy A, D, E rozpuszczają się w tłuszczach , lecz korzystniejszą postacią dla podania doustnego lub pozajelitowego jest roztwór wodny , który otrzymuje się z użyciem preparatu Tween (polisorbat) jako solubilizatora
w postaci solubilizowanych wodnych roztworów stosuje się też hormony steroidowe, olejki eteryczne, mentol, kamforę, sulfonamidy, czy związki jodu (tzw. jodofory)
Jodofory
eliminacja drażniących właściwości i koloru jodyny
solubilizacja jodu za pomocą poliwinylopirolidonu
powstają połączenia typu klatratów
PVP ułatwia rozpuszczalność w wodzie i wnikanie jodu do wnętrza komórek drobnoustrojów
Szybkość rozpuszczania
Szybkość przenikania przez barierę biologiczną
Wyszukiwarka
Podobne podstrony:
TPL 13x, Recepty, Wyklady TLP
TPL 16x, Recepty, Wyklady TLP
TPL 1x, Recepty, Wyklady TLP
TPL 21x, Recepty, Wyklady TLP
TPL 12x, Recepty, Wyklady TLP
TPL 14x, Recepty, Wyklady TLP
TPL 7x, Recepty, Wyklady TLP
TPL 15x, Recepty, Wyklady TLP
TPL 5x, Recepty, Wyklady TLP
TPL 8x, Recepty, Wyklady TLP
TPL 20x, Recepty, Wyklady TLP
TPL 4x, Recepty, Wyklady TLP
TPL 9x, Recepty, Wyklady TLP
TPL 3x, Recepty, Wyklady TLP
TPL 11x, Recepty, Wyklady TLP
TPL 10x, Recepty, Wyklady TLP
TPL 17x, Recepty, Wyklady TLP
TPL 6x, Recepty, Wyklady TLP
TPL 19x, Recepty, Wyklady TLP
więcej podobnych podstron